茶多酚对精索静脉曲张大鼠睾丸组织氧化应激和细胞凋亡的影响
2015-06-24柯鑫文武政华冯少勇武进峰成建军张建东张雁钢
柯鑫文,武政华,冯少勇,张 利,武进峰,程 伟,成建军,张建东,张雁钢
(1.山西医科大学第一临床医学院,山西太原 030001;2.山西医科大学附属山西大医院泌尿外科,山西太原 030001)
·基础研究·
茶多酚对精索静脉曲张大鼠睾丸组织氧化应激和细胞凋亡的影响
柯鑫文1,武政华1,冯少勇1,张 利2,武进峰2,程 伟2,成建军2,张建东2,张雁钢2
(1.山西医科大学第一临床医学院,山西太原 030001;2.山西医科大学附属山西大医院泌尿外科,山西太原 030001)
目的 通过研究茶多酚对精索静脉曲张大鼠睾丸组织氧化应激和细胞凋亡的影响,探讨茶多酚是否对精索静脉曲张大鼠生精功能具有保护作用,为临床上应用茶多酚治疗精索静脉曲张提供理论依据和实验基础。方法 32只雄性青春期Wistar大鼠随机分为4组,每组8只。其中第Ⅰ组为假手术组(仅游离左肾静脉,不结扎);第Ⅱ组为模型组(建立精索静脉曲张模型);第Ⅲ、Ⅳ组为茶多酚干预组(先建立精索静脉曲张模型,然后分别给予不同浓度的茶多酚干预)。造模4周后,第Ⅰ组及第Ⅱ组均给予生理盐水1 mL/100 g,第Ⅲ组给予茶多酚10 mg/kg[即:(1 mL盐水+1 mg茶多酚)/100 g],第Ⅳ组给予茶多酚40 mg/kg[即:(1 mL盐水+4 mg茶多酚)/100 g];1次/d,灌胃,持续4周。4周后4组大鼠均处死取左侧睾丸组织,分别测定超氧化物歧化酶(SOD)活力、丙二醛(malondialdehyde,MDA)含量及检测凋亡指数(apoptosis index,AI)。结果 第Ⅰ组SOD活力最高,第Ⅱ组低于第Ⅲ组和第Ⅳ组,差异有统计学意义(P<0.05);第Ⅰ组MDA含量最低,第Ⅲ、Ⅳ组低于第Ⅱ组,差异有统计学意义(P<0.05);第Ⅰ组AI最低,第Ⅲ、Ⅳ组AI低于第Ⅱ组,差异有统计学意义(P<0.05)。结论 茶多酚能显著降低精索静脉曲张大鼠睾丸组织的氧化应激和细胞凋亡,间接改善精索静脉曲张大鼠睾丸的生精功能。
精索静脉曲张;不育;茶多酚;氧化应激;凋亡
精索静脉曲张(varicocele,VC)是指精索内静脉因静脉回流受阻或瓣膜功能不全致血液返流,使蔓状静脉丛迂曲、扩张及伸长,是青少年男性人群中一种常见的良性疾病。目前普遍认为VC是导致成年男性不育最常见、最易纠正的病因。据流行病学调查结果显示,VC在普通男性人群中的发病率约为15%,在原发性不育中占21%~41%,在继发性不育中占75%~81%[1]。尽管针对VC开展的相关研究非常多,但具体的病理生理机制仍未完全阐明,目前研究的重点主要集中在细胞凋亡和氧化应激。VC传统的治疗方式主要是手术,但单纯手术的效果往往不很理想,尤其是精液质量的改善上效果欠佳;因此改善VC患者睾丸生精功能的药物研究成为近些年来医学领域研究的热点。
茶多酚(tea polyphenol,TP)是茶叶中多酚类物质的总称,又名茶鞣质,是茶叶中有保健功能的主要成分之一。据文献报道,TP具有抗氧化、抑菌、抗病毒、抗肿瘤、抗辐射、降血糖、降血脂及防治动脉粥样硬化等药理学活性[2]。TP是天然的抗氧化剂,其抗氧化活性是维生素E的20倍[3]。诸多医学实验已经证明,茶多酚有极强的清除有害自由基及抑制质膜脂质过氧化的作用。研究表明,每人每天摄入160 mg茶多酚即对人体内亚硝化过程产生明显的抑制和阻断作用,摄入480 mg的茶多酚抑制作用达到最高[4]。本实验在建立VC动物模型的基础上给予TP干预,观察分析TP对大鼠睾丸组织氧化应激和细胞凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性青春期Wistar大鼠32只,周龄6周左右,体重140~170 g,购自中国人民解放军总医院动物实验中心。
1.1.2 试剂与主要仪器 茶多酚(纯度≥98.0%)购自北京索莱宝生物科技有限公司;SOD、MDA试剂盒均购自南京建成生物工程研究所;细胞凋亡试剂盒购自天津灏洋生物制品科技有限责任公司;低温超速离心机(美国Thermo Scientific公司);酶标仪(美国Thermo Scientific公司)。
1.2 方法
1.2.1 动物分组与模型制备 32只Wistar大鼠随机分为4组:Ⅰ、Ⅱ、Ⅲ、Ⅳ组。其中第Ⅰ组为假手术组(仅游离左肾静脉,不结扎);第Ⅱ组为模型组(建立VC模型);第Ⅲ、Ⅳ组为茶多酚干预组(先建立VC模型,然后分别给予不同浓度的茶多酚干预)。模型的建立:按照经典的Turner法[5]将直径为0.7 mm自制的金属杆与左肾静脉一起结扎,然后拔出金属杆,使左肾静脉直径缩小约一半,造模8周后开腹,以左侧精索内静脉明显扩张(直径大于1 mm)且左肾无缺血萎缩为造模成功的标准。造模4周后,第Ⅰ组及第Ⅱ组均给予生理盐水1 mL/100g;第Ⅲ组给予茶多酚10 mg/kg(即:1 mL盐水+1 mg茶多酚)/100 g;第Ⅳ组给予茶多酚40 mg/kg(即:1 mL盐水+1 mg茶多酚)/100 g;1次/d,灌胃,持续4周,其他饲养条件均一致。
1.2.3 标本的采集 灌胃4周后4组大鼠均处死取左侧睾丸组织,用预冷生理盐水冲洗,洗净睾丸上的血液,用滤纸擦干,沿睾丸中轴纵行切开成两半;一半放入Borrin液中固定,48 h后石蜡包埋;另一半放入-80℃冰箱中冻存。
1.2.4 组织匀浆的制备 从-80℃冰箱中取出冻存的睾丸组织,常温下解冻片刻,用眼科剪剪取0.1 g组织放入EP管中,并用眼科剪剪碎组织,加入900 μL预冷生理盐水,放入冰水浴中用超声匀浆机充分匀浆,冰水浴中静置10 min,以2 500 r/min、4 ℃离心10 min,取上清液制成10%组织匀浆,用于SOD活力及MDA含量的测定。
1.2.5 SOD活力及MDA含量的测定 严格按照试剂盒说明书操作,先采用考马斯亮蓝法测定10%、1%组织匀浆中蛋白的浓度,然后分别采用羟胺法和TBA法测定SOD活力及MDA含量。
1.2.6 凋亡检测 将蜡块切成4 μm厚度切片,严格按照试剂盒说明书操作,采用原位脱氧核苷酸转移酶介导的dUTP缺口末端标记法(TUNEL法)检测凋亡细胞,细胞核染成棕色为阳性。将组织切片置于40×10倍光学显微镜下观察,每张切片均随机选择5个视野,计数500个细胞,进行阳性细胞计数,取其平均值用于统计学分析,求得阳性细胞率即为凋亡指数(apoptosis index,AI)。
1.2.7 统计学方法 用SPSS13.0统计软件对实验数据进行统计学分析,采用多个样本均数的单因素方差分析进行组间比较,检验水准α=0.05。
2 结 果
2.1 TP对VC大鼠睾丸组织SOD活力及MDA含量的影响 第Ⅰ组SOD活力最高,第Ⅱ组明显低于第Ⅲ组和第Ⅳ组,差异有统计学意义(P<0.05,表1)。第Ⅰ组MDA含量最低,第Ⅲ、Ⅳ组明显低于Ⅱ组,差异有统计学意义(P<0.05,表1)。
2.2 生精细胞的凋亡 第Ⅰ组偶见棕褐色的生精细胞凋亡,第Ⅱ组可见大量棕褐色凋亡的生精细胞,第Ⅲ、Ⅳ组可见少量生精细胞凋亡(图1);第Ⅰ组AI最低,第Ⅲ、Ⅳ组AI显著低于第Ⅱ组,差异有统计学意义(P<0.05,表1)。

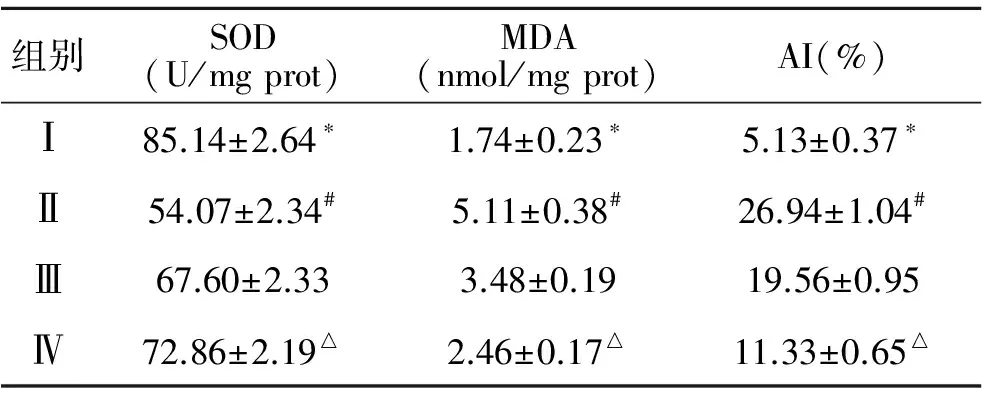
组别SOD(U/mgprot)MDA(nmol/mgprot)AI(%)Ⅰ85.14±2.64∗1.74±0.23∗5.13±0.37∗Ⅱ54.07±2.34#5.11±0.38#26.94±1.04#Ⅲ67.60±2.333.48±0.1919.56±0.95Ⅳ72.86±2.19△2.46±0.17△11.33±0.65△
*与其他3组比较,P<0.05;#与Ⅲ、Ⅳ组较,P<0.05;△与第Ⅲ组比较,P<0.05。

图1 生精细胞凋亡图像(TUNEL,×400,阳性细胞核呈棕褐色)
A:第Ⅰ组;B:第Ⅱ组;C:第Ⅲ组:D:第Ⅳ组。
3 讨 论
VC是泌尿外科常见的一种良性疾病,是成年男性不育的主要原因之一,其导致不育的确切病理生理机制仍未完全阐明。已经提出了一系列相关假说,如:睾丸温度升高、微循环障碍、细胞凋亡异常、氧化应激、缺氧和CO2蓄积、毒素返流、性激素的改变、自身免疫、NO的作用及附睾损害等[6],但没有一种学说能完全阐明其确切机制,可能是通过多种途径共同作用所致,其中细胞凋亡异常和氧化应激起主要作用[7]。细胞凋亡是基因编码的细胞程序性死亡,是机体维持细胞群体数量稳态的重要手段,是维持机体生理状态的主要调节方式之一。正常生精过程中有25%~75%的生精细胞发生凋亡,以此来维持生精细胞与支持细胞的适当比例,从而保证正常的生育能力[8]。当发生VC时,阴囊局部温度升高、血液中代谢毒物浓度增加、氧化应激及免疫作用等多种因素均会诱发生精细胞过度凋亡,并且具有时间依从性[9]。SIMSEK等[10]通过TUNEL法测定生精细胞AI后发现VC组和对照组分别为14.7%和2%。活性氧自由基(reactive oxygen species,ROS)是一类具有高度反应活性的含氧基团,生理条件下机体可产生少量受控的ROS,它是精子获能、顶体反应等生理功能所必需的。同时机体内还存在抗氧化防御体系,主要包括一些抗氧化酶,如SOD、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathyione peroxidase,GSH-Px)等,生理状态下氧化/抗氧化系统处于动态平衡。VC时,由于ROS产生过多或抗氧化体系功能缺失均会导致氧化应激,使氧化/抗氧化系统呈现负平衡;过量的ROS一方面可以直接损伤生精细胞。另一方面通过诱发生精细胞膜脂质过氧化产生大量MDA,进一步破坏生精细胞结构,使其形态发生改变,产生功能及代谢异常,从而间接损伤生精细胞。ALLAMANENI等[11]通过研究发现VC患者睾丸中ROS含量明显升高,且升高程度与VC的严重程度呈正相关。ABD-ELMOATY等[12]通过对比研究发现患有VC的不育患者精液中的SOD、CAT、GSH-Px活性明显低于正常对照组,MDA含量显著高于对照组,这表明氧化应激可能是VC致不育的原因之一。因为生精细胞凋亡异常增多可以导致少精子症或无精子症,而氧化应激可以通过破坏生精细胞DNA的完整性使生精细胞损伤,最终导致精子活力减弱,生育力下降或不育,所以细胞凋亡和氧化应激可以间接反映VC对睾丸生精功能的影响[7]。
VC对机体的最大损害是导致不育,传统的治疗方式首选手术,但治疗效果往往欠佳,尤其是精液质量的改善,VC患者术后精液的改善率为65%[13]。鉴于此,许多学者对改善VC所致不育患者生精功能的药物进行了相关研究,CAM等[14]发现,维生素E可以明显降低VC大鼠睾丸组织中的ROS水平,使生精细胞凋亡减少。ABBSI等[15]研究发现氨基胍(一种NO合酶抑制剂)通过阻断NO的合成间接抑制ROS的产生,并减少生精细胞DNA的碎裂,从而改善生精功能。国内学者对抗氧化药物的研究主要集中在中成药:崔云等[16]通过实验发现通精灵能显著降低实验性VC大鼠生精细胞的凋亡;安立文、吴育锋及梁志刚等[17-19]均证实生精冲剂对VC大鼠睾丸组织具有保护作用;尹静等[20]通过研究证实强精胶囊能改善VC大鼠精子密度及活力。因此,利用抗氧化剂改善VC患者的生精功能受到了临床医生的广泛关注。
茶多酚是从茶叶提取的一种天然抗氧化剂,根据目前的研究水平,它的抗氧化作用机制主要通过以下4个途径实现:①直接清除ROS:TP结构中的酚羟基可提供活泼氢使活性氧还原成三线态氧而灭活,而本身则被氧化成具有较稳定的酚氧自由基。②抑制脂质过氧化反应:病理条件下,体内产生过多的ROS极易损害细胞膜脂质中的不饱和脂肪酸,形成脂自由基,引起膜脂质过氧化反应。TP不仅可以直接清除脂质过氧化链式反应的中间产物脂过氧自由基和烷氧自由基从而抑制脂质过氧化,还能通过减少ROS的产生间接抑制脂质过氧化[21]。③络合金属离子:金属离子是体内代谢反应中各种酶的重要辅助因子,为酶发挥活性所必需。在中性或酸性条件下,茶多酚的邻位二酚羟基对过渡态金属离子有较强的络合作用,从而阻止金属离子对ROS等自由基的生成和膜脂质过氧化链式反应的催化作用。④激活细胞内抗氧化防御系统:生理状态下细胞内的抗氧化防御系统作为清除自由基的第一道防线可及时清除体内过剩的ROS,维持自由基的动态平衡。TP可以促进和调动体内抗氧化酶的活性间接作用于自由基,使机体免受氧化应激的损伤。TP的抗氧化活性已经在心、脑、肺、肾等器官中得到实验验证[3],另外TP对睾丸扭转/复位大鼠生精细胞的保护作用也已得到实验证实[22],但TP对VC睾丸生精功能的保护作用研究还未见相关报道。SOD是体内经典的抗氧化酶之一,它可以专一性地清除体内的ROS。MDA是ROS通过损伤质膜诱发脂质过氧化链式反应的重要中间代谢产物,对细胞质膜具有毒害作用。因此测定SOD活性及MDA含量既可以直接反映细胞脂质过氧化的程度,又可以间接反应细胞损伤的程度,即SOD活性及MDA含量可以反映细胞受氧化应激损伤的程度。本实验中,第Ⅱ组SOD活力最低,可能是过量的ROS消耗了大量SOD所致,而第Ⅲ、Ⅳ组SOD活力明显高于第Ⅱ组,因为TP既可以直接激活抗氧化防御系统使SOD产生增多和活力增强,还能通过清除ROS减少SOD的消耗间接实现;另外,第Ⅳ组SOD活力高于第Ⅲ组,但由于茶多酚干预组分组太少,只能说明TP的抗氧化作用与给药浓度可能呈正相关。第Ⅲ、Ⅳ组MDA含量明显低于第Ⅱ组,可能与TP显著抑制细胞膜脂质过氧化反应有关。试验中第Ⅲ、Ⅳ组AI显著低于第Ⅱ组,一方面可能是TP在体内发挥极强的抗氧化作用,从而抑制生精细胞的凋亡,另一方面可能是TP参与凋亡的生精细胞DNA的修复[23]。
本试验表明,茶多酚通过显著降低VC大鼠睾丸组织的氧化应激和细胞凋亡,间接改善VC大鼠睾丸的生精功能,并且可能与茶多酚的浓度呈正相关,进一步说明茶多酚应用于临床上治疗VC的不育患者具有潜在的临床应用价值。但茶多酚对VC生精功能保护作用的分子机制有待进一步研究,并探索茶多酚的最佳干预时间及最佳给药剂量,为临床上治疗VC提供理论依据和实验基础。
[1] WILL MA, SWAIN J, FODE M, et al. The great debate:varicocele treatment and impact on fertility[J]. Fertil Steril,2011,95(3):841-852.
[2] 张晓梦,倪 艳,李先荣. 茶多酚的药理作用研究进展[J]. 药物评价研究,2013,36(2):157-160.
[3]刘大美,毕宏生,解孝锋,等. 茶多酚体内抗氧化作用研究进展[J]. 山东医药,2013,53(16):82-84.
[4] 贾宁,于竞舟,张颖. 茶多酚的生物活性研究与保健作用[C]. 创新沈阳文集(B),2009:157-162.
[5] TURNER TT. The study of varicocele through the use of animal models[J]. Hum Repod Update,2001,7(1):78-84.
[6] 闫涛, 俞建军, 徐月敏. 精索静脉曲张致男性不育的研究进展[J]. 现代泌尿外科杂志,2010,15(4):324-327.
[7] 黄宇烽. 精索静脉曲张与男性不育[J]. 中华男科学杂志,2010,16(3):195-200.
[8] SAID TM, PAASCH U, GLANDER HJ, et al. Role of caspases in male infertility[J]. Hum Reprod Update,2004,10(1):39-51.
[9] 艾庆燕, 赵豫凤, 王艳梅,等. 精索静脉曲张致男性不育机制研究进展[J]. 中国全科医学,2011,14(8C):2813-2815.
[10] SIMSEK F, TRKERI L, CEVIK I, et al. Role of apoptosis in testicular tissue damage caused by varicocele[J]. Arch Esp Urol,1998,51(9):947-950.
[11] ALLAMANENI SS, NAUGHTON CK, SHARMA RK, et al. Increased seminal reactive oxygen species levels in patients with varicoceles correlate with varicocele grade but not with testis size[J].Fertil Steril,2004,82(6):1684-1686.
[12] ABD-ELMOATY MA,SALEH R,SHARMA R,et al.Increased levels of oxidants and reduced antioxidants in semen of infertile men with varicocele[J]. Fertil Steril,2010,94(4):1531-1534.
[13] AGARWAL A, HAMADA A, ESTEVES SC, et al. Insight into oxidative stress in varicocele-associated male infertility:part 1[J]. Nat Rev Urol,2012,9(12):678-690.
[14] CAM K, SIMSEK F, YUKSEL M, et al. The role of reactive oxygen species and apoptosis in the pathogenesis of varicocele in a rat model and efficiency of vitamin E treatment[J]. Int J Androl,2004,27(4):228-233.
[15] ABBASI M, ALIZADEH R, ABOLHASSANI F, et al. Effect of aminoguanidine in sperm DNA fragmentation in varicocelized rats: role of nitric oxide[J]. Reprod Sci,2011,18(6):545-550.
[16] 崔云,冯奕,郑武,等. 通精灵对实验性精索静脉曲张大鼠生精细胞凋亡及Caspase-3、Hsp60表达的影响[J]. 中华中医药学刊,2008,26(12):2593-2597.
[17] 安立文,隋勇,张景欣,等. 生精冲剂对精索静脉曲张大鼠睾丸生精功能保护作用的研究[J]. 中国男科学杂志,2006,20(2):39-42.
[18] 吴育峰,王瑞,张卫星,等. 中药生精冲剂对精索静脉曲张大鼠的治疗[J]. 中华男科学杂志,2008,14(7):658-661.
[19] 梁志刚,王坤芳,安立文. 生精冲剂对精索静脉曲张大鼠睾丸TGF-β1表达的影响[J]. 山西中医,2013,29(3):43-46.
[20] 尹静,王超,张蜀武,等. 强精胶囊对精索静脉曲张大鼠附睾功能性指标及精子质量的影响[J]. 中国中西医结合外科杂志,2013,19(2):156-159.
[21] 王树华,杨林,齐亚娟. 茶多酚抑制MDA生成及对阿霉素在小鼠肝细胞内蓄积的影响[J]. 西北药学杂志,2000,15(2):63-64.
[22] 何庆鑫,张雁钢,胡轩,等. 茶多酚对睾丸扭转/复位模型保护作用的研究[J]. 中华男科学杂志,2010,16(7)615-618.
[23] KATIYAR SK. Green tea prevents non-melanoma skin cancer by enhancing DNA repair[J]. Arch Biochem Biophys,2011,508(2):152-158.
(编辑 何宏灵)
The effects of tea polyphenol on the oxidative stress and cellular apoptosis of testicular tissues in rat varicocele
KE Xin-wen1, WU Zheng-hua1, FENG Shao-yong1, ZHANG Li2, WU Jin-feng2, CHENG Wei2, CHENG Jian-jun2, ZHANG Jian-dong2, ZHANG Yan-gang2
(1.the First Clinical Medical College, Shanxi Medical University, Taiyuan 030001; 2.Department of Urology, Shanxi Dayi Hospital Affiliated to Shanxi Medical University, Taiyuan 030001, China)
Objective To explore the protective role of tea polyphenol on the oxidative stress and cellular apoptosis of testicular tissues in experimentally-induced varicocele rat models.Methods A total of 32 male prepubertal Wistar rats were randomly divided into 4 groups, with 8 rats in each group. Group I was the sham operation group. Group Ⅱ was the varicocele model group. Group Ⅲ and Ⅳ were the tea polyphenol groups, in which the varicocele models were treated with tea polyphenol of different concentrations. Four weeks after the models were established, group I and Ⅱ were fed with 1 mL/100 g normal saline, group Ⅲ and Ⅳ were fed with 10 mg/kg and 40 mg/kg tea polyphenol respectively. After being fed once every day for 4 weeks, all rats were executed and the left testes were collected to detect the vitality of superoxide dismutase (SOD), content of malondialdehyde (MDA), and the apoptosis index (AI). Results Group I showed the highest vitality of SOD, followed by group Ⅱ,Ⅲ and Ⅳ (P<0.05). Group II had the highest measurement of MDA and AI, followed by group Ⅲ,Ⅳ and Ⅰ (P<0.05). Conclusion Tea polyphenol can significantly reduce the oxidative stress and cellular apoptosis of testicular tissues, indirectly improving the spermatogenesis in rats.
varicocele; infertility; tea polyphenol; oxidative stress; apoptosis
2014-12-01
2015-02-11
山西省卫生厅科研资助项目(No.201201047)
张雁钢,主任医师.E-mail:urozyg@163.com
柯鑫文(1988-),男(汉族),在读硕士.研究方向:泌尿男科学.E-mail:kxwweneal@126.com
R698
A
10.3969/j.issn.1009-8291.2015.07.017
