高良姜素在大鼠肠道的吸收机制
2015-06-24胡军林杨涛何开勇
胡军林,杨涛,何开勇
(1.湖北省食品药品监督检验研究院,武汉 430064;2.上海中医药大学附属曙光医院,上海 201203)
高良姜素在大鼠肠道的吸收机制
胡军林1,杨涛2,何开勇1
(1.湖北省食品药品监督检验研究院,武汉 430064;2.上海中医药大学附属曙光医院,上海 201203)
目的 探讨高良姜素在大鼠肠道的吸收机制。方法 采用大鼠在体单向肠灌流吸收实验模型,以质量法校正灌流液体积,采用反相高效液相色谱法测定灌流液中高良姜素浓度,考察不同肠段、药物浓度和P糖蛋白(P-gp)抑制药对高良姜素吸收的影响。结果 高良姜素在整个肠段都有吸收,在十二指肠、空肠、回肠和结肠的吸收速率常数Ka分别为(5.12±1.14)×10-2,(2.23±1.02)× 10-2,(4.61±0.75)× 10-2和(2.68±0.70)×10-2·min-1,同时它在回肠的吸收不受自身浓度和P-gp抑制药盐酸维拉帕米的影响。结论 高良姜素在肠道吸收良好,吸收过程以被动扩散为主,不受P-gp外排蛋白的影响。
高良姜素;肠道吸收;单向肠灌流法;色谱法,高效液相
高良姜为姜科植物高良姜(AlpiniaofficinarumHance)干燥根茎,味辛,性热,归脾、胃经,具有温胃止呕,散寒镇痛的功效,主要用于脘腹冷痛的功效,胃寒呕吐,嗳气吞酸[1]。高良姜素是高良姜中分离得到的黄酮类成分,具有显著的药理活性,主要有抗氧化[2]、抗菌[3]、抗肿瘤[4]等。体外研究表明高良姜素可导致肝癌细胞凋亡[5]和抑制黑色瘤细胞生长[6],是潜在的抗癌药物。而作为一种药物的开发,除了要有良好的药理活性以外,其体内吸收过程也至关重要。肠道是药物经口服后的主要吸收部位,其中小肠和结肠是最重要的吸收场所,故在研究药物的吸收时主要考察十二指肠、空肠、回肠和结肠的吸收特征来指导药物的剂型和工艺研究。研究药物肠吸收的方法有在体法、体外法和体内法[7-8]。其中在体法中以单向灌流法(single pass intestine perfusion,SPIP)应用广泛,由于它采用低流速(0.2~0.3 mL·min-1),而且实验时间较短(2~3 h),与正常生理状态的肠道吸收特征比较相似,能反映药物的体内吸收过程[9]。在进行肠灌流实验时,肠道还在动物体内,小肠的吸收与分泌功能还比较正常,小肠一边吸收药物,一边分泌与吸收一定的水分,会使药物在经过肠道后的浓度发生改变,从而导致实验误差,因此校正浓度变化是非常重要的环节。常用的校正方法有:酚红法[10]、质量法[11]和放射物标记法[12],但酚红本身也会在肠段有所吸收而引起实验误差,放射物标记法虽然准确但价格昂贵,而质量法既准确又便宜,是比较理想的实验方法[13]。笔者采用质量法校正的单向灌流法考察高良姜素在不同肠段的吸收情况和影响肠道吸收的各种因素,探讨高良姜素在肠道的吸收规律,为制剂开发提供参考。
1 材料
1.1 动物 斯泼累格·多雷(Sprague Dawley,SD)大鼠,体质量250 ~ 270 g,雄性,无特定病原体(specific pathogen free,SPF)级,10只。湖北省疾病预防控制中心实验动物研究中心提供,生产许可证号:SCXK(鄂)2008-0005。合格证号:42000600000333。实验所用大鼠健康符合国家普通动物实验健康标准,大鼠饲养于12 h明暗(7:00—19:00)交替的环境,温度(25±2) ℃,湿度 65%,提供充足的饮食,适应性饲养1周后开始实验。
1.2 药物与试剂 高良姜素对照品(中国食品药品检定研究院,含量> 98.5%,批号:111699-200602);盐酸维拉帕米对照品(中国食品药品检定研究院,含量为99.9%,批号:100223-200102);色谱纯甲醇(批号:1694207-330)和乙腈(批号:1488730-924)均购自德国Merck公司;超纯水(自制);0.9%氯化钠溶液由武汉滨湖双鹤药业有限公司提供(批号:20120811-5);其他试剂均为分析纯,均购自上海国药集团化学试剂有限公司。
1.3 仪器 Waters e2695高效液相色谱仪(Empower Pro 色谱数据工作站,996二极管阵列检测器,600四元泵,717plus 自动进样器,在线脱气机,Waters Co.);ZOBAX XBD C18柱(150 mm×4.6 mm,5 μm,Agilent Inc,USA);BP211D Sartorius十万分之一电子天平(Sartourius Co.,GER);DKZ系列电热恒温振荡水槽(上海一恒科学仪器有限公司);DK-S24型电热慢温浴锅(上海精宏实验设备有限公司);TDL-60B 离心机(上海安亭科学仪器有限公司);Mettler Toledo pH计(Mettler,瑞士); 旋转蒸发仪 N-1001和SB-2000水浴锅(EYELA,日本);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);5415R离心机(Eppendorf,德国);KQ-250型超声清洗器(昆山市超声仪器有限公司);HL-2 恒流泵(上海沪西分析仪器厂有限公司),VORTEX-GENIE 2漩涡混合器(Scientific Industries,USA)。
2 方法与结果
2.1 溶液的配制
2.1.1 Kreb's-Ringer试液(K-R液,pH7.4) 分别称取氯化钠7.8 g,碳酸氢钠1.37 g,氯化钾0.35 g,磷酸二氢钠0.32 g,葡萄糖1.4 g,氯化镁0.02 g,加适量的纯化水溶解;另取二水氯化钙0.37 g加纯化水100 mL溶解,然后两液混和均匀,定容至1 000 mL,即得,置4 ℃保存,备用。
2.1.2 含高良姜素的K-R液 精密称取高良姜素12.5 mg,加K-R液溶解并稀释成50 μg·mL-1的溶液,置4 ℃保存,备用,需要时再用K-R液分别稀释成5和10 μg·mL-1的溶液。
2.1.3 含盐酸维拉帕米和高良姜素的K-R液 精密称取盐酸维拉帕米49.11 mg,加“2.1.2”项所配制含高良姜素的K-R液100 mL,即得储备液1 μmol·mL-1,再精密吸取1 mL储备液,该储备液再被稀释100倍后即得含0.01 μmol·mL-1盐酸维拉帕米的高良姜素供试液。
2.2 高良姜素测定方法的建立
2.2.1 供试品溶液的制备 取各个段肠的出口收集灌流液适量,过孔径0.22 μm滤膜滤过,取续滤液,作为供试品溶液。
2.2.2 对照品溶液的制备 取减压干燥至恒质量的高良姜素对照品,精密称定,以甲醇制成 86.00 μg·mL-1高良姜素的对照品溶液,备用。
2.2.3 色谱条件 色谱柱:Agilent ZOBAX XBD-C18(150 mm×4.6 mm,5 μm);流动相:乙腈-0.1%甲酸(85:15);流速:1 mL·min-1;柱温:25 ℃;检测波长:266 nm;进样量:5 μL。
2.2.4 专属性考察 以高良姜素为对照品,精密称取5.04 mg,用K-R试液溶解并定量稀释成20 μg·mL-1溶液。以K-R液作为空白对照溶液,高效液相色谱(HPLC)法,在200 ~ 400 nm波长范围内进行紫外扫描,结果显示高良姜素在266 nm处有最大吸收,经HPLC分析空白K-R液、高良姜素对照品溶液和经过肠液后含有药物的灌流液,在高良姜素出峰处无杂峰,对含药量测定无干扰,表明方法专属性良好,见图1。
2.2.5 线性关系考察 分别精密吸取86 μg·mL-1高良姜素对照品溶液,加甲醇稀释成0.43,1.29,3.87,11.64,34.83和43.00 μg·mL-1等一系列对照品溶液,按“2.2.3”项色谱条件进行测定。以峰面积(Y,AU)为纵坐标,以质量浓度(X,μg·mL-1)为横坐标,进行线性回归。高良姜素线性回归方程为:Y=8 158.1X-657.3(r=0.999 9)。实验结果表明,高良姜素在0.43~43.00 μg·mL-1范围内与色谱峰面积呈现良好的线性关系。
2.2.6 日内和日间精密度实验 分别取低、中、高浓度依次为0.43,11.64和43.00 μg·mL-1的高良姜素对照品溶液,重复进样 5次,按“2.2.3”项的色谱条件进行测定,计算日内精密度。结果表明,低、中、高浓度高良姜素日内精密度相对标准差(RSD)分别为0.92%,1.31%和1.44%。另外,再分别将低、中、高浓度高良姜素对照品溶液在3 d内连续进样分析(每天连续进样5次),按“2.2.3 ”项的色谱条件进行测定,计算日间精密度。高良姜素低、中、高浓度对照品溶液日间精密度RSD依次为1.52%,1.73%和1.90%。
2.2.7 稳定性考察 取浓度为11.64 μg·mL-1高良姜素对照品溶液,按“2.2.3” 项条件分别在 0,1,5,48,96和120 h测定样品峰面积。计算不同时间测得峰面积间的RSD以衡量样品溶液的稳定性。高良姜素对照品溶液的RSD为1.57%。结果表明,高良姜素在 120 h内能稳定。
2.2.8 重复性考察 取含有高良姜素的回肠段的供试品溶液3份,按照“2.2.1”项方法处理,在“2.2.3” 项色谱条件下,测定3份样品中高良姜素的含量,计算RSD值。结果高良姜素的峰面积RSD为0.82%,表明重复性良好。
2.2.9 加样回收率实验 分别精密称取高良姜素对照品,加入已知含量的回肠段的供试品溶液中,按照“2.2.1”项下方法处理,在“2.2.3 ” 项色谱条件下,计算回收率。结果高良姜素低、中、高浓度溶液的回收率分别为96.24%,103.42%和104.92%,RSD为1.57%。实验结果表明,加样回收率良好,能够满足样品测定的要求。
2.3 肠壁物理吸附的考察 雄性SD大鼠,腹腔注射30 mg·kg-1戊巴比妥麻醉后,沿腹中线剪开腹腔,分别截取十二指肠、空肠、回肠和结肠各10 cm,0.9%氯化钠溶液清洗2次,将黏膜层翻出,分别置于250 mL盛有50 μg·mL-1高良姜素供试液烧杯中,37 ℃孵育3 h,取出肠段,以HPLC法测定孵育液的药物浓度。实验结果表明,高良姜素在不同肠段的孵育液中可在3 h内保持稳定,与初始供试液的百分比均在98%以上,提示肠壁对高良姜素无物理吸附。
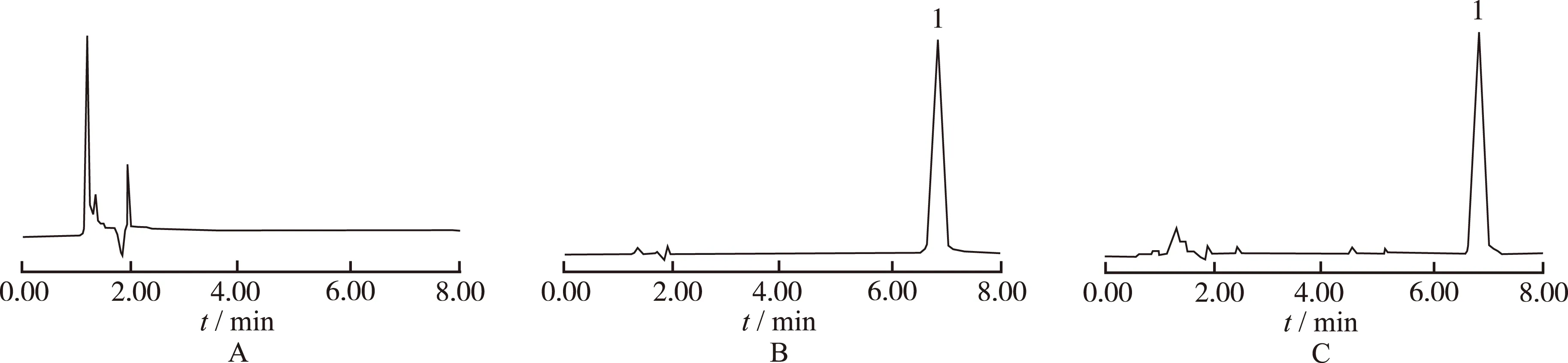
A.空白对照溶液;B对照品溶液;C.样品溶液;1.高良姜素
2.4 灌流管对药物吸附的考察 分别取“2.2.2” 项所制备的高良姜素对照品溶液置250 mL烧杯中,置37 ℃恒温水浴中,将恒流泵的进口端硅胶管放入烧杯中,出口端用另一烧杯收集流出液,平衡15 min后,测定收集液中高良姜素的浓度,平行测定3份。结果表明,收集液中高良姜素含量分别是初始供试液的(99.3±1.2)%,表明灌流用硅胶管对高良姜素均无吸附。
2.5 高良姜素在不同肠段的吸收 根据文献[13-14]方法测定肠的吸收特征,实验时略有改动,具体如下:取体质量250~270 g雄性SD大鼠,禁食12 h,自由饮水,腹腔注射戊巴比妥麻醉后,固定于托盘上,37 ℃恒温水浴锅上维持体温。沿腹中线从胸骨往下剃掉鼠毛,采用75%乙醇消毒后,延腹中线用手术刀纵向切开一个长3 cm的切口,打开腹腔,依次分离出十二指肠、空肠、回肠和结肠,每个肠段取约10 cm。分别于各肠段的两端切一小口,通过注射器以37 ℃的0.9%氯化钠溶液40 mL缓缓地冲洗各肠段的肠内容物,再注入空气以排空残留的0.9%氯化钠溶液。分别于各肠段开端切口处插管,插入长度约1 cm,手术线结扎;末端插管接流出液口。各肠段插管接好后,将其按原状放回至大鼠腹腔内,并对腹部的切口作必要缝合,并于伤口处覆盖浸有0.9%氯化钠溶液的纱布,维持湿润,并用红外灯维持大鼠体温。实验前以K-R液灌注满整个管路,并排除管路中的空气,以0.2 mL·min-1流速平衡10 min。吸取K-R液(含高良姜素50 μg·mL-1)5 mL置于小瓶中,精密称定质量,将每个肠段的进口管分别置其液面下,开始灌流,流速0.2 mL·min-1,在各段肠的出口处每隔15 min收集(收集小瓶已精密称定质量)灌流液。分别精密称定每个取样点的供试液小瓶和收集液小瓶的质量,采用HPLC方法测定高良姜素的浓度。实验持续105 min后,脱颈椎处死大鼠,分离被灌流的肠段,并测量该肠段的长度(l)和周长(d),计算其半径(r),采用质量法按以下公式计算药物的吸收速率常数(Ka)和表观吸收系数(Papp)。


式中:C0和Ce分别为灌流进口处和出口处溶液中药物的浓度,V0和Ve分别为灌流前和灌流后的供试液的体积(假定供试液的浓度为1.0 g·mL-1,根据测定的质量计算体积),v为灌流的速度。
实验结果表明,高良姜素在4个不同肠段均有吸收,但是吸收有差异,在十二指肠、空肠、回肠和结肠的的吸收速率常数Ka分别为(5.12±1.14)×10-2,(2.23±1.02)× 10-2,(4.61±0.75)× 10-2和(2.68±0.70)×10-2·min-1,对应的表观吸收系数Papp分别为(5.63±1.23)× 10-3,(2.28±1.08)×10-3,(4.78±0.61)× 10-3和(3.26±0.98)×10-3cm·min-1。从结果可看出,高良姜素在4个不同肠段吸收速率常数顺序依次为十二指肠>回肠>结肠>空肠。经方差分析并对各组之间两两比较,高良姜素在十二指肠段和回肠段的吸收要显著高于空肠和结肠段,组间比较采用SPSS软件进行t检验,其中十二指肠与回肠之间差异有统计学意义(t=3.776,P=0.009 2);十二指肠与结肠之间差异有统计学意义(t=3.648,P=0.010 7);回肠与空肠之间差异有统计学意义(t=3.760,P=0.009 4);回肠与结肠之间差异有统计学意义(t=3.762,P=0.009 4)。但是,高良素的吸收在十二指肠与空肠、空肠与结肠之间差异无统计学意义(P> 0.05)。
2.6 药物浓度对吸收的影响 分别取“2.1.2” 项所制备的5,10 和50 μg·mL-1高良姜素K-R液作为灌流液。取大鼠4只,以回肠段为灌流部位,灌流速度0.2 mL·min-1,持续105 min,依照“2.5”项方法分离不同肠段后进行实验研究,每15 min 换液1次。根据公式(1)和公式(2)分别计算Ka和Papp,结果见表1。可见,高良姜素浓度在考察范围内对Ka和Papp无显著影响(P> 0.05),说明高良姜素在回肠段的吸收不受自身浓度影响,主要以被动扩散机制进入体循环。
表1 不同浓度高良姜素在回肠的吸收特征
Tab.1 Absorption characteristics of galangin at different concentrations in the ileum±s,n=4
2.7 P-gp 对高良姜素肠吸收的影响 以盐酸维拉帕米作为P-gp抑制药,采用“2.2.3”项所配制的含盐酸维拉帕米和高良姜素的K-R液作为灌流液,以回肠为灌流肠段,按“2.5”项操作,计算Ka和Papp值,结果见表1。实验结果表明,P-gp被抑制后高良姜素在回肠段的Ka和Papp与对照组差异无统计学意义(P>0.05),提示高良姜素在肠道吸收可能主要以被动扩散为主,P-gp外排蛋白对其影响不大。
3 讨论
HPLC法测定高良姜素在肠道人工灌流液(K-R液)的含量,快速准确,专属性好,适用于高良姜素的体内肠吸收的研究。结果显示,K-R液在经过肠道后,肠道内存在的消化液、蛋白质等对高良姜素含量测定无干扰,3种浓度高良姜素的加样回收率均较高,表明该方法满足定量测定的要求。
本研究采用了经典的以质量法校正的大鼠肠道单向灌流法,该方法已广泛应用于药物在体肠吸收的研究。结果表明,高良姜素在各个肠段的吸收效果并不一样,在十二指肠段吸收显著高于回肠段(P<0.01),也显著高于结肠段(P<0.05);回肠段的吸收显著高于空肠和结肠段(P<0.01),它们在不同肠段的吸收由强至弱的顺序依次为十二指肠>回肠>结肠>空肠。此外,文献报道,当药物在大鼠的Papp> 1.2×10-2cm·min-1表示易于吸收,当Papp<1.8×10-3cm·min-1时表示药物难吸收[15];高良姜素在十二指肠、空肠、回肠和结肠的吸收在这两者之间,提示高良姜素在4个肠段的吸收均属于中等吸收的药物。
一般而言,回肠段是小肠最长的部分,也是药物吸收的主要场所,而高良姜素在回肠段吸收较好。因此,本研究选取了回肠段对高良姜素的吸收影响因素进行了考察。结果显示,高良姜素在回肠段的吸收不受自身浓度影响,提示高良姜素在肠道的吸收不存在转运饱和现象。P-gp蛋白是重要的外排转运体,当它被抑制之后,很多受此外排蛋白影响药物的体内吸收会增加。本研究发现,高良姜素在肠道的吸收也不受P-gp蛋白抑制药(盐酸维拉帕米)的影响。这些研究表明高良姜素吸收特点比较符合被动转运的方式,可能以被动扩散的转运方式为主。当然,在体的单向灌流法虽然是经典的研究药物吸收机制的方法,但是与真实的肠道吸收还有差距。因此,本研究只是初步探索了高良姜素的吸收特点,将来还有待采用体外和体内的方法研究其吸收特点与机制,如caco-2体外吸收机制研究、药动学研究(体内的吸收与分布特点),以进一步深入研究其吸收机制。
[1] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:270-271.
[2] RUSSO A,LONGO R,VANELLA A.Antioxidant activity of propolis:role of caffeic acid phenethyl ester and galangin[J].Fitoterapia,2002,73(Suppl 1):21-29.
[3] CHEN C C,HUANG C Y.Inhibition ofKlebsiellapneu-moniaeDnaB helicase by the flavonol galangin[J].Protein J,2011,30(1):59-65.
[4] ZHANG H T,LUO H,WU J,et al.Galangin induces apo-ptosis of hepatocellular carcinoma cells via the mitoch-ondrial pathway[J].World J Gastroenterol,2010,16(27):3377-3384.
[5] ZHANG H T,WU J,WEN M,et al.Galangin induces apo-ptosis in hepatocellular carcinoma cells through the caspase 8/t-Bid mitochondrial pathway[J].J Asian Nat Prod Res,2012,14(7):626-633.
[6] ZHANG W,TANG B,HUANG Q,et al.Galangin inhibits tumour growth and metastasis of B16F10 melanoma [J].J Cell Biochem,2013,114(1):152-161.
[7] 李高,方超.药物肠道吸收的生物学研究方法[J].中国药学杂志,2002,37(10):8-11.
[8] 马宏达,郭涛,何进.夏天无提取物中原阿片碱和延胡索乙素的大鼠肠吸收特性[J].医药导报,2011,30(9):1125-1129.
[9] DAHAN A,WEST B T,AMIDON G L.Segmental-dependent membrane permeability along the intestine following oral drug administration:evaluation of a triple single-pass intestinal perfusion(TSPIP) approach in the rat[J].Eur J Pharm Sci,2009,36(2/3):320-329.
[10] 郑雪静,赵庆春,颜鸣,等.盐酸洛美沙星大鼠在体肠吸收动力学研究[J].实用药物与临床,2011,14(1):25-27.
[11] 孙佳轶,郭盼,潘裕生,等.依托度酸的大鼠在体肠吸收动力学[J].沈阳药科大学学报,2010,27(9):754-758.
[12] SUTTON S C,RINALDI M T,VUKOVINSKY K E.Com-parison of the gravimetric,phenol red,and 14C-PEG-3350 methods to determine water absorption in the rat single-pass intestinal perfusion model[J].AAPS Pharm Sci,2001,3(3):93-97.
[13] 吴雅娜,栾立标.独活有效成分大鼠在体单向灌流肠吸收[J].药学学报,2008,43(1):102-107.
[14] 聂淑芳,潘卫三,李伟,等.长春西汀的大鼠在体肠吸收研究[J].中国医药工业杂志,2005,36(10):625-628.
[15] FAGERHOLM U,JOHANSSON M,LENNERNAS H.Com-parison between permeability coefficients in rat and human jejunum[J].Pharm Res,1996,13(9):1336-1342.
DOI 10.3870/yydb.2015.05.012
Intestinal Absorption Mechanism of Galangin in Rats
HU Junlin1, YANG Tao2, HE Kaiyong1
(1.HubeiInstituteforFoodandDrugControl,Wuhan430064,China; 2.ShuguangHospitalAffiliatedtoShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China)
Objective To investigate the absorption characteristics of galangin in various intestinal segments. Methods Single-pass intestinal perfusion was employed in rats, and the mass quality was used to correct the volume; Galangin in rat intestinal perfusion was determined by HPLC to investigate the effects of intestinal segments, drug concentration and P-glycoprotein (P-gp) inhibitor on drug’s absorption. Results Galangin could be absorbed in the whole intestine, and itsKavalues in the segments of duodenum, jejunum, ileum and colon were (5.12±1.14)×10-2,(2.23±1.02)×10-2,(4.61±0.75)× 10-2and(2.68 ± 0.70)×10-2·min-1,respectively.Meanwhile, the values of theKain the segment of ileum were not affected by the drug concentration and P-gp inhibitor. Conclusion The galangin is well absorbed in rats intestinal segments.The absorption procedure is mainly controlled by passive diffusion but unaffected by P-gp efflux protein.
Galangin; Intestinal absorption; Single-pass intestinal perfusion; Chromatography,high performance liquid
2014-03-12
2014-04-20
胡军林(1963-),男,湖北天门人,副主任药师,学士,研究方向:中药活性成分与质量标准。电话:(0)13554171576,E-mail:wanglipiaoxue@163.com。
杨涛(1979-),男,湖北天门人,助理研究员,博士,研究方向:中药复方药效物质基础与作用机制。电话:021-20256409,E-mail:yangtao8579@163.com。
R282.71;R285.5
A
1004-0781(2015)05-0612-05
