匹伐他汀对野百合碱诱导大鼠肺动脉高压的作用及其机制
2015-06-24周述博张本斯
周述博,张本斯
(大理学院人体解剖教研室,大理 671000)
匹伐他汀对野百合碱诱导大鼠肺动脉高压的作用及其机制
周述博,张本斯
(大理学院人体解剖教研室,大理 671000)
目的 探讨匹伐他汀在防治肺动脉高压中的作用及其可能机制。方法 雄性斯泼累格·多雷(SD)大鼠50只,随机分为5组(n=10),分别为正常对照组、模型对照组、匹伐他汀预防组(1 mg·kg-1·d-1)和匹伐他汀大剂量(3 mg·kg-1·d-1)治疗组、小剂量(1 mg·kg-1·d-1)治疗组。除正常对照组外,其余4组均通过皮下注射野百合碱55 mg·kg-1,诱导大鼠形成肺动脉高压。8周后,比较各组存活率、平均肺动脉高压(mPAP)、血小板源性生长因子-B(PDGF-B)、Rac1mRNA的表达及白细胞介素-6(IL-6)分泌水平。结果 匹伐他汀预防组、正常对照组大鼠均存活,匹伐他汀小剂量治疗组、大剂量治疗组与模型对照组小鼠存活率分别为60.0%,80.0%,40.0%(P<0.01);与模型对照组比较,匹伐他汀治疗组mPAP均降低(均P<0.01),肺组织PDGF-B表达、IL-6分泌及Rac1基因表达均降低(均P<0.01)。结论 匹伐他汀可能是通过对Rac1基因和PDGF-B表达的调节以抑制肺动脉平滑肌细胞增殖和抑制IL-6分泌等机制防治肺动脉高压。
匹伐他汀;野百合碱;肺动脉高压;血管平滑肌
肺动脉高压(pulmonary arterial hypertension,PAH)是在多种致病因素下使肺血管阻力增高及肺顺应性减退并肺血管重塑,最终发展为右心衰竭的一种病理生理过程[1],具体的发生机制尚不完全清楚,已证实多种体液因素如内皮素及生长因子等参与肺血管纤维化的发病过程,并使肺血管平滑肌细胞增殖。他汀类药物已被证实具有抗血管平滑肌增殖、抗炎、抗凋亡作用,对小G蛋白翻译后的修饰有抑制作用,可中断细胞内信号的传导[2]。小G蛋白是一种具有GTP酶活性且相对分子质量小的蛋白。Rac1是小G蛋白的一个亚群;血小板源性生长因子B(platelet-derived growth factor B,PDGF-B)在血管平滑肌增殖中起重要的调节作用;白细胞介素-6( interleukin-6,IL-6)是一种重要的炎症递质。匹伐他汀属于他汀类新型调脂药。笔者通过观察Rac1、PDGF-B和IL-6变化,进一步阐明PAH形成及匹伐他汀对PAH的治疗机制。
1 材料与方法
1.1 动物、试剂与仪器 雄性斯泼累格·多雷(Sprague Dawley,SD)大鼠,无特定病原体(specific pathogen free,SPF)级,体质量(253.8±14.2) g,由昆明动物实验中心提供,动物生产许可证号:SCXK(滇)2011-004,动物使用合格证号:0024150。野百合碱(上海纯优生物有限公司,含量:98%,批号:P1014),匹伐他汀钙片(日本Kowa Company,Ltd,规格:每片2 mg,批号:20130101),大鼠PDGF-B抗体(Bia-Swamp公司,批号:BSA-10308),二抗及二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒(上海基尔顿生物制剂公司,批号:201310A),IL-6酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒(美国Rapidbio公司,批号:201310),TRIZOL试剂(天根公司,批号:HG1310281004),灌胃液均按每组设定的匹伐他汀的量用灭菌水稀释至2 mL。大鼠右心导管(大理学院生理学教研室),聚合酶链反应(polymerase chain reaction,PCR)扩增仪(德国Eppendorf公司),荧光定量PCR仪(Applied Biosystems公司的7700型)。
1.2 动物分组与干预方法 大鼠50只,随机分为5组,每组10只,分别为正常对照组、模型对照组、匹伐他汀预防组(1 mg·kg-1·d-1)和匹伐他汀大剂量(3 mg·kg-1·d-1)治疗组、小剂量(1 mg·kg-1·d-1)治疗组。除正常对照组外其余4组均通过皮下注射野百合碱55 mg·kg-1,诱导大鼠形成PAH[3-4]。其中匹伐他汀预防组自野百合碱皮下注射当日起每日给予匹伐他汀(1 mg·kg-1·d-1)灌胃至第8周末;匹伐他汀大剂量组(3 mg·kg-1·d-1)和小剂量组(1 mg·kg-1·d-1)在第4周末开始给予匹伐他汀相应剂量灌胃至第8周末。模型对照组和正常对照组给予0.9%氯化钠溶液灌胃至第8周末。
1.3 血流动力学测定 用10%水合氯醛腹腔注射麻醉大鼠后,参照孙波等[2]介绍的方法,血流动力学测定主要记录平均肺动脉压(mean pulmonary artery pressure,mPAP),用右心导管及生理记录仪记录。
1.4 肺动脉形态学观察 取右中肺约200 mg,经石蜡切片、苏木精-伊红(hematoxylin and eosin,HE)染色后,显微镜下双盲阅片,对肺小动脉管壁厚度进行统计学分析,每张切片均选取3~5个肺小动脉测量血管内外径,其差值为血管壁厚度(wall thickness,WT),血管壁厚度百分比=(管壁厚度×2)/外径×100%,计算其平均值。
1.5 右心室肥厚的判断 将心脏分离为右心室游离壁(right ventricular free wall,RV)和左心室加室间隔(left ventricle+ventricular septal,LV+S),用滤纸吸干后称其质量,计算RV/(LV+S)比值,判断右心室的肥厚程度。
1.6 肺组织中PDGF-B免疫组化染色和结果判断 取肺组织经石蜡切片后再免疫组化染色,依次脱蜡、抗原修复、用过氧化氢消除内源性过氧化物酶、滴加一抗、再滴加二抗、DAB显色等步骤。以棕黄色反应物为阳性信号,每张切片选取直径100~150 μm肺小动脉3~5支,染色深浅表示PDGF-B的表达强度。
1.7 RT-PCR法检测肺组织Rac1的mRNA 引物合成由天根公司完成Rac 1引物序列:上游5′-CCTGCTCATCAGTTACACGAC- 3′,下游5′-GACGC-AGTCTGTCATAATCTT- 3′,扩增片段长度为180 bp。β-actin基因为内参照,上游5′-CACCCGCG-AGTACAACCTTC-3′,下游5′-CCCATACCCACCATC-ACACC-3′,扩增长度片段为244 bp。PCR过程按照说明书进行,扩增条件如下:①95 ℃、3 min预变性;②95 ℃、20 s变性,60 ℃、30 s退火延伸,40个循环。实时荧光定量PCR 分析:分别测定每个样品Rac1和β-action mRNA 的Ct值,为了减少操作误差,将每个样品均作复孔。Ct值表示每个反应管内的荧光信号达到设定的阈值时经历的循环数。采用相对定量方式表示各样品Rac1的ΔCt。再按照ΔΔCt=ΔCt目的基因-ΔCt参照基因,计算2-ΔΔCt。在对PCR反应过程中的每一个循环的系统荧光强度进行实时监测的过程中,根据扩增曲线确定Ct值,利用2-ΔΔCt法计算Rac1相对拷贝数。
1.8 ELISA检测肺组织中IL-6 取已冻存的肺组织100 mg,剪碎,取灭菌水0.9 mL稀释匀浆后,2 000 r·min-1(r=3 cm)离心10 min,取上清液50 μL用于检测,按照ELISA试剂盒说明书进行操作。
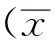
2 结果
2.1 实验动物一般状况 匹伐他汀预防组、正常对照组大鼠均存活。正常对照组大鼠强壮、呼吸平稳;模型对照组、匹伐他汀小剂量治疗组、匹伐他汀大剂量治疗组大鼠在腹腔注射野百合碱1周后,3组大鼠较正常对照组均有不同程度活动减少,食量减少,至第 2 周末开始出现体质量下降,部分大鼠出现喘息,第 3 周末上述症状更严重,鼻、唇发绀,至第4周末时模型对照组和匹伐他汀大剂量治疗组各死亡1只,匹伐他汀小剂量治疗组死亡2只;匹伐他汀大剂量、小剂量治疗组在4周末给予匹伐他汀治疗后,大鼠呼吸逐渐平稳,体质量开始增加,并且大剂量治疗组优于小剂量治疗组;至8周末时模型对照组共死亡6只,匹伐他汀大剂量治疗组死亡2只,匹伐他汀小剂量治疗组死亡4只,匹伐他汀预防组和正常对照组无死亡。匹伐他汀小剂量治疗组、大剂量治疗组与模型对照组小鼠存活率分别为60.0%,80.0%,40.0%(χ2=2.326,P<0.01)。解剖死亡大鼠,可见胸腔积液,肺部有瘀点、瘀斑,且可见右心室游离壁明显肥厚。
2.2 血液动力学测定和肺小动脉形态学、右心室肥厚判定 与正常对照组和匹伐他汀预防组、大剂量治疗组、小剂量治疗组比较,模型对照组mPAP值、肺小动脉管壁增厚程度及右心室肥厚程度显著升高(1.476≤F≤13.264,均P<0.01);匹伐他汀预防组、大剂量治疗组、小剂量治疗组上述指标组间比较均差异有统计学意义(2.481≤F≤10.259,均P<0.05),见表1和图1。
2.3 肺组织中PDGF-B的表达情况 与模型对照组比较,匹伐他汀大剂量治疗组、小剂量治疗组及预防组的PDGF-B基因表达均不同程度抑制,均明显低于模型对照组(1.354≤F≤13.368,均P<0.01),匹伐他汀大剂量治疗组及小剂量治疗组间比较上述指标差异有统计学意义(1.375≤t≤6.316,P<0.05),见表1和图2。
2.4 实时荧光定量PCR检测及ELISA检测结果 Rac1 mRNA的表达在正常对照组中较低,匹伐他汀预防组和大、小剂量治疗组较高,模型对照组最高(2.489≤F≤14.264,均P<0.01);IL-6的表达量同样是模型对照组最高,各组值明显降低(3.549≤F≤13.470,均P<0.01),见表1。
表1 5组大鼠各观察指标比较

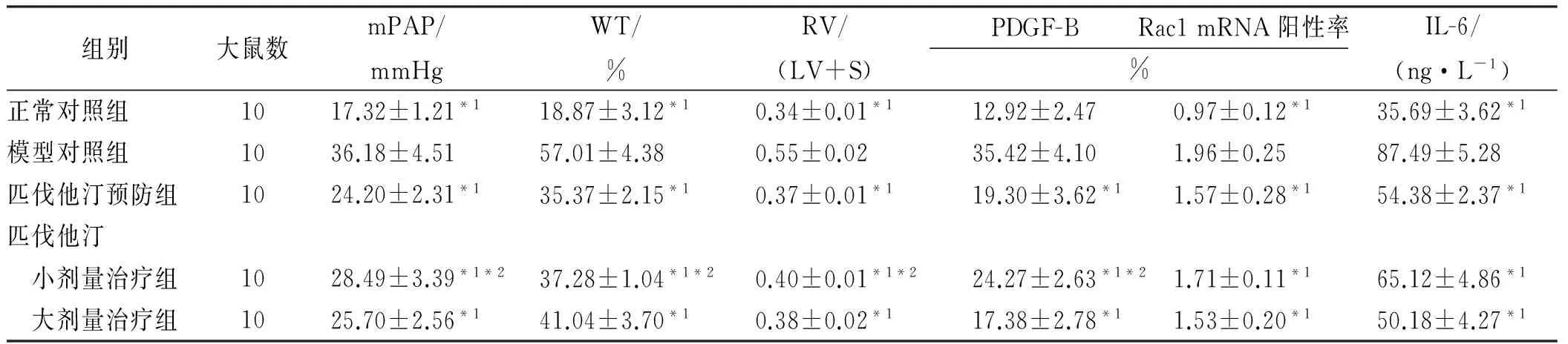
组别大鼠数mPAP/mmHgWT/%RV/(LV+S)PDGF-BRac1mRNA阳性率%IL-6/(ng·L-1)正常对照组1017.32±1.21*118.87±3.12*10.34±0.01*112.92±2.470.97±0.12*135.69±3.62*1模型对照组1036.18±4.5157.01±4.380.55±0.0235.42±4.101.96±0.2587.49±5.28匹伐他汀预防组1024.20±2.31*135.37±2.15*10.37±0.01*119.30±3.62*11.57±0.28*154.38±2.37*1匹伐他汀 小剂量治疗组1028.49±3.39*1*237.28±1.04*1*20.40±0.01*1*224.27±2.63*1*21.71±0.11*165.12±4.86*1 大剂量治疗组1025.70±2.56*141.04±3.70*10.38±0.02*117.38±2.78*11.53±0.20*150.18±4.27*1
与模型对照组比较,*1P<0.01;与匹伐他汀大剂量治疗组比较,*2P<0.05
Compared with model control group,*1P<0.01;compared with high-dose pitavastatin group,*2P<0.05
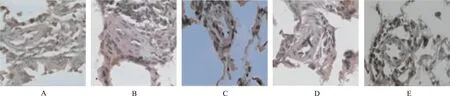
A.正常对照组; B.模型对照组; C.匹伐他汀预防组; D.匹伐他汀小剂量治疗组; E.匹伐他汀大剂量治疗组
A.normal control group;B.model control group;C.pitavastatin prevention group;D.low-dose pitavastatin group;E.high-dose pitavastatin group
Fig.1 Histopathology of pulmonary arteriole in five groups of rats(HE,×400)
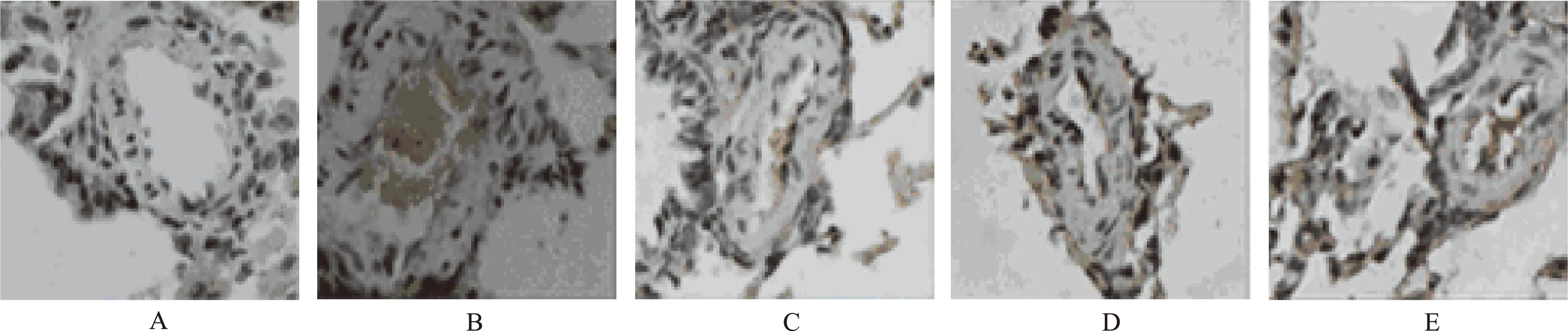
A.正常对照组; B.模型对照组; C.匹伐他汀预防组; D.匹伐他汀小剂量治疗组; E.匹伐他汀大剂量治疗组
A.normal control group;B.model control group;C.pitavastatin prevention group;D.low-dose pitavastatin group;E.high-dose pitavastatin group
Fig.2 Immunohistochemical stain on PDGF-B in pulmonary tissue in five groups of rats(ISH,×400)
3 讨论
PAH是临床常见的病理生理过程,常继发于心肺等多种疾病。随着细胞和分子水平研究深入,目前对PAH发病机制及治疗的研究有很大进展[5-6]。新的治疗药物及方法也逐渐增多,他汀类药物就是其中的一种。他汀类药物为3-羟基-3-甲基戊二酰辅酶A还原酶抑制药,除具有较强的降脂作用外,还具有抗血管平滑肌细胞增殖、抗调亡、抗氧化及抑制炎性因子产生等作用[7-8]。匹伐他汀在治疗PAH中的抗炎作用笔者尚未见报道。本研究结果证实,匹伐他汀可以减少肺组织中IL-6的分泌,从而产生抗炎作用,并能在一定程度上逆转PAH的发生。IL-6作为一种炎症递质,在炎症的发生、发展过程中有着重要地位[9]。目前,PAH发生机制虽未明确阐明,但认为IL-6可介导肺血管平滑肌免疫和炎性反应,并产生大量如C-反应蛋白等急性炎性反应产物;促进诱导型一氧化氮合成酶增加,使心肌环磷酸鸟苷水平升高,钙内流减少,最终出现肺动脉弹性减退,所以在PAH进展中,由于各种因素导致炎症反应,引起IL-6在肺组织分泌增加,而IL-6又可进一步损伤肺动脉,由此形成恶性循环。
研究显示,他汀类药物可以影响血管平滑肌细胞的增殖和迁移,且能有效治疗PAH[10]。推测可能的机制是与其诱导肺动脉平滑肌细胞或血管内皮细胞凋亡、抑制靶细胞增殖有关,但是在PAH的进展中,有关对肺动脉平滑肌细胞增殖的细胞因子暂未具体阐明。在本实验中,通过对各组大鼠肺组织PDGF-B表达量的测定,结果表明对已诱导形成PAH的大鼠肺组织PDGF-B的表达量较正常大鼠增多,由此推测,PDGF-B的表达增多在一定程度上促进肺动脉平滑肌细胞增殖。并且在使用匹伐他汀干预治疗后,PDGF-B在肺组织中的表达量较模型对照组减少,进一步提示匹伐他汀能够通过抑制PDGF-B的表达而逆转PAH的进展。 PDGF-B 由巨噬细胞产生,主要促进细胞增殖及平滑肌纤维化[11]。所以可以推导,在PAH形成过程中,多种因素使肺组织产生炎症反应、巨噬细胞增多,PDGF-B表达增加,从而使肺血管平滑肌细胞增殖。
Rho家族成员中的GTP激酶(Rho GTPases)是Ras GTP激酶(Ras GTPase)超家族的一个主要分支,目前在哺乳动物细胞中发现有8个亚群,共22种,Rac就是其中的一个亚群,并且Rac1是广泛表达并且研究最多的亚型[12]。各种因素如低氧引起肺动脉平滑肌细胞Rac1激活,介导血管内皮细胞产生活性氧簇(reactive oxygen species,ROS),ROS生成及肺动脉平滑肌细胞增殖促进PAH形成[13-14]。
笔者在本实验中同时观察Rac1与PDGF-B、IL-6,旨在进一步阐明PAH的进展和匹伐他汀治疗PAH的具体机制。由实验结果可以推测:在PAH发生的各种致病因素如低氧诱导肺血管的Rac1激活,进而介导细胞外向细胞内信号传导,引起PDGF-B的表达,促进肺血管增殖及炎症递质如IL-6的产生而发生炎症反应,导致肺血管重塑。另外研究表明[15],低氧诱导Rac1激活,可介导ROS诱导内皮细胞核因子-κB1激活,活化的核因子-κB1可进一歩激活炎性因子IL-6,而IL-6又能诱导ROS的大量产生,形成恶性循环,导致血管内皮细胞炎性损伤,发生凋亡。本实验结果也与此相符。但是在PAH的发生过程中,Rac1对肺组织中IL-6产生及PDGF-B的表达具体如何调控,还有待进一步研究。
[1] DIEBOLD I,PETRY A,DJORDJEVIC T,et al.Reciprocal regulation of Racl and PAK-1 by HIF-1 alpha:a positive-feedback loop promoting pulmonary vascular remodeling[J].Antioxid Redox Signal,2010,13(4):399-412.
[2] 孙波,刘文利.右心导管测定大鼠肺动脉压的方法[J].中国医学科学院学报,1984,6(6):466-469.
[3] DEMARCO V G,HABIBI J,WHALEY-CONNEU A T,et al.Rosuvastatin ameliorates the development of pulmonary arterial hypertension in the transgenic(mRen2)27 rat[J].Am J Physiol Heart Circ Physiol,2009,297(5):1128-1139.
[4] CARLINO C,TOBIAS J D,SCHNEIDER R I,et al.Pulm-onary hemodynamic response to acute combination and monothempy with sildenafil and brain natriuretic peptide in rats with monocrotaline-induced pulmonary hypertension[J].Am J Med Sei,2010,339(1):55-59.
[5] TACKETT K L,STAJICH G V.Combination pharmacothe-rapy in the treatment of pulmonary arterial hypertension[J].J Pharm Pract,2013,26(1):18-28.
[6] CORREA R D,SILVA L C,REZENDE C J,et al.Pulmonary hypertensionand pulmonaryartery dissection[J].J Bras Pneumol,2013,39(2):238-241.
[7] GAN H L,ZHANG J Q,LU J K,et al.Pulmonary oligemia maneuver can alleviate pulmonaryartery injury during pulmonary thromboendarterectomy procedure[J].Chin Med J(Engl),2013,126(5):828-833.
[8] COLOMBO R,SIQUEIRA R,BECKER C U,et al.Effects of exercise on monocrotaline-induced changes in right heart function and pulmonaryartery remodeling in rats[J].Can J Physiol Pharmacol,2013,91(1):38-44.
[9] 王凤,王桂芹,薛峰,等.血管平滑肌细胞在不同细胞外基质的迁移特性:玻片扣法研究[J].生理学报,2013,65(2):135-142.
[10] 王巍,林建清.氟伐他汀辅助治疗慢性阻塞性肺疾病并发肺动脉高压56例[J].医药导报,2012,31(9):1163-1165.
[11] NARAOKA M,MUNAKATA A,MATSUDA N,et al.Suppr-ession of the Rho/Rho-Kinase pathway and prevention of cerebral vasospasm by combination treatment with statin and fasudil after subarachnoid hemorrhage in rabbit[J].Transl Stroke Res,2013,4(3):368-374.
[12] WARITA S,KAWASAKI M,TANAKA R,et al.Effects of pitavastatin on cardiac structure and function and on prevention of atrial fibrillation in elderly hypertensive patients[J].Circ J,2012,76(12):2755-2762.
[13] MATSUBARA T,NARUSE K,ARAKAWA T,et al.Impact of pitavastatin on high-sensitivity C-reactive protein and adiponectin in hypercholesterolemic patients with the metabolic syndrome:the PREMIUM study[J].J Cardiol,2012,60(5):389-394.
[14] CHEMLA D,CASTELAIN V,ZHU K,et al.Estimating right ventricular stroke work and the pulsatile work fraction in pulmonary hypertension[J].Chest,2013,143(5):1343-1350.
[15] YU J,TAYLOR L,WILSON J,et al.Altered expression and signal transduction of endothelin-1 receptors in heritable and idiopathic pulmonary arterial hypertension[J].J Cell Physiol,2013,228(2):322-329.
DOI 10.3870/yydb.2015.05.002
Effects and Mechanism of Pitavastatin on Monocrotaline-induced Pulmonary Arterial Hypertension in Rats
ZHOU Shubo,ZHANG Bensi
(TeachingandResearchSectionofHumanAnatomy,DaliCollege,Dali671000,China)
Objective To investigate the effects and mechanism of pitavastatin on monocrotaline (MTC)-induced pulmonary arterial hypertension (PAH) in rats. Methods A total of 50 male Sprague-Dawley rats were randomly divided into five groups (n=10 each):pitavastatin treatment at low dose (1 mg·kg-1·d-1),high dose (3 mg·kg-1·d-1),pitavastatin prevention regimen (1 mg·kg-1·d-1), the model control, and the normol control group. PAH was induced by applying a single subcutaneous injection of MTC(55 mg·kg-1)in the first four groups of rats. The treatment lasted for 8 weeks.At the end of the study,survival rates and mean pulmonary arterial pressure(mPAP) among groups were compared.The expression levels of platelet-derived growth factor-B(PDGF-B)and IL-6,Rac1 mRNA in small pulmonary artery were also detected. Results All rats in the prevention protocol and normal control group survived.Pitavastatin treatment improved survival in the treatment protocol(P<0.01).The survival rate in the low dose, high dose, and model control group was 60.0%, 80.0%, and 40.0%, respectively.Pitavastatin in both prevention and treatment protocol significantly lowered mPAP (P<0.01).Pitavastatin also inhibited PDGF-B and IL-6 expression (P<0.01),and inhibited Rac1 mRNA expression in lung tissues (P<0.01). Conclusion Pitavastatin reduces mPAP in the MTC-induced PAH rat model, the mechanism of which may be related to inhibition of Rac1 expression,smooth muscle cell proliferation and inflammatory mediator IL-6.
Pitavastatin; Monocrotaline;Pulmonary arterial hypertension; Vascular smooth muscle
2014-03-26
2014-06-20
周述博(1986-),男,湖南邵阳人,医师,硕士,研究方向:肺动脉高压。电话:(0)18587201753,E-mail:43602984@qq.com。
张本斯(1969-),女,云南梁河人,教授,研究方向:形态学基础与临床。电话:0872-2257104,E-mail:ben-si-zhang@163.com。
R972.6;R965
A
1004-0781(2015)05-0569-05
