荷花NnγGCS基因的克隆及表达分析
2015-06-24张阿慧刘兆磊顾春笋陈发棣蒋甲福陈素梅
张阿慧, 刘兆磊,①, 顾春笋, 陈发棣, 蒋甲福, 陈素梅
〔1. 南京农业大学园艺学院, 江苏 南京 210095; 2. 江苏省·中国科学院植物研究所(南京中山植物园), 江苏 南京 210014〕
荷花NnγGCS基因的克隆及表达分析
张阿慧1, 刘兆磊1,①, 顾春笋2, 陈发棣1, 蒋甲福1, 陈素梅1
〔1. 南京农业大学园艺学院, 江苏 南京 210095; 2. 江苏省·中国科学院植物研究所(南京中山植物园), 江苏 南京 210014〕
以荷花品种‘台城拂翠’(Nelumbonucifera‘Taicheng Focui’)嫩叶为材料,采用简并引物PCR和RACE技术得到荷花γGCS基因的全长cDNA序列,命名为NnγGCS。序列分析结果表明:NnγGCS基因cDNA序列的全长为1 801 bp,其开放阅读框(ORF)长度为1 569 bp,编码522个氨基酸残基。NnγGCS蛋白质的理论相对分子质量为59 159.0,理论等电点为pI 6.27,稳定指数为39.60;该蛋白质无跨膜结构域,但具有1个保守的GCS2结构域,并被定位于细胞质和叶绿体中,说明NnγGCS蛋白质较稳定,并属于谷氨酰半胱氨酸连接酶家族。系统进化分析结果表明:荷花NnγGCS氨基酸序列与龙眼(DimocarpuslonganLour.)和黄瓜(CucumissativusLinn.)等双子叶植物γGCS氨基酸序列的亲缘关系较近,与水稻(OryzasativaLinn.)等单子叶植物γGCS氨基酸序列的亲缘关系较远。实时荧光定量PCR扩增结果显示:NnγGCS基因在荷花各器官中均能表达,且在嫩叶中的相对表达量最高、在茎中的相对表达量最低。不同浓度镉胁迫条件下,NnγGCS基因在荷花嫩叶和须根中的相对表达量及表达趋势差异较大;NnγGCS基因的相对表达量在嫩叶中总体表现为随胁迫时间延长先下降后上升,在须根中表现为200 μmol·L-1镉胁迫1 h和400 μmol·L-1镉胁迫12 h时显著高于初始水平、而在其他胁迫时间与初始水平差异不明显。亚细胞定位结果显示:NnγGCS基因能够在洋葱(AlliumcepaLinn.)表皮细胞的细胞质中表达,说明该基因编码的蛋白质在细胞质中发挥作用。研究结果显示一定浓度的镉胁迫能够诱导NnγGCS基因的表达。
荷花;NnγGCS基因; 克隆; 相对表达量; 镉胁迫; 亚细胞定位
荷花,学名莲(NelumbonuciferaGaertn.),为中国十大传统名花之一,花大色艳,且地下茎和莲子均能够食用[1],观赏价值和经济价值具佳;此外,荷花还具有降低水体污染[2]和积累重金属[3-4]的潜能。
γ-谷氨酰半胱氨酸合成酶(γGCS)是谷胱甘肽(GSH)合成过程中的限速酶,能够调节GSH的合成并受GSH的反馈调节[5],编码该合成酶的基因即为γGCS基因。GSH能够参与调节植物的多种抗逆过程[6],γGCS基因在植物的抗逆过程中也有所响应,例如受干旱、低温和过氧化胁迫等非生物胁迫诱导后γGCS基因的表达水平发生明显变化[7-9];过量表达γGCS基因的芥菜〔Brassicajuncea(Linn.) Czern.〕较其野生型具有更强的镉积累能力,而且对重金属胁迫的耐受力也有所增强[10];镉胁迫下番茄(LycopersiconesculentumMiller)[11]和玉米(ZeamaysLinn.)[12]植株的γGCS酶活性分别增强2和8倍,且随着镉浓度升高γGCS酶活性逐渐增强。
植物螯合素(phytochelatins,PC)又称植物螯合肽,是GSH衍生的金属离子结合肽,能够螯合环境中的重金属离子,有效降低重金属对植物的毒害作用[13]。冯保民等[14]将从荷花中克隆获得的植物螯合素基因NnPCs转化到拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕中进行异源表达,结果显示镉胁迫下转NnPCs基因的拟南芥中该基因的表达增强,且其生长状况优于野生型,体内的镉积累量也显著高于野生型,说明NnPCs基因能够提高拟南芥植株的重金属耐受能力和镉积累能力。
GSH是PC合成的前体,因此,明确荷花γGCS基因的结构和功能对于研究该基因在积累重金属和解除重金属毒害中的作用具有重要意义。鉴于此,作者以荷花品种‘台城拂翠’(‘Taicheng Focui’)的嫩叶为实验材料,采用简并引物PCR和RACE技术获得荷花γGCS基因的全长cDNA序列,并对该基因进行序列特征、表达模式和表达定位分析,以期为进一步阐明在荷花积累重金属的过程中γGCS基因的作用提供参考依据。
1 材料和方法
1.1 材料
供试荷花品种‘台城拂翠’来源于南京艺莲苑有限公司;实验于2013年4月在南京农业大学花卉遗传与育种实验室内进行。取长约15 cm的根状茎,用等量沙土种植于长50 cm、宽38 cm、高29 cm的周转箱中,每个周转箱种植1株;注入自来水,直至水面超过沙土表面15 cm;将周转箱置于避雨温室内培养,当水面低于沙土表面时及时补充水分。
实验用RNA快速提取试剂盒购自北京原平皓生物技术有限公司,DNA片段纯化回收试剂盒(Agarose Gel DNA Purification Kit Ver. 2.0)、Real-Time PCR Kit(SYBR Green)、DNaseⅠ、SalⅠ、NotⅠ、PvuⅠ、T4DNA连接酶、LR重组酶和pMD19-T载体均购自宝生物工程(大连)有限公司,cDNA合成试剂盒(SuperScript Ⅲ Reverse Transcriptase)、5′RACE 试剂盒(5′RACE System for Rapid Amplification of cDNA Ends Kit Version 2.0)、pENTR1A载体和pMDC43载体均为美国Invitrogen公司产品,大肠杆菌DH5α购自天根生化科技(北京)有限公司;所有引物的合成和测序均委托上海捷瑞生物工程有限公司完成。
1.2 方法
1.2.1 总RNA提取及cDNA合成 培养7至8周后,任意选取1株具7或8枚叶片的健康荷花植株,采集鲜嫩叶片并包于锡纸内,液氮速冻后于-80 ℃保存、备用。称取0.1 g嫩叶样品,参照RNA快速提取试剂盒说明书上的操作流程提取获得总RNA样品,并用DNaseⅠ去除总RNA中残留的少量DNA;用质量体积分数1%琼脂糖凝胶电泳检测总RNA样品的完整性。按照cDNA合成试剂盒说明书上的操作流程合成cDNA,并使用荷花内参基因NnActin检测cDNA质量。
1.2.2 荷花γGCS基因全长cDNA序列的克隆 根据GenBank数据库中登录的洋葱(AlliumcepaLinn.)、黄瓜(CucumissativusLinn.)、拟南芥和百脉根(LotuscorniculatusLinn.)等植物的GCS氨基酸序列的保守序列设计1对简并引物GCS-F和GCS-R,引物序列分别为5′-CCCTCTGGAGACCCTCAYCARACNTG-3′和5′-GAAGATGGTGGTCAGGTGGTTYTCCCARTC-3′;以荷花叶片cDNA为模板进行PCR扩增反应,反应体系总体积25 μL,包括1.0 μg·μL-1cDNA模板1.0 μL、10×PCR buffer 2.5 μL、10.0 mmol·L-1Mg2+1.5 μL、2.5 mmol·L-1dNTPs 2.0 μL、10.0 mmol·L-1正向和反向引物各1.0 μL及5.0 U·μL-1rTaqDNA聚合酶0.2 μL,用灭菌双蒸水补足体积。扩增程序为:94 ℃预变性5 min;94 ℃变性30 s、50 ℃退火30 s、72 ℃延伸30 s,共35个循环;最后于72 ℃延伸10 min。
回收扩增产物并将其连接到pMD19-T载体上,转化大肠杆菌DH5α感受态细胞,37 ℃振荡培养1.5 h;将感受态细胞涂布在含有50 μmol·mL-1氨苄青霉素(Amp)的LB固体培养基上,37 ℃过夜培养;挑取单克隆菌落,接种至含有50 μmol·mL-1氨苄青霉素的LB液体培养基中,37 ℃振荡培养2 h;对菌液DNA进行PCR检测,选取含有目的条带(即γGCS基因保守序列)的单个阳性克隆进行测序。
根据上述克隆获得的荷花γGCS基因的中间保守序列设计2条5′RACE反向引物GCS-51和GCS-52,引物序列分别为5′-CCTTCGCCTTACAACCAGAG-3′和5′-AGCATCATCTGTAGGGGGGC-3′;接头引物为AAP和AUAP,引物序列分别为5′-GGCCACGCGTCG ACTAGTACGGGIIGGGIIGGGIIG-3′和5′-GGCCACGC GTCGACTAGTAC-3′。并设计2条3′RACE正向引物GCS-31和GCS-32,引物序列分别为5′-ATGAGAAG CCACATTTGGACCGACAC-3′和5′-TGGGTTTGAGCA GTATGTGGA-3′;接头引物为Jiang-T和Jiang-R,引物序列分别为5′-CTGATCTAGAGGTACCGGATCCTTTTTTTTTTTTTTTT-3′ 和 5′-CTGATCTAGAGGTACCGGATCC-3′。5′RACE的2轮扩增程序均为:94 ℃预变性5 min; 94 ℃变性30 s、 55 ℃退火30 s、 72 ℃延伸1 min, 共35个循环; 最后于72 ℃延伸10 min。 3′RACE的扩增程序为:94 ℃预变性5 min;94 ℃变性30 s、50 ℃退火30 s、72 ℃延伸1 min,共35个循环;最后于72 ℃延伸7 min。分别对5′RACE和3′RACE扩增产物进行纯化和回收,将其连接到pMD19-T载体上并转化大肠杆菌DH5α感受态细胞;按照上述筛选方法用Amp进行筛选,挑取单个阳性克隆进行测序。
将测序得到的3′RACE片段、5′RACE片段及中间保守片段进行拼接,得到荷花γGCS基因的全长序列,并根据拼接结果设计全长引物GCS-WF和GCS-WR,引物序列分别为5′-ATTCTATCACTCGACACTCAAAGCC-3′和5′-TCAATATAACAGCTCCTCAAAAATGGGATCCACGCATTGACCCC-3′。使用上述引物对荷花γGCS基因的全长序列进行验证,扩增程序为:94 ℃预变性5 min; 94 ℃变性30 s、 55 ℃退火30 s、 72 ℃延伸2 min, 共35个循环; 最后于72 ℃延伸7 min。回收扩增产物,将其与pMD19-T载体连接并转化大肠杆菌DH5α感受态细胞;按照上述筛选方法用Amp进行筛选,挑取单个阳性克隆进行测序。
1.2.3 序列分析 利用GenBank内的ORF finder工具查找序列的开放阅读框(ORF);采用BLASTp软件进行序列比对分析,选择与荷花γGCS氨基酸序列同源的其他植物的γGCS氨基酸序列、用ClustalX 1.83软件进行多重比对,利用MEGA 5.1软件中的neighbor-joining (NJ)法构建系统进化树。利用在线工具ProtParam(http:∥web.expasy.org/protparam/)预测荷花γGCS基因编码的蛋白质的理论相对分子质量及理论等电点(pI);采用TMHMM Sever v. 2.0(http:∥www.cbs.dtu.dk/services/TMHMM/)预测该蛋白质的跨膜结构域;采用wolf PSORT(http:∥wolfpsort.seq.cbrc.jp/)对该蛋白质进行亚细胞定位预测;采用SMART(http:∥smart.embl-heidelberg.de/)分析该蛋白质的保守结构域。
1.2.4 荷花γGCS基因的表达分析 任意选取长势一致的3株荷花,分别采集各单株的剑叶(刚萌出、未展开的叶片)、嫩叶(刚刚展开的叶片)、成熟叶、叶柄(成熟叶的叶柄)、茎和须根,各称取0.1 g,用于γGCS基因的组织定量表达分析,每个样品设3次重复。
在塑料花盆(上口径25 cm、高28 cm)中分别装入200和400 μmol·L-1CdCl2溶液2 L,植入正常生长的荷花植株进行胁迫培养,每盆1株;于胁迫培养0、1、3、6、12和24 h时每处理各选取3株样株,分别采集每株样株的嫩叶和须根各0.1 g,经液氮速冻后于-80 ℃保存、备用。
按照RNA快速提取试剂盒说明书上的操作流程分别提取嫩叶和须根样品的总RNA,取1 μg 总RNA、按照cDNA合成试剂盒说明书上的操作流程合成cDNA第1链;将获得的cDNA稀释30倍,采用设计的定量引物GCS-RTF和GCS-RTR进行扩增反应,引物序列分别为5′-GCTTATTTCCCAGCCAAGTC-3′和5′-TCTCGGCACTCCATAACAAG-3′,反应体系总体积20 μL。参考张计育等[15]的方法和条件进行实时荧光定量PCR反应,并用7300 Real Time PCR System软件和2-ΔΔCt法[16]进行分析。
1.2.5 荷花γGCS基因表达载体的构建和亚细胞定位 以正确提取的质粒DNA为模板,采用含酶切位点的引物GCS-SalⅠ和GCS-NotⅠ(引物序列分别为5′-CGCGTCGACATGATGGCGCTTATTTCCCAGCCAAGTCC-3′和5′-AAAGCGGCCGCGATCAATATAACAGCTCCTCAAAAATGGGAT-3′)扩增荷花γGCS基因的ORF;回收扩增产物,分别用限制性内切酶SalⅠ和NotⅠ对扩增出的目的片段进行双酶切,并利用T4DNA连接酶将其连接到pENTR1A载体中;转化大肠杆菌DH5α感受态细胞,按照上述筛选方法用Amp进行筛选,挑取单个阳性克隆进行测序。提取测序正确的阳性克隆菌液中的质粒DNA,使用PvuⅠ进行单酶切后得到线性化产物;利用LR重组酶与pMDC43载体进行重组,转化大肠杆菌DH5α感受态细胞,并按照上述筛选方法用Amp进行筛选;挑取单个阳性克隆,采用pMDC43载体引物pMDC43-Test-F和pMDC43-Test-R(引物序列分别为5′-CGTCGTCCTTGAAGAAGATGG-3′和5′-TGAATTAGATGGTGATGTTAATGGG-3′)以及γGCS基因特异引物GCS-T-F和GCS-T-R(引物序列分别为5′-CCCTCTGGAGACCCTCAYCARACNTG-3′和5′-GAAGATGGTGGTCAGGTGGTTYTCCCARTC-3′)进行PCR检测,经测序验证载体构建的正确性。
构建的pMDC43-γGCS表达载体含2个35S启动子和GFP荧光信号(见图1),利用基因枪轰击法[17]将该表达载体转化到在MS高渗培养基上培养16 h的洋葱表皮细胞中,获得高效瞬时表达,暗培养16 h后在激光共聚焦显微镜下观察细胞的荧光。

图1 荷花γGCS基因表达载体的结构图
Fig. 1 Structure chart of expression vector ofγGCSgene fromNelumbonuciferaGaertn.
2 结果和分析
2.1 荷花γGCS基因全长序列分析
利用简并引物扩增获得荷花γGCS基因的保守中间片段,长度为619 bp;其3′RACE和5′RACE片段长度分别为596和668 bp。将中间片段、3′RACE和5′RACE片段进行拼接,得到总长度为1 801 bp的片段,即为荷花γGCS基因的全长cDNA序列。序列分析结果(图2)表明:该序列包含194 bp的3′非编码区、38 bp的5′非编码区以及1 569 bp的开放阅读框(ORF),共编码522个氨基酸残基。预测结果显示:荷花γGCS基因编码的蛋白质的理论相对分子质量为59 159.0;理论等电点为pI 6.27,稳定指数为39.60,表明该蛋白质较稳定。跨膜结构域和亚细胞定位的预测结果显示:荷花γGCS蛋白质无跨膜结构域,且该蛋白质位于细胞质和叶绿体中。通过保守结构域分析可知,荷花γGCS蛋白质具有1个保守的GCS2结构域,属于谷氨酰半胱氨酸连接酶家族。
多重比对结果显示(图3):根据获得的基因序列推导出的氨基酸序列与百脉根、洋葱、龙眼(DimocarpuslonganLour.)、巴西橡胶树〔Heveabrasiliensis(Willd. ex A. Juss.) Müll. Arg.〕、黄瓜和拟南芥的γGCS氨基酸序列的一致性分别为87%、85%、81%、 80%、78%和76%。据此确定获得的序列为荷花γGCS基因,命名为NnγGCS。

*: 终止密码子 Stop codon.

AC: 洋葱AlliumcepaLinn.; AT: 拟南芥Arabidopsisthaliana(Linn.) Heynh.; BJ: 芥菜Brassicajuncea(Linn.) Czern.; CS: 黄瓜CucumissativusLinn.; LC: 百脉根LotuscorniculatusLinn.; NN: 荷花NelumbonuciferaGaertn.; HB: 巴西橡胶树Heveabrasiliensis(Willd. ex A. Juss.) Müll. Arg.
图3 荷花与其他6种植物的γGCS基因编码的氨基酸序列的比对分析
Fig. 3 Comparison analysis on amino acid sequences encoded byγGCSgene fromNelumbonuciferaGaertn. and other six species
2.2 基于γGCS氨基酸序列的荷花与其他植物的系统进化分析
基于GenBank中龙眼、百脉根和玉米等15种植物的γGCS氨基酸序列及本研究预测的荷花NnγGCS氨基酸序列构建系统进化树(图4)。这些植物的γGCS氨基酸序列在进化过程中比较保守,主要分为双子叶植物和单子叶植物2个大类,其中,荷花与龙眼和百脉根等10个种类聚为一组,均为双子叶植物,与水稻和玉米等5种单子叶植物的亲缘关系较远。

图中数据为置信度 Datums in the figure are confidence. LC: 百脉根LotuscorniculatusLinn.; PV: 菜豆PhaseolusvulgarisLinn.; PS: 豌豆PisumsativumLinn.; CB: 高山离子芥ChorisporabungeanaFisch. et C. A. Mey.; AT: 拟南芥Arabidopsisthaliana(Linn.) Heynh.; DL: 龙眼DimocarpuslonganLour.; PC: 豆梨PyruscalleryanaDec.; CS: 黄瓜CucumissativusLinn.; HB: 巴西橡胶树Heveabrasiliensis(Willd. ex A. Juss.) Müll. Arg.; ZE: 百日菊ZinniaelegansJacq.; NN: 荷花NelumbonuciferaGaertn.; AC: 洋葱AlliumcepaLinn.; TA: 小麦TriticumaestivumLinn.; OS: 粳稻Oryzasativasubsp.japonicaKato; ZM: 玉米ZeamaysLinn.; PA: 芦苇Phragmitesaustralis(Cav.) Trin. ex Steud.
图4 基于γGCS氨基酸序列构建的荷花与其他植物的NJ系统树
Fig. 4 NJ phylogenetic tree ofNelumbonuciferaGaertn. and other species based on γGCS amino acid sequence
2.3 荷花NnγGCS基因的表达分析
以荷花的NnActin基因为内参,利用实时荧光定量PCR技术分析荷花NnγGCS基因在不同组织中的表达状况,结果见图5。分析结果显示:荷花的NnγGCS基因在其须根、茎和叶片中均能够表达,但表达量差异明显,该基因在各组织中的相对表达量从高到低依次排序为嫩叶、叶柄、成熟叶、须根、剑叶、茎。
不同浓度镉胁迫条件下荷花嫩叶和须根中NnγGCS基因的表达特征见图6。由图6-A可见:在200 μmol·L-1Cd胁迫条件下,嫩叶中NnγGCS基因的相对表达量在胁迫1 h时略升高,胁迫3 h时明显下降,胁迫6、12和24 h逐渐升高,胁迫24 h时较初始水平(胁迫0 h)明显升高;在400 μmol·L-1Cd胁迫条件下,嫩叶中NnγGCS基因的相对表达量在胁迫1和3 h时持续下降,胁迫6和12 h时逐渐升高,胁迫24 h时又略有下降且低于初始水平。

ML: 成熟叶 Mature leaf; St: 茎 Stem; FL: 剑叶 Flag leaf; TL: 嫩叶 Tender leaf; Pe: 叶柄 Petiole; FR: 须根 Fibrous root.
图5 荷花不同器官中NnγGCS基因的相对表达量
Fig. 5 Relative expression ofNnγGCSgene in different organs ofNelumbonuciferaGaertn.
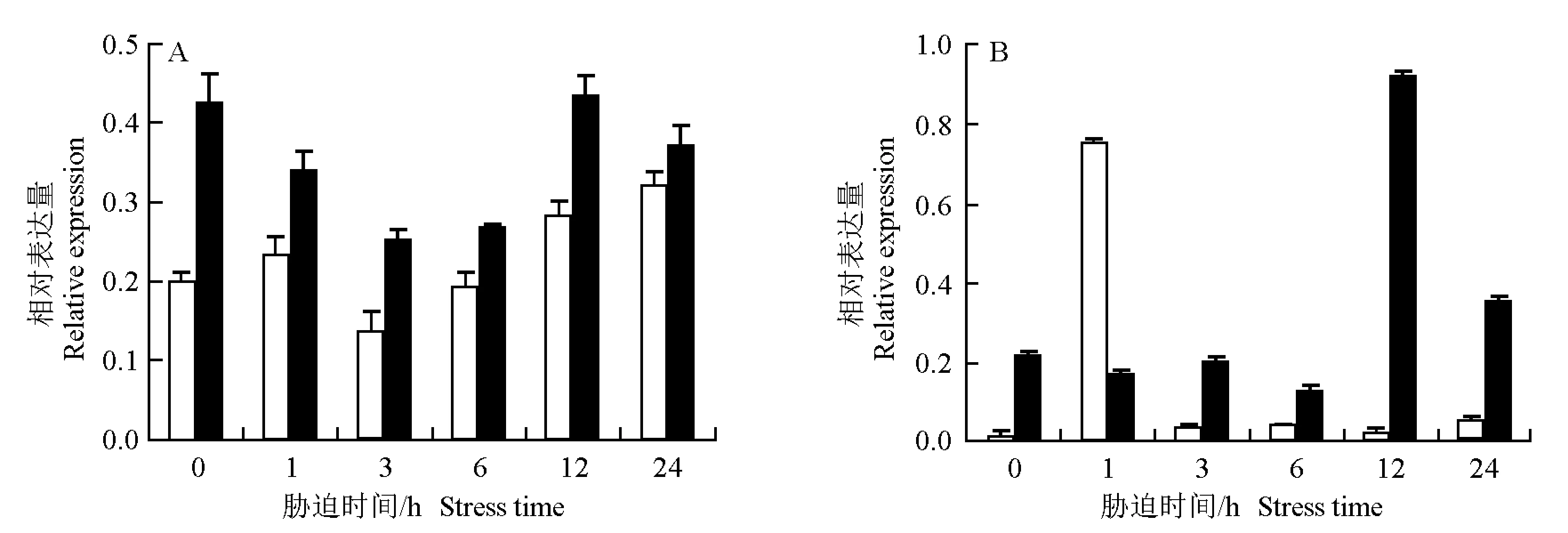
□: 200 μmol·L-1 Cd; ■: 400 μmol·L-1 Cd.
由图6-B可见:不同浓度镉胁迫条件下NnγGCS基因在须根中相对表达量的变化与嫩叶中存在较大差异。在200 μmol·L-1Cd胁迫条件下,须根中NnγGCS基因的相对表达量在胁迫1 h时显著升高,随后下降至初始水平,之后保持在稳定状态,变化幅度较小;而在400 μmol·L-1Cd胁迫条件下,须根中NnγGCS基因的相对表达量在胁迫1、3和6 h时均略低于初始水平,在胁迫12 h时显著升高,胁迫24 h时虽有一定下降但仍高于初始水平。
2.4 荷花NnγGCS基因的表达定位分析
采用洋葱表皮细胞对荷花NnγGCS基因表达进行亚细胞定位,结果(图7)显示:该基因表达的蛋白质荧光仅出现在细胞质中,并呈分散状态,而液泡和质膜中没有荧光,与该蛋白质跨膜结构域的预测结果部分一致。虽然该基因在细胞质和叶绿体中均能表达[18],但由于本研究所用材料为洋葱表皮,无法观察到叶绿体,因而仅在细胞质中观察到该基因的表达。

A,B,C. pMDC43载体 pMDC43 vector: A. 可见光 Visible light; B. GFP; C. 叠加 Merged.
3 讨 论
序列分析结果显示:荷花NnγGCS蛋白与其他植物的γGCS蛋白具有相同的GCS2结构域,为谷胱甘肽合成过程中的限速酶。比对结果显示:荷花NnγGCS蛋白的氨基酸序列与百脉根γGCS蛋白的氨基酸序列一致性最高(87%),与拟南芥γGCS蛋白的氨基酸序列一致性最低(76%)。在进化关系上,荷花γGCS基因属于双子叶植物类,与龙眼和百脉根等双子叶植物的亲缘关系较近,与水稻等单子叶植物的亲缘关系较远,表明该基因在进化过程中具有保守性。在进化过程中,γGCS基因的C端氨基酸比较保守,而N端则约有100个氨基酸残基存在较大差异。不同植物γGCS基因的ORF编码的氨基酸残基数变化较大(百脉根为435个、小麦为374个、荷花为522个),这种差异不仅体现了不同物种间的差异性,也体现了相同基因的多态性。
GSH广泛存在于植物体中,参与调节植物的多种抗性机制[19]。γGCS蛋白为GSH合成过程中的限速酶,直接影响GSH的生物合成量。表达分析结果显示:NnγGCS基因在荷花的各个组织器官中均能够表达,说明该基因在荷花中没有组织特异性,能够在荷花各组织器官的生长发育过程中发挥作用。这一研究结果与巴西橡胶树的相关研究结果一致[20]。
荷花NnγGCS基因的表达量对重金属镉胁迫有一定的响应,大体表现为随胁迫时间延长NnγGCS基因的相对表达量先下降后升高,与镉胁迫下番茄中γGCS酶活性的变化趋势一致[11],推测这可能是由于γGCS酶能够催化合成GSH,继而合成PC来抵御重金属对植物的伤害,说明镉胁迫条件下PC合成受镉胁迫诱导[21-22]。然而,在不同浓度镉胁迫条件下,荷花须根中NnγGCS基因的表达模式不同,高浓度(400 μmol·L-1Cd)镉胁迫条件下该基因的响应时间反而延迟,其响应机制有待深入研究。
利用基因枪轰击法将NnγGCS基因表达的蛋白质定位于细胞质中,说明该蛋白质在细胞质中发挥相应的生理功能,与该蛋白质跨膜结构域的预测结果一致。其作用过程可能是该蛋白质在细胞质中催化合成GSH,进而合成PC,PC与重金属结合后被运至液泡内,从而降低重金属对细胞的伤害[23]。虽然Hell等[24]证实γGCS基因表达的蛋白质还存在于叶绿体内,但是由于本研究所用材料为洋葱表皮,无法观察到该基因在叶绿体中的表达情况,因而,还需采用合适的材料对此进行进一步的实验验证。
[1] 王其超, 张行言. 荷花发展前景: 从中国视角展望[J]. 中国园林, 2011, 27(1): 50-53.
[2] 聂雅萍, 冯子云, 刘 波, 等. 荷花净化水质能力分析[J]. 林业调查规划, 2006, 31(增刊): 110-112.
[3] VAJPAYEE P, SHARMA S C, TRIPATHI R D, et al. Bioaccu-mulation of chromium and toxicity to photosynthetic pigments, nitrate reductase activity and protein content ofNelumbonuciferaGaertn.[J]. Chemosphere, 1999, 39: 2159-2169.
[4] KUMAR M, CHIKARA S, CHAND M K, et al. Accumulation of lead, cadmium, zinc, and copper in the edible aquatic plantsTrapabispinosaRoxb. andNelumbonuciferaGaertn.[J]. Bulletin of Environmental Contamination and Toxicology, 2002, 69: 649-654.
[5] LIU Z L, GU C S, CHEN F D, et al. Heterologous expression of aNelumbonuciferaphytochelatin synthase gene enhances cadmium tolerance inArabidopsisthaliana[J]. Applied Biochemistry and Biotechnology, 2011, 166: 722-734.
[6] TAKAO H, HIROSHI N, TORU N, et al. Crystal structure of γ-glutamylcysteine synthetase: insights into the mechanism of catalysis by a key enzyme for glutathione homeostasis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101: 15052-15057.
[7] XIANG C B, Oliver D J. Glutathione metabolic genes coordinately respond to heavy metals and jasmonic acid inArabidopsis[J]. Plant Cell, 1998, 10: 1539-1550.
[8] SENGUPTA D,RAMESH G,MUDALKAR S, et al.Molecular cloning and characterization of γ-glutamyl cysteine synthetase (VrγECS) from roots ofVignaradiate(L.) Wilczek under progressive drought stress and recovery[J]. Plant Molecular Biology Reporter, 2012, 30: 894-903.
[9] 陈坤明, 宫海军, 王锁民. 植物谷胱甘肽代谢与环境胁迫[J]. 西北植物学报, 2004, 24(6): 1119-1130.
[10] ZHU Y L, PILON-SMITS E A H, TARUN A S T, et al. Cadmium tolerance and accumulation in Indian Mustard is enhanced by overexpressing γ-glutamylcysteine synthetase[J]. Plant Physiology, 1999, 121: 1169-1177.
[11] CHENJJ,GOLDSBROUGHPB.Increasedactivityofγ-glutamylcysteine synthetase in tomato cells selected for cadmium tolerance[J]. Plant Physiology, 1994, 106: 233-239.
[12] RÜEGSEGGERA,BRUNOLDC.EffectofCadmiumonγ-glutamylcysteine synthesis in maize seedlings[J]. Plant Physiology, 1992, 99: 428-433.
[13] MAY M J,VERNOUX T,SNCHEZ-FERNNDEZ R,et al. Evidence for posttranscriptional activation of gamma-glutamylcysteine synthetase during plant stress responses[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95: 12049-12054.
[14] 冯保民, 麻 密. 植物络合素及其合酶在重金属抗性中的功能研究进展[J]. 应用与环境生物学报, 2003, 9(6): 657-661.
[15] 张计育, 佟兆国, 高志红, 等. SA、MeJA、ACC和苹果轮纹病病原菌诱导湖北海棠MhWRKY1基因的表达[J]. 中国农业科学,2011, 44(5): 990-999.
[16] 汪 仁, 蔡黎丽, 徐 晟, 等. 石蒜Mg2+转运体基因LrMGT的克隆与分析[J]. 植物资源与环境学报, 2014, 23(4): 1-7.
[17] SONG A P, LOU W H, JIANG J F. An isoform of eukaryotic initiation factor 4E fromChrysanthemummorifoliuminteracts withChrysanthemumvirusBcoat protein[J]. PLoS One, 2013, 8: e57229.
[18] VÖGELILANGE R,WAGNER G J.Subcellularlocalizationof cadmium and cadmium-binding peptides in tobacco leaves[J]. Plant Physiology, 1990, 92: 1086-1093.
[19] LI W, LI Z M, YE Q. Enzymatics synthesis of glutathione using yeast cells in two-stage reaction[J]. Bioprocess and Biosystems Engineering, 2010, 33: 675-682.
[20] 邓 治, 刘向红, 覃 碧, 等. 巴西橡胶树HbγGCS基因克隆及表达分析[J]. 植物生理学报, 2012, 48(8): 772-778.
[21] WEIS J S, WEIS P. Metal uptake, transport and release by wetland plants: implications for phytoremediation and restoration[J]. Environment International, 2004, 30: 685-700.
[22] COBBETTCS.Phytochelatinsandtheirroles in heavy metal detoxification[J]. Plant Physiology, 2000, 123: 826-832.
[23] ZENK M H. Heavy metal detoxification in higher plants: a review[J]. Gene, 1996, 179: 21-30.
[24] HELL R, BERGMANN L. γ-glutamylcysteine synthetase in higher plants: catalytic properties and subcellular localization[J]. Planta, 1990, 180: 603-612.
(责任编辑: 佟金凤)
Cloning and expression analysis ofNnγGCSgene fromNelumbonucifera
ZHANG Ahui1, LIU Zhaolei1,①, GU Chunsun2, CHEN Fadi1, JIANG Jiafu1, CHEN Sumei1
(1. College of Horticulture, Nanjing Agricultural University, Nanjing 210095, China; 2. Institute of Botany, Jiangsu Province and ChineseAcademyofSciences, Nanjing 210014, China),
J.PlantResour. &Environ., 2015, 24(4): 1-9
Taking tender leaf ofNelumbonucifera‘Taicheng Focui’as materials, full-length cDNA sequence ofγGCSgene fromN.nuciferawas obtained by degenerate primer-PCR and RACE technologies, the cDNA sequence is named asNnγGCS. The results of sequence analysis show that full-length of cDNA sequence ofNnγGCSgene is 1 801 bp, its open reading frame (ORF) length is 1 569 bp, which encodes 522 amino acid residues. Theoreticalrelativemolecularmass of NnγGCS protein is 59 159.0, theoretical isoelectric point is pI 6.27, and stability index is 39.60. The protein has no transmembrane structure domain but with one conserved GCS2 domain and the protein is localized in cytoplasm and chloroplast, indicating that NnγGCS protein is stable and belonging to glutamate cysteine ligase modulatory family. The phylogenetic analysis result shows that NnγGCS amino acid sequence ofN.nuciferahas a close relationship with γGCS amino acid sequence of dicotyledon includingDimocarpuslonganLour. andCucumissativusLinn., etc, and has a distant relationship with γGCS amino acid sequence of monocotyledon includingOryzasativaLinn., etc. The amplification results of real-time fluorescence quantitative PCR show thatNnγGCSgene can be expressed in various organs ofN.nucifera, and the relative expression in tender leaf is the highest, that in stem is the lowest. Under cadmium stress with different concentrations, differences in relative expression and expression trend ofNnγGCSgene in tender leaf and fibrous root ofN.nuciferaare great. Relative expression ofNnγGCSgene in tender leaf generally appears firstly decreasing and then increasing with prolonging of stress time, that in fibrous root appears significantly higher than original level when 200 μmol·L-1Cd stress for 1 h and 400 μmol·L-1Cd stress for 12 h, while without obvious difference with the original level at other stress times. Subcellular localization result shows thatNnγGCSgene can express in cytoplasm of epidermal cells ofAlliumcepaLinn., meaning that the protein encoded by this gene plays a role in cytoplasm. It is suggested that Cd stress with a certain concentration can induceNnγGCSgene expression.
NelumbonuciferaGaertn.;NnγGCSgene; cloning; relative expression; Cd stress; subcellular localization
2015-03-17
国家教育部新世纪优秀人才支持计划项目(NCEI-11-0669); 江苏省科技支撑计划项目(BE2011325)
张阿慧(1988—),女,安徽阜阳人,硕士研究生,主要从事荷花耐重金属的分子生物学研究。
①通信作者 E-mail: lzl@njau.edu.cn
Q943.2; Q786; Q682.32
A
1674-7895(2015)04-0001-09
10.3969/j.issn.1674-7895.2015.04.01
