不同浓度NaCl胁迫条件下马齿苋幼苗生长及叶片部分生理指标的变化
2015-06-24邢锦城赵宝泉王茂文洪立洲
邢锦城, 董 静, 赵宝泉, 王茂文, 刘 冲, 洪立洲
(江苏沿海地区农业科学研究所, 江苏 盐城 224002)
不同浓度NaCl胁迫条件下马齿苋幼苗生长及叶片部分生理指标的变化
邢锦城, 董 静, 赵宝泉, 王茂文, 刘 冲, 洪立洲①
(江苏沿海地区农业科学研究所, 江苏 盐城 224002)

马齿苋; 耐盐性; NaCl胁迫; 生长指标; 抗氧化酶活性; 苗期
土壤盐胁迫是导致农作物减产的主要非生物因子之一[1]。据统计,全世界盐碱地总面积约9.55×108hm2,占全球陆地总面积的7.26%[2]。随水资源的日趋匮乏、化肥使用量的增加以及水源和土壤污染的加重,全球将有20%的耕地和近半数的灌溉土地不同程度面临土壤盐渍化的威胁[3]。为了加强盐渍化土壤的有效利用,近年来人们对林木、农作物和野生植物的耐盐性进行了大量研究,并在盐胁迫对植物的伤害机制、植物对盐胁迫的适应性及生长和生理响应、以及提高植物耐盐性等方面获得了一定的研究成果[4-6]。
马齿苋(PortulacaoleraceaLinn.)为马齿苋科(Portulacaceae)马齿苋属(PortulacaLinn.)一年生草本植物,其茎叶营养丰富、药食兼用,在沿海滩涂地区广泛分布,是盐碱滩涂土地农业化利用的重要植物资源。目前,国内外学者对于马齿苋的研究主要集中在药用成分分析及其药理活性等方面,对于马齿苋的耐盐性及其对盐胁迫的适应性尚缺乏深入研究。本项目组前期的研究结果表明:在一定浓度NaCl胁迫条件下,马齿苋幼苗能够保持较高的净光合速率,表现出较强的耐盐性[7],但马齿苋耐盐性的生理机制目前尚不明确。
鉴于此,作者采用盆栽法对不同浓度NaCl胁迫条件下马齿苋幼苗的生长状况进行分析,并比较了不同处理时段马齿苋幼苗部分生理生化指标的变化,以期探究盐胁迫对马齿苋幼苗的毒害作用、明确马齿苋幼苗的耐盐机制,为扩展马齿苋在盐渍土壤上的开发种植及其耐盐品种选育和栽培技术研究提供基础实验数据。
1 材料和方法
1.1 材料
供试马齿苋品种‘苏马齿苋1号’(‘Sumachixian No. 1’)种子由江苏沿海地区农业科学研究所提供。种子用质量分数0.1%HgCl2消毒10 min,充分冲洗后播种于装满基质的50孔穴盘中;栽培基质为按体积比1∶1∶1配制的蛭石-珍珠岩-石英砂混合基质,用1/2 Hoagland营养液浇灌;将穴盘置于GZX-400BS-Ⅲ型人工气候箱(上海新苗医疗器械有限公司)中发芽,昼温和夜温分别为28 ℃和25 ℃,相对湿度60%、光照时间12 h·d-1、光照强度622 μmol·m-2·s-1。待幼苗进入四叶期时进行间苗,每个穴盘定植幼苗1株,转入玻璃温室中于自然光照条件下培养;待幼苗株高约15 cm 时,选取长势一致的幼苗用于NaCl胁迫处理。
1.2 方法
1.2.1 NaCl胁迫处理 用去离子水将供试幼苗冲洗干净后,将其固定在塑料周转箱中并置于玻璃温室内,在自然光照条件下用1/2 Hoagland营养液预培养7 d后进行NaCl胁迫处理。用1/2 Hoagland营养液配制NaCl处理液,处理液中NaCl终浓度分别为0(CK)、50、100、150和200 mmol·L-1。胁迫处理共持续21 d,期间每5天更换1次处理液,每处理10 株幼苗,各5 次重复。
1.2.2 生长指标测定 在胁迫处理21 d时,每处理随机选取3株幼苗,测定幼苗的单株叶片数、株高、根长、主茎直径、单株鲜质量和单株干质量。
单株叶片数为整株幼苗的叶片总数量。用精度0.1 cm直尺测量幼苗的株高和根长,株高为从根颈部到生长点的长度,根长为从根颈部到根尖的长度。用精度0.1 mm游标卡尺测量幼苗主茎直径,主茎直径即为根与茎结合部的直径。幼苗用自来水冲洗干净,吸干表面水分后分别用精度10 mg 的MP500B型电子天平(上海良平仪器仪表有限公司)称量全株鲜质量;然后置于105 ℃杀青2 h,于60 ℃烘干至恒质量,称量全株干质量。上述各指标的测量结果均以平均值计。



1.3 数据统计和分析
采用EXCEL 2010 和SPSS12.0统计分析软件对实验数据进行处理,并计算平均值;采用“t-检验”进行差异显著性分析。
2 结果和分析
2.1 不同浓度NaCl胁迫对马齿苋幼苗生长的影响
在不同浓度NaCl胁迫条件下马齿苋幼苗各项生长指标的测定结果见表1。
结果显示:在50 mmol·L-1NaCl胁迫条件下,马齿苋幼苗的单株鲜质量、株高、根长和单株叶片数略高于或略低于对照,但与对照均无显著差异(P>0.05)。在100、150和200 mmol·L-1NaCl胁迫条件下,幼苗的单株鲜质量、株高、根长和单株叶片数均随NaCl浓度升高而降低,且多数指标与对照差异显著(P<0.05);其中,在200 mmol·L-1NaCl胁迫条件下,幼苗的单株鲜质量、株高、根长和单株叶片数分别较对照降低53.5%、24.6%、44.2%和38.5%,差异达显著水平。随NaCl浓度升高,单株干质量和主茎直径呈低浓度时增大,中、高浓度时减小的变化趋势,且均在50 mmol·L-1NaCl胁迫条件下达到最高,分别较对照增加4.8%和5.2%,差异显著;在100、150和200 mmol·L-1NaCl胁迫条件下,单株干质量和主茎直径均显著低于对照,且在200 mmol·L-1NaCl胁迫条件下最低,较对照分别降低35.7%和19.2%。
实验结果表明:低浓度NaCl胁迫对马齿苋幼苗的主茎生长和干质量有一定的促进作用,但因细胞失水等原因导致其幼苗鲜质量无显著变化。高浓度NaCl处理对马齿苋地上和地下部分的生长均有抑制作用,且NaCl浓度越高抑制作用越明显。在所测定的生长指标中,单株鲜质量和根长的降幅最大、受到的抑制作用最显著,表明NaCl胁迫通过抑制马齿苋幼苗根的生长阻碍其对养分、水分及矿物质的吸收,从而对其地上部分的生长产生一定的抑制作用。



NaCl浓度/mmol·L-1ConcentrationofNaCl单株鲜质量/gFreshweightperplant单株干质量/gDryweightperplant株高/cmPlantheight根长/cmRootlength主茎直径/mmMainstemdiameter单株叶片数Leafnumberperplant 0(CK)12.50±0.94a0.84±0.09b29.13±3.35a15.25±1.86a5.98±0.25b41.0±4.0a 5012.65±0.85a0.88±0.10a28.18±3.58a15.00±1.70a6.29±0.55a40.2±5.2a 10011.86±1.12b0.79±0.08c27.62±3.45ab13.10±0.95b5.71±0.22c38.3±2.6ab 1508.56±0.32c0.62±0.12d25.60±2.65b10.70±1.20c5.21±0.47d32.2±1.7b 2005.81±0.80d0.54±0.14d21.97±2.33c8.51±1.05d4.83±0.33e25.2±2.3c
1)同列中不同的小写字母表示差异显著(P<0.05) Different small letters in the same column indicate the significant difference (P<0.05).


2.2.2 MDA含量的变化 由表3可见:各处理组叶片初始MDA含量以及对照组叶片在各时间段的MDA含量均无显著差异;随NaCl浓度的升高及胁迫时间延长,各处理组叶片的MDA含量总体呈现逐渐升高的趋势,且除50 mmol·L-1NaCl处理组外,均显著高于对照及各自的初始值。表明NaCl胁迫可引起马齿苋叶片细胞内的膜脂过氧化反应。
随NaCl浓度的升高,MDA含量逐渐提高。在50、100、150和200 mmol·L-1NaCl胁迫条件下,叶片MDA含量分别在胁迫处理7、7、7和15 d时达到最高,分别较各自的初始值增加了17.0%、47.4%、94.0%和148.7%,与对照差异显著。随NaCl胁迫时间的延长,在低浓度(50 mmol·L-1)NaCl胁迫条件下,叶片MDA含量呈现先增加后降低的趋势,在处理7 d时达到最高且随后逐渐降低,处理15 d时叶片MDA含量与对照无显著差异;而在中、高浓度(100、150和200 mmol·L-1)NaCl胁迫条件下,马齿苋叶片中MDA含量随处理时间延长逐渐增加,均与对照有显著差异,且NaCl浓度越高MDA含量增幅越大。表明低浓度NaCl胁迫条件下,马齿苋叶片细胞质膜的氧化损伤随处理时间延长逐渐被修复;而中、高浓度NaCl胁迫则引发其细胞质膜的持续氧化损伤。



NaCl浓度/mmol·L-1ConcentrationofNaCl不同处理时间叶片的O-·2含量/μmol·min-1·g-1 O-·2contentinleafatdifferenttreatmenttimes0d1d3d7d15d 0(CK)6.84±0.34e6.72±0.45e7.18±0.26e6.85±0.53e7.22±0.25e 506.98±0.75e7.25±0.29e8.25±0.25d8.14±0.30d8.07±0.62d 1006.67±0.26e10.25±1.16bc12.35±0.62b12.22±1.87b12.33±0.73b 1507.02±0.28e11.58±1.64b14.58±1.24ab15.87±1.05ab16.64±0.92ab 2006.85±0.34e12.65±0.38b16.88±1.88ab18.35±0.98a20.45±2.22a
1)不同的小写字母表示差异显著(P<0.05) Different small letters indicate the significant difference (P<0.05).



NaCl浓度/mmol·L-1ConcentrationofNaCl不同处理时间叶片的MDA含量/μmol·g-1 MDAcontentinleafatdifferenttreatmenttimes0d1d3d7d15d 0(CK)1.46±0.36e1.44±0.13e1.52±0.05e1.50±0.35e1.55±0.62e 501.41±0.14e1.42±0.39e1.51±0.54e1.65±0.20d1.54±0.36e 1001.52±0.51e1.68±0.42d2.19±0.25c2.24±0.38c1.81±0.32cd 1501.51±0.25e1.91±0.34cd2.66±0.43bc2.93±0.18b2.85±0.14b 2001.54±0.44e2.32±0.22c3.44±0.31a3.75±0.24a3.83±0.52a
1)不同的小写字母表示差异显著(P<0.05) Different small letters indicate the significant difference (P<0.05).
2.3 不同浓度NaCl胁迫条件下马齿苋幼苗叶片中抗氧化酶活性的变化
在不同浓度NaCl胁迫条件下,不同处理时间马齿苋幼苗叶片中超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性的变化分别见表4、表5和表6。

2.3.2 POD活性的变化 由表5可知:在不同浓度NaCl胁迫条件下,马齿苋叶片中POD活性的变化趋势与SOD活性的变化趋势基本一致,各处理组叶片的初始POD活性以及对照组叶片在各时间段的POD活性均无显著差异。随NaCl浓度升高和胁迫时间延长,叶片POD活性总体呈先升高后降低的变化趋势,且NaCl浓度越高POD活性变幅越大。在50、100、150和200 mmol·L-1NaCl胁迫条件下,叶片的POD活性均在处理1 d时达到最高,分别较对照增加了18.6%、36.8%、64.5%和77.8%,差异显著;此后各处理组POD活性快速下降,其中50 mmol·L-1处理组的POD活性与对照无显著差异,而其他处理组的POD活性与对照均有显著差异,至处理15 d时,100、150和200 mmol·L-1NaCl处理组的POD活性降至最低,较对照分别降低15.3%、22.5%和55.1%。实验结果表明:NaCl胁迫能够在短时间内诱导POD活性升高,但高浓度、长时间的NaCl胁迫则可导致POD活性降低。



NaCl浓度/mmol·L-1ConcentrationofNaCl不同处理时间叶片的SOD活性/U·g-1 SODactivityinleafatdifferenttreatmenttimes0d1d3d7d15d 0(CK)69.25±9.65e73.55±7.13e72.86±8.28e74.62±9.26e68.35±8.18e 5072.15±5.05e79.64±11.25de85.85±13.63d71.66±7.25e72.85±11.57e 10075.28±8.32e110.65±15.45c102.45±11.05cd88.92±7.05d60.50±6.25f 15074.29±6.55e175.55±19.50ab140.25±15.50b115.83±13.13c52.25±12.85f 20077.26±12.25e217.35±15.58a156.13±14.05b117.40±8.25c42.18±7.25f
1)不同的小写字母表示差异显著(P<0.05) Different small letters indicate the significant difference (P<0.05).



NaCl浓度/mmol·L-1ConcentrationofNaCl不同处理时间叶片的POD活性/U·g-1·min-1 PODactivityinleafatdifferenttreatmenttimes0d1d3d7d15d 0(CK)85.43±12.35e82.36±8.15e80.72±4.53e81.65±7.75e86.35±9.82e 5079.63±9.64e97.71±7.55d91.50±6.75e82.55±11.08e88.43±11.35e 10084.45±11.15e112.65±13.62c109.56±6.84c107.50±16.35c73.18±5.44ef 15086.15±13.26e135.52±10.50a124.23±8.85b95.85±8.75d66.88±3.55f 20082.44±5.43e146.41±15.52a122.48±11.03b96.87±6.98d38.75±5.15f
1)不同的小写字母表示差异显著(P<0.05) Different small letters indicate the significant difference (P<0.05).



NaCl浓度/mmol·L-1ConcentrationofNaCl不同处理时间叶片的CAT活性/U·g-1·min-1 CATactivityinleafatdifferenttreatmenttimes0d1d3d7d15d 0(CK)148.78±13.65d152.46±13.53d145.38±18.75d149.63±9.62d155.42±14.35d 50152.69±17.55d202.38±23.25b217.88±25.62b179.35±9.88c169.52±8.91cd 100157.84±16.65d228.65±15.52a235.78±18.75a198.75±22.45b187.33±20.62c 150149.63±21.42d195.98±19.85bc176.25±19.26c129.79±13.62e118.45±8.65e 200159.62±12.76d140.75±18.52de127.63±6.95e105.45±8.79f104.38±5.41f
1)不同的小写字母表示差异显著(P<0.05) Different small letters indicate the significant difference (P<0.05).
2.3.3 CAT活性的变化 由表6可知:各处理组叶片的初始CAT活性以及对照组叶片在各时间段的CAT活性均无显著差异。随NaCl浓度的提高,叶片CAT活性均呈先升高后降低的变化趋势;而随处理时间延长,叶片CAT活性在50、100和150 mmol·L-1NaCl胁迫条件下呈现先升高后降低的变化趋势,在200 mmol·L-1NaCl胁迫条件下则呈现逐渐降低的变化趋势。在50和100 mmol·L-1NaCl胁迫条件下CAT活性在处理3 d时达到最高,分别较对照提高了49.9%和62.2%,其后逐渐降低,但均高于对照,且总体上与对照差异显著;在150 mmol·L-1NaCl胁迫条件下CAT活性在处理1 d时达到最高,较对照提高28.5%,其后逐渐降低且在处理7和15 d时低于对照,且各时间段的CAT活性与对照均有显著差异;在200 mmol·L-1胁迫条件下叶片CAT活性持续下降,且在处理的各时间段均低于对照,其中在处理的3、7和15 d时与对照均有显著差异,并在处理15 d时降至最低,仅为对照的32.8%。实验结果表明:较低浓度及短期的NaCl胁迫能够诱导马齿苋叶片CAT活性的升高,以抵御胁迫造成的过氧化伤害;而较高浓度及较长时间的NaCl胁迫则对叶片产生严重伤害,导致CAT活性的降低。
3 讨论和结论
盐分对植物最直接和最明显的胁迫效应就是抑制植株生长,抑制程度既取决于植物的抗盐能力、又受到盐胁迫水平的影响。幼苗形态建成是植物生长的关键时期,也是植物对NaCl胁迫最为敏感的时期[11]。本研究结果表明:较低浓度(50 mmol·L-1)NaCl胁迫对马齿苋幼苗生长无明显的抑制作用,反而对马齿苋幼苗生长有一定促进作用。在NaCl胁迫条件下马蔺〔Irislacteavar.chinensis(Fisch.) Koidz.〕幼苗生长量的变化也有此规律[12]。低浓度NaCl胁迫能够促进马齿苋幼苗主茎直径增加和干物质的积累,可能与马齿苋幼苗为了应对渗透胁迫而增大了矿质元素的吸收量并合成可溶性有机物[13]有关。较高浓度的NaCl胁迫(100和200 mmol·L-1)对马齿苋幼苗生长和生物量积累均有明显的抑制效应,洪立洲等[7]对马齿苋的相关研究也得出了相似的结论;并且,在本研究涉及的生长指标中,株高和根长受高浓度NaCl胁迫的抑制效果最显著,这些现象均表明马齿苋幼苗地下部分(根)和地上部分(茎)对高浓度NaCl胁迫比较敏感。这可能与高浓度NaCl胁迫阻碍了根对水分和矿质营养的吸收并抑制了植物的光合作用有关;同时也说明植株在NaCl胁迫条件下可调整其生长和生物量分配策略以适应胁迫环境[14]。
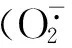


[1] ZHU J K. Plant salt tolerance[J]. Trends in Plant Science, 2001, 6: 66-71.
[2] 甘海峰, 刘可慧, 傅翠娜, 等. NaCl胁迫对不同柑橘砧木品种抗氧化系统的影响[J]. 生态环境学报, 2010, 19(1): 183-187.
[3] 赵 昕, 杨小菊, 石 勇, 等. 盐胁迫下荒漠共生植物红砂与珍珠的根茎叶中离子吸收与分配特征[J]. 生态学报, 2014, 34 (4): 963-972.
[4] 林栖风, 李冠一. 植物耐盐性研究进展[J]. 生物工程进展, 2000, 20(2): 20-25.
[5] 冯 固, 李晓林, 张福锁, 等. 施磷和接种AM真菌对玉米耐盐性的影响[J]. 植物资源与环境学报, 2000, 9(2): 22-26.
[6] ASADA K.Thewater-watercycleinchloroplasts: scavenging of active oxygens and dissipation of excess photons[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1999, 50: 601-639.
[7] 洪立洲, 王茂文, 丁海荣, 等. NaCl胁迫对马齿苋光合作用及叶绿素荧光特性的影响[J]. 西北植物学报, 2011, 31(12): 2516-2521.
[8] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 260-261.
[9] 邹 琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2000.
[10] 张立军, 樊金娟. 植物生理学实验教程[M]. 北京: 中国农业大学出版社, 2007.
[11] 郭秀林, 刘子会, 赵会嶶, 等. 热锻炼和高温胁迫下冬小麦热激蛋白与抗氧化酶基因表达[J]. 华北农学报, 2014, 29(4): 13-18.
( Continuedonpage82)( Continuedfrompage75)
[12] 张明轩, 黄苏珍, 绳仁立, 等. NaCl胁迫对马蔺生长及生理生化指标的影响[J]. 植物资源与环境学报, 2011, 20(1): 46-52.
[13] AUBERT S, HENNION F, BOUCHEREAU A, et al. Subcellular compartmentation of proline in the leaves of the subantarctic Kerguelen cabbagePringleaantiscorbuticaR. Br.invivo13C-NMR study[J]. Plant, Cell and Environment, 1999, 22: 255-259.
[14] GREENWAY H, MUNNS R. Mechanism of salt tolerance in non-halophytes[J]. AnnualReviewofPlantPhysiology, 1980, 31: 149-190.
[15] BORSANI O, VALPUESTA V, BOTELLA M A. Evidence for a role of salicylic acid in the oxidative damage generated by NaCl and osmotic stress inArabidopsisseedlings[J]. Plant Physiology, 2001, 126: 1024-1030.
[17] 金 兰, 罗桂花. 盐胁迫对紫花苜蓿SOD、丙二醛及SOD 同工酶的影响[J]. 黑龙江畜牧兽医, 2004(5): 15-16.
[18] 裴 斌, 张光灿, 张淑勇, 等. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J]. 生态学报, 2013, 33(5): 1386-1396.
[19] 樊瑞苹, 周 琴, 周 波, 等. 盐胁迫对高羊茅生长及抗氧化系统的影响[J]. 草业学报, 2012, 21(1): 112-117.
[20] 郝福顺, 崔香环, 赵世领, 等. 渗透胁迫对黑麦幼苗活性氧和抗氧化酶活性的影响[J]. 植物学通报, 2007, 24(5): 603-608.
(责任编辑: 惠 红)
Change on seedling growth and some physiological indexes in leaf ofPortulacaoleraceaunder NaCl stress with different concentrations
XING Jincheng, DONG Jing, ZHAO baoquan, WANG Maowen, LIU Chong, HONG Lizhou①
(Institute of Agricultural Sciences in Coastal Area of Jiangsu, Yancheng 224002, China),
J.PlantResour. &Environ., 2015, 24(4): 69-75

PortulacaoleraceaLinn.; salt tolerance; NaCl stress; growth index; antioxidant enzyme activity; seedling stage
2015-03-27
江苏省农业科技自主创新探索类项目〔CX(13)5083〕; 江苏省自然科学基金面上项目(BK20151301)
邢锦城(1983—),男,山东滕州人,硕士,助理研究员,主要从事植物逆境生理方面的研究。
①通信作者 E-mail: ychonglz@163.com
Q945.78
A
1674-7895(2015)04-0069-07
10.3969/j.issn.1674-7895.2015.04.09
