碳青霉烯酶药物不敏感的肠杆科细菌中KPC酶的检测及分析
2015-06-24佘姝敏詹希美吴多荣
黄 会,佘姝敏,詹希美,吴多荣
碳青霉烯酶药物不敏感的肠杆科细菌中KPC酶的检测及分析
黄 会1,佘姝敏2,詹希美3,吴多荣1
目的 了解海南地区三级医院中肠杆菌科细菌产KPC酶的流行状况及型别特点。方法 收集2012年8月到2013年6月海南地区四家三级医院无菌部位分离的对亚胺培南或厄他培南中介或耐药的肠杆菌科细菌43株,运用改良Hodge试验进行KPC表型筛查;PCR的方法进行基因型别检测。结果 43株细菌中,21株改良Hodge试验阳性;PCR检测3株为阳性,基因测序比对分析均为KPC-2型。结论 海南地区对碳青霉烯酶类药物不敏感的肠杆科细菌中KPC酶的主要基因型别KPC-2型,携带KPC酶的质粒可在不同种属细菌间水平传递,临床应加强监控,防止产碳青霉烯酶菌株在医院环境中暴发和流行。
碳青霉烯酶;KPC;肠科杆细菌;改良Hodge试验
肠杆菌科细菌如肺炎克雷伯菌、大肠埃希菌等作为社区获得性和医院感染的重要病原菌,常可引起泌尿道、腹腔、胆道及呼吸道感染以及全身系统性感染。由于抗菌药物的大量使用,肠杆菌科细菌的耐药现象也十分普遍,甚至出现了碳青霉烯类抗生素耐药的肠杆科细菌。而KPC酶的产生是目前引起肠杆菌科细菌对碳青霉烯类抗生素耐药的主要原因[1]。迄今为止,在法国、哥伦比亚和以色列等许多国家和地区相继报道了产KPC酶的菌株[2-3],说明产 KPC酶的菌株已在世界各地相继流行和播散。在国内,2007年我国由魏泽庆等人首次报道在浙江地区发现了产KPC-2型碳青霉烯酶的肺炎克雷伯菌[4],其后在我国一些南方省份开始流行,并在大肠埃希菌、粘质沙雷氏菌、费氏柠檬酸杆菌等菌中相继发现了KPC-2型碳青霉烯酶。
本研究首次对海南地区碳青霉烯酶药物不敏感的肠杆科细菌进行KPC酶的检测,以了解海南地区肠杆菌科细菌产KPC酶状况,以指导临床合理使用抗菌药物和及时好耐药菌株的流行控制,对阻止或减缓产KPC型碳青霉烯酶细菌的产生及扩散和预防医院感染方面具有重要意义,现报道如下。
1 材料与方法
1.1 菌株来源和鉴定 43株对亚胺培南或厄他培南中介或耐药的肠杆菌科细菌均来自海南四家综合性三级甲等医院,其中海口市人民医院21株、海南省人民医院10株、三亚市人民医院6株、海南省农垦总医院6株。入选标准为:来自无菌部位的非重复性的且对亚胺培南或厄他培南中介或耐药的肠杆菌科细菌。其中自中段尿标本21株、分泌物8株、血液标本5株、胸腹水和胆汁5株、其他标本4株。所有的分离株均使用法国梅里埃Vitek2 Compact 全自动细菌仪再次进行菌株鉴定、药敏试验及MIC值的测定。质控菌株为大肠埃希菌ATCC25922、ATCC35218均来自卫生部临床检验中心。
1.2 改良Hodge 试验 操作步骤按照2012年CLSI标准进行操作:用生理盐水制备0.5麦氏浊度单位的大肠埃希菌ATCC25922浊菌液,用生理盐水10倍稀释后,用棉签蘸取菌液均匀涂布M-H平板(在平板表面均匀涂布,并沿平板内缘均匀涂抹一周),30 s后用无菌镊子在平板中间贴10 μg/片厄他培南纸片,并用镊子往下轻轻按压,使纸片与琼脂紧密结合,再用无菌接种环挑取3~5个待测菌落,将菌株从纸片边缘向外沿离心方向划20~25 mm长的直线,每个平板可接种3个待测菌株,标记后放入35 ℃培养箱中孵育18~24 h后观察结果,如果在被测菌株与大肠埃希菌ATCC25922抑菌环交汇处大肠埃希菌生长增强,即为产碳青霉烯酶。阳性对照为产KPC酶肺炎克雷伯菌;阴性对照为肺炎克雷伯菌ATCC700603。
1.3 PCR基因扩增及测序
1.3.1 模板处理 用无菌接种环挑取2~4个菌落置于装有300 μL三蒸水的EP管中,振荡混匀,放于100 ℃干浴锅中干浴10 min,迅速置于冰盒中冷却5 min,1 200 r/min离心5 min,取上清DNA模板移入新的EP管,放-20℃保存备用。
1.3.2 基因检测 通过已经设计好的引物(见表1),进行PCR扩增。PCR整体反应的25 μL反应体系:模板DNA1 μL;引物1 μL;超纯净三蒸水9.5 μL;Taq酶12.5 μL。PCR反应的条件如下:94 ℃预变性4 min,然后 95 ℃ 50 s,57 ℃ 50 s,72 ℃ 60 s, 30个循环后,72 ℃延长7 min。将扩增得到的产物进行2%琼脂糖凝胶电泳,将电泳完成的凝胶放入EB溶液中显色,在电泳凝胶扫描成像仪中扫描并记录结果,出现目的条带的为阳性。

表1 PCR 扩增基因引物序列
1.3.3 阳性基因测序及序列比对 将上述PCR产物送去上海美吉生物医药科技有限公司进行测序,测序后在 GenBank运用BLAST进行比对。
2 结 果
2.1 鉴定和药敏结果 从四家医院收集来的43株菌株鉴定复核无误,其中大肠埃希15株,阴沟肠杆菌9株,肺火克雷伯菌9株, 弗劳地柠檬酸杆菌4株,粘质沙雷菌 3株,其它菌株3株。重复药敏试验显示均为对厄他培南、亚胺培南或美罗培南中介或耐药的菌株,43株细菌对常见抗生素的耐药情况见表2。
2.2 改良Hodge试验筛查结果 改良Hodge试验结果判断:在划线与抑菌圈的交叉处若细菌有增强生长的趋势,使抑菌圈内呈矢状生长者(典型为苹果蒂样生长)为阳性,否则为阴性。在43株药敏初筛试验阳性菌中,21株为改良Hodge试验阳性。
2.3 KPC基因检测结果 对21株表型筛查阳性的菌株进行KPC基因扩增结果显示,有3株菌的PCR产物经凝胶电泳后出现目的条带,电泳结果见图2。将PCR产物送上海美吉生物医药科技有限公司测序,所得DNA序列用BLAST程序与GenBank中的BLAST数据库进行比对,比对结果3株阳性菌株均为KPC-2型基因,相似度99%。
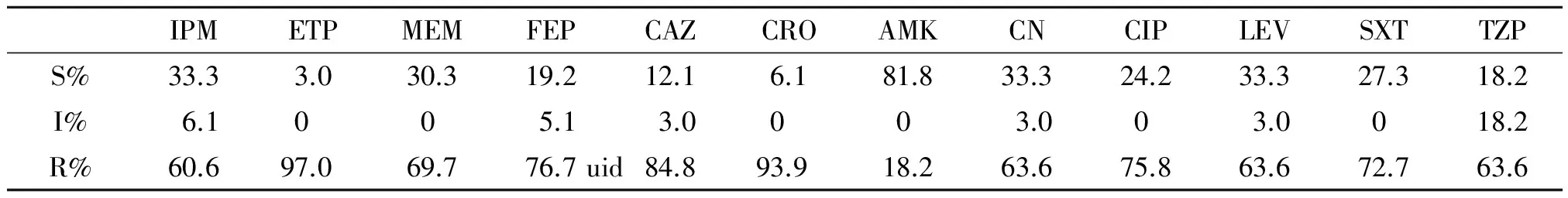
表2 43株肠杆科细菌对常见抗生素的耐药情况
Note: IPM--Imipenem; MEM--Meropenem; ETP--Ertapenem; FEP--Cefepime; CAZ--Peftazidime; CRO--Ceftriaxone; AMK--Amikacin; CN--Gentamicin; CIP--Ciprofloxacin; LEV--Levofloxacin; SXT--Sulfamethoxazole.

M: DL 2000 DNA Marker; 1: Negative control; 2-22: Amplification results of clinical strains.
3 讨 论
碳青霉烯类抗生素是抗菌谱最广,抗菌活性最强的非典型β-内酰胺抗生素,因其具有对β-内酰胺酶稳定以及毒性低等特点,已经成为治疗严重细菌感染最主要的抗菌药物之一。临床主要致病菌对碳青霉烯类的耐药很少见,在革兰阴性菌中主要以鲍曼不动杆菌和铜绿假单胞菌为主,一般来说对肠杆科的细菌敏感性较高,但是随着碳青酶烯类抗生素在临床的大量和不规范的应用,关于肠杆科细菌耐碳青霉烯类药物的报道也越来越多[5-6]。
本研究中我们收集了2012年8月到2013年6月海南地区四家三甲医院住院患者无菌部位非重复分离的对亚胺培南或美罗培南中介或耐药的43株分离菌,对亚胺培南、厄他培南和美罗培南的耐药率分别为60.6%、97.0%和69.7%,对β-内酰胺类耐药率亦很高,对于三代头孢菌素耐药率高达93.9%,对喹诺酮类药物耐药为75.8%,对庆大霉素耐药率为63.6%,仅对阿米卡星耐药率相对较低,与各医院往年情况相比,对碳青霉烯类抗生素的耐药的肠杆科细菌出现上升的趋势,这可能与抗生素特别是三、四代头孢菌素类和碳青霉烯类抗生素的广泛使用有关,应引起临床医师和微生物工作人员的重视。呼吸道标本因合格率较差且较难判定是致病菌还是定植菌,故在本研究中未收集。
肠杆科细菌耐碳青霉烯类药物的机制主要是产碳青霉烯酶,包括:A类碳青霉烯酶;B类碳青霉烯酶(即金属酶,常见的有VIM、IPM,最近报道超级细菌携带的NDM—1也属于B类碳青霉烯酶);D类碳青霉烯酶(如OXA系列,但一般在肠杆菌科细菌中较少见)[7]。其中最为常见的是KPC型碳青霉烯酶,它是近年发现的一种新型碳青霉烯酶,它首次发现是在美国卡罗利亚州北部的一株肺炎克雷伯菌中分离得到的,故将其命名为 KPC[8]。迄今,Genbank已收录的KPC有14种之多。全球范围报道的KPC型碳青霉烯酶多以 KPC-2和KPC-3为主,我国以KPC-2为主[9]。含有这种质粒基因的菌株通常是多重耐药,可供选择治疗方法不多,并造成很高的死亡率,而且它传播速度非常快,可以在不同的种属中传播, KPC型碳青霉烯酶已引起了临床特别注意,成为医院感染控制和流行病学的新的挑战,早期发现这样的菌株是至关重要的。
本研究中,在 43株分离株中有21株经改良Hodge试验表型筛查为阳性,其中有3株菌的PCR产物经凝胶电泳后出现目的条带,测序比对结果3株阳性菌株均为KPC-2型基因,其他菌株耐药或敏感性下降的原因可能为产金属酶、其他β-内酰胺酶或合并多种酶需要进行进一步的研究。3株阳性菌分别为弗氏柠檬酸杆菌、大肠埃希菌、产酸克雷伯菌。据报道,目前产KPC型碳青霉烯酶的细菌有大肠埃希菌、阴沟肠杆菌、 产酸克雷伯菌、沙门菌属、变形菌属、弗氏柠檬酸杆菌、奥克西托克雷伯菌、褪色沙雷菌、铜绿假单胞菌、鲍氏不动杆菌等。本研结果表明在海南地区KPC型碳青霉烯酶亦不仅仅是存在于肺炎克雷伯菌中,亦存在跨种属传播的现象,目前还未出现流行。
值得注意的是这3株菌均分离于中段尿标本中,3例病人均有插尿管操作,这种有创的操作可能也是感染KPC型碳青霉烯酶肠杆科细菌的危险因素。另外,3例病人中年龄分别为5岁,71岁,72岁,这些病人免疫力较差,其中两例有基础性疾病,年龄和基础性疾病与感染也是有密切关系的,但因为研究得到的阳性菌株数目太少,这些因素和感染的关系还需要更多的数据的支持。另外,在本试验中我们只对KPC型碳青霉烯酶做了检测,下一步研究将对包括ESBL、VIM、IPM、NDM-1的基因进行检测,以进一步对肠杆科细菌耐碳青霉烯类药物的机制进行全面的了解。
研究表明海南地区已出现产KPC型碳青霉烯酶肠杆科细菌,其主要的基因型别为KPC-2,携带KPC型碳青霉烯酶的质粒可在不同种属细菌间进行转移,临床和微生物室应加强监控,防止产碳青霉烯酶菌株在医院环境中暴发和流行。
[1]Naas T, Nordman P, Vedel G, et al. Plasmid-mediated carbapenem-hydrolyzing beta- lactamase KPC in aKlebsiellapneumoniae isolate from France[J]. Antimicrob Agents Chemother, 2005, 49(10): 4423-4426.DOI:10.1128/AAC.49.10.4423-4424.2005
[2]Villegas MV, Lolans K, Correa A, et al. First detection of the plasmid-mediated class A carbapenemase KPC-2 in clinical isolates ofKlebsiellapneumoniae from South America[J]. Antimicrob Agents Chemother, 2006, 50(8): 2880-2882. DOI: 10.1128/AAC.00186-06
[3]Navon Venezia S, Chmelnitsky I, Leavitt A, et al. Plasmid-mediated imipenem-hydrolyzing enzyme KPC-2 among multiple carbapenem-resistantEscherichiacoliclones in Israel[J]. Antimicrob Agents Chemother, 2006, 50(9): 3098-3102. DOI: 10.1128/AAC.00438-06
[4]Wei ZQ, Du XX, Yu YS, et al. Plasmid-mediated KPC-2 in aKlebsiellapneumoniae isolate from China[J]. Antimicrob Agents Chemother, 2007, 51(2): 763-766.DOI: 10.1128/AAC.01053-06
[5]Ning MZ, Shen H, Yin YW, et al. Distribution of KPC enzymes and integrons in imipenem-resistantEnterobacteriaceaein Nanjing[J].Chin J Nosocomiol,2012, 22(19): 4181-4183. (in Chinese) 宁明哲, 沈瀚, 印玉炜, 等.南京地区耐亚胺培南肠杆菌科细菌碳青霉烯酶及整合子调查[J].中华医院感染学杂志, 2012, 22(19):4181-4183.
[6]Liu Y, Li FQ, Jiang WY, et al. Study on the drug-resistance mechanism of plasmid-mediated KPC-2 carbapenemase possessingKlebsiellapneumoniaeisolated from children[J].Chin J Microbiol Immunol, 2012, 32(10): 861-865. (in Chinese) 刘洋, 李方去, 蒋伟燕, 等.质粒介导KPC-2型碳青霉烯酶肺炎克雷伯菌儿童分离株耐药基因研究[J].中华微生物学和免疫学杂志, 2012, 32(10):861-865
[7]Yu YS. Should raise understanding of Carbapenemase- producting "superbugs"[J].Nat Med J China, 2010, 90(46): 3241-3243. (in Chinese) 俞云松.应提高对产碳青霉烯酶“超级细菌”的认识[J].中华医学杂志, 2010, 90(46):3241-3243
[8]Yigit H, Queenan AM, Anderson GJ, et al. Novel carbapenem-hydrolyzing β-lactamase, KPC-1, from a carbapenem-resistant strain ofKlebsiellapneumoniae[J]. Antimicrob Agents Chemother, 2001, 45(4): 1151-1161. DOI: 10.1128/AAC.45.4.1151-1161.2001
[9]Qiu LP, Chang YZ, Zhu JY, et al. Durg resistance genes inKlebsiellapneumoniaeand control of nosocomial infections[J]. Chin J Nosocomiol, 2013, 23(19): 4605-4608. (in Chinese) 裘莉佩, 常燕子, 竺军洋, 等.肺炎克雷伯菌耐药基因及医院感染控制研究[J].中华医院感染学杂志, 2013, 23(19):4605-4608.
KPC carbapenemases amongEnterobacteriaceaewith carbapenem non-susceptibility
HUANG Hui1,SHE Shu-min2,ZHAN Xi-mei3,WU Duo-rong1
(1.ClinicalLaboratory,HaikouMunicipalHospital,Haikou570208,China; 2.SchoolofTropicalMedicineandLaboratoryMedicine,HainanMedicalCollege,Haikou571199,China; 3.DepartmentofPathogenBiology,ZhongshanMedicalCollege,SunYat-senUniversity,Guangzhou51008,China)
To investigate the prevalence and gene types of KPC inEnterobacteriaceaestrains isolated from 4 tertiary general hospitals in Hainan area, a total 43 isolates which were resistant or intermediate to imipenem or ertapenem were collected from sterile sites between August 2012 and June 2013 from 4 tertiary general hospitals in Hainan area. Modified Hodge Tests (MHT) were performed for KPC phenotype screening. PCR amplification and DNA sequence were performed to analyze the encoding genes of KPC. Results showed that in the 43 isolates, 21 strains were positive in MHT. PCR and DNA sequence analysis confirmed that 3 isolates produced KPC-2. It's suggested that there were theEnterobacteriaceaecarrying KPC in Hainan area. The encoding genes were KPC-2. The KPC gene could be horizontally transmitted by plasmid among different groups of bacteria. It is important to control the transmission of theseEnterobacteriaceaecarrying KPC.
carbapenemase;Klebsiellapneumoniae carbapenemases;Enterobacteriaceae; Modified Hodge Test
Wu Duo-rong, Email: wuduorong@163.com
10.3969/cjz.j.issn.1002-2694.2015.03.013
海口市重点科技计划项目(No.2012-070)
吴多荣,Email:wuduorong@163.com
1.海口市人民医院 中南大学湘雅医学院附属海口医院检验科,海口 570208; 2.海南医学院热带医学与检验医学院,海口 570208 3.中山大学中山医学院病原生物部,广州 510080
R378.2
A
1002-2694(2015)03-0247-04
Supported by the Key Project of Haikou Science and Technology Planning (No. 2012-070)
2014-09-12;
2014-12-04
