壬基酚降解菌的分离筛选及其降解条件的优化
2015-06-23唐玉斌陈芳艳王新刚
马 娟,杨 芬,唐玉斌,陈芳艳,王新刚
(1.江苏科技大学环境与化学工程学院,江苏镇江 212018) (2.江苏科技大学生物技术学院,江苏镇江 212018)
壬基酚降解菌的分离筛选及其降解条件的优化
马 娟1,2,杨 芬2,唐玉斌1*,陈芳艳1,王新刚1
(1.江苏科技大学环境与化学工程学院,江苏镇江 212018) (2.江苏科技大学生物技术学院,江苏镇江 212018)
为了有效地对壬基酚(NP)污染水环境进行生物修复,丰富高效降解NP的微生物资源,从垃圾填埋场的垃圾渗滤液中,分离得到两株NP高效降解菌SLY7和SLY8,根据菌落的形态特征和16S rDNA序列分析,初步鉴定SLY7为施氏假单胞菌(Pseudomonas stutzeri),SLY8为非脱羧勒克菌(Leclercia adecarboxylata).通过摇瓶实验考察NP的初始浓度、pH、温度以及投菌量等因素对菌株降解NP能力的影响.结果表明:菌株SLY7的最佳降解条件为温度30℃,pH为8.0,接种量3%(V/ V),振荡速率120 r/min,在此条件下,历时3 d,对初始浓度为10 mg/L的NP的降解率可达72.83%;菌株SLY8的最佳降解条件为温度35℃,pH为7.0,接种量5%(V/V),振荡速率120 r/min,在此条件下,历时3 d,对初始浓度为5 mg/L的NP的降解率可达64.43%.
壬基酚;生物降解;降解条件优化;施氏假单胞菌;非脱羧勒克菌;16S rDNA
壬基酚(NonylPhenol,NP)是欧盟列出的13种优先控制的持久性有毒污染物之一[1],主要来源于非离子表面活性剂壬基酚聚氧乙烯醚的分解或降解,具有高度的疏水性,在河流底泥中可积累400 d之久,一旦进入人体便会持久存在且不易排出[2].NP还具有雌激素效应,可刺激或抑制免疫系统,改变免疫应答通路,不仅对水生动植物具有极强的毒害性,甚至会影响人的大脑发育和神经系统.我国在2011年将NP加入有毒物质限制名单,严格禁止NP的进出口[2].
环境中的NP分布范围广,浓度较低,具有生物富集性,难以被生物降解.用物理吸附和化学光解法对其进行处理成本较高,不适合大规模应用.而生物降解法与其他处理方法相比,因其成本低、绿色环保且去除效率高,已成为去除环境介质中NP的一种可控的、快速有效的方法[3].迄今为止,人们分离出的NP降解菌主要有假单胞菌(Pseudomonas)、食酸菌(Acidovorax)、假丝酵母菌(Candida maltosa)、寡养单胞菌(Stenotrophomonas)、鞘氨醇单胞菌(Sphingomonas)、芽孢杆菌(Bacillus)和鞘脂菌属(Sphingobium)等[4].近年来,研究分离出的NP降解菌多数来自于土壤、河底沉积物以及污水处理厂的活性污泥中,且多数都集中在土壤环境的污染控制上,对水环境中NP的生物降解报道较少.本研究从垃圾填埋场的渗滤液中分离得到2株NP降解菌,并进行了菌种鉴定和降解条件优化,以期丰富NP降解菌资源,为NP污染水环境的生物修复提供参考.
1 实验
1.1 实验试剂及培养基
1)NP-乙醇储备液(NP浓度为0.05 g/mL):准确称取0.5 g NP,用乙醇溶解并定容至100 mL的棕色容量瓶中,保存于4℃的冰箱备用.
2)NA培养基(g/L):牛肉膏10,蛋白胨20,NaCl 10,琼脂粉18,pH为7.0~7.2,121℃高压灭菌30 min.
3)无机盐培养基(g/L):NH4Cl 2.5,KH2PO42.5,Na2HPO45,MgSO4·7H2O 0.5,FeSO4· 7H2O 0.05,MnC12·4H2O 0.2,CaC12·2H2O 0.05,pH为7.0~7.2,121℃高压灭菌30 min.
4)无机盐固体培养基:在3)的基础上,添加2%(体积分数)的琼脂.
1.2 壬基酚降解菌的分离和纯化
菌源取自郑州垃圾填埋场的垃圾渗滤液.将垃圾渗滤液按10%(即100 mL的培养液中含10 mL的渗滤液)的接入量接种于无机盐液体培养基中,以梯度压力式驯化法进行驯化,NP的浓度梯度分别为1,5,10,20,30,50,80,100,150,200 mg/L,放入30℃,120 r/min的水浴振荡器中培养,每个梯度培养5 d.反复接种培养、分离、纯化,直至得到纯单菌落.将得到的菌种分别接种于喷洒NP储备液的无机盐固体平板上,再反复分离、镜检、纯化,直至得到可在上述平板上生长的纯菌株.
1.3 菌株的鉴定
16S rDNA鉴定用上海生工细菌基因组DNA快速抽提试剂盒提取细菌的总DNA作为模板,采用细菌通用引物27f:AGAGTTTGATCCTGGCTCAG和1492r:TACCTTGTTACGACTT进行PCR扩增反应.扩增反应体系(25 μL体系):10×Buffer 2.5 μL;Mixed dNTP 2.0 μL;27f Primer 1.0 μL(10 pmol/L);1492r Primer 1.0 μL(10 pmol/L);DNA模板 1 μL(约10 ng/μL);Taq聚合酶 0.25 μL (2.5 U/μL);ddH2O 17.25 μL.PCR反应条件:预变性温度为94℃,反应时间为5 min;变性温度为94℃,反应时间为45 s;退火温度为55℃,反应时间45 s;延伸温度为72℃,反应时间为90 s;终延伸温度为72℃,反应时间为10 min;循环次数为35次.PCR产物经1%琼脂糖凝胶电泳检测后,用DNA回收试剂盒回收DNA条带,纯化好的PCR产物先连接至pMD18-T vector,再转化到DH10B感受态细胞,涂板培养后将筛选出的阳性克隆进行测序(测序工作委托上海生工生物工程技术服务有限公司完成).采用Blast软件将测序结果与Gen-Bank中已知菌株的16S rDNA序列进行同源性比较,选取同源性较高的序列,利用MEGA 5.0软件和Neighbor-joining法计算序列的系统进化距离,构建系统发育树.
1.4 壬基酚的提取与定量检测
培养液中NP的提取方法参照文献[5].NP定量检测采用岛津高效液相色谱(LC-20A),色谱柱为Inertsil ODS-SP C18柱.检测条件:波长278 nm;柱温 35℃;流动相甲醇/水为 90∶10,流速1 mL/min;进样量10 μL,R2>0.999.
样品处理:将样品经过0.45 μm有机相滤膜过滤后,进行高效液相色谱检测,r2>0.999.
1.5 壬基酚降解菌降解条件优化
每次以一个因素为变量,其他条件保持不变,考察各因素变化条件下菌株对底物降解效率的影响(各实验组做3次重复和不加菌的空白对照),以确定菌株的最佳降解条件.分别设4个实验组:
1)初始底物质量浓度对降解效率的影响:向无机盐基础培养基(pH 7.0)中加入NP储备液,使得NP的初始质量浓度分别为5,10,15,20,30,40,50,60,70,80,100 mg/L.按10%的投菌量接入待试菌株,在温度30℃、转速120 r/min的摇床中培养;
2)pH对降解效率的影响:将无机盐液体培养基的pH分别调至4,5,6,7,8,9,10,NP初始质量浓度为10 mg/L,按比例(10%)接入待试菌株,在温度30℃、转速120 r/min的摇床中培养;
3)温度对降解效率的影响:将待试菌株按10%的投菌量分别接种于NP初始质量浓度10 mg/L、pH为7.0的无机盐液体培养基中,分别于20,25,30,35,40,45℃下进行摇床培养,摇床转速为120 r/min;
4)投菌量对降解效率的影响:在NP质量浓度为10 mg/L、pH为7.0、温度为30℃的条件下,改变投菌量大小,分别为1%,3%,5%,10%,15%,20%.
所有的实验组均在培养3 d后测定培养液中NP的浓度(每个样品做3个平行试验).
2 结果与讨论
2.1 菌株的鉴定
经富集、分离,获得2株对NP具有显著降解效果的菌株,这2株菌皆能以NP作为唯一碳源和能源生长繁殖,分别命名为SLY7和SLY8.图1是菌株的菌落形态,由图1a)可以看出,SLY7在NA培养基上呈黄色,菌落边缘不规则,表面有褶皱,大而干燥,不易挑取;图1b)显示SLY8的菌落在NA培养基上呈乳黄色,形态规则,近圆形,中央略突起,表面光滑湿润.2株菌革兰氏染色结果都呈阴性.

图1 菌株的菌落形态Fig.1 Colony morphology of strain
图2是2株菌基于16S rDNA基因同源性的系统发育树.由图2可以看出,SLY7与Pseudomonas stutzeri在进化树上处于同一分支,具有相近的进化距离,表明它与Pseudomonas stutzeri发育关系最紧密.综合菌落的形态特征和16S rDNA序列分析结果,初步鉴定SLY7属于施氏假单胞菌(Pseudomonas stutzeri).假单胞菌在自然界中分布广泛,在生物修复、生物防治、生物转化和耐药性等方面具有较高的理论和应用价值[6].施氏假单胞菌隶属于假单胞菌属,同样也参与了多环芳烃[7]、联苯[8]、氟氯氰菊酯[9]、咔唑[10]等有机物污染和重金属污染[11]环境的生物修复.
SLY8与Enterobacter sp.在进化树上处于同一分支,具有相近的进化距离,表明它与Enterobacter sp.发育关系最紧密.综合菌株的形态特征和16S rDNA序列分析结果,初步鉴定SLY8属于非脱羧勒克菌(Leclercia adecarboxylata).非脱羧勒克菌是肠杆菌科的一种,对抗菌药物具有耐药性,该菌还具有降解多环芳烃[12-13]的能力,并且在厌氧环境中能够降解除草剂[14].
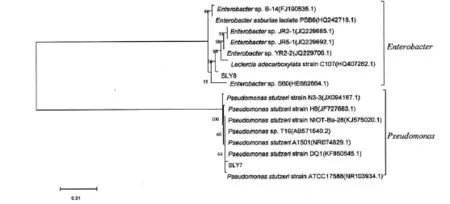
图2 菌株基于16S rDNA基因同源性的系统发育树Fig.2 Phylogenetic tree of strains based on the 16S rDNA gene homology
2.2 底物浓度对菌株降解壬基酚能力的影响
图3为底物浓度对SLY7和SLY8降解效果的影响.从图中可看出,SLY7对不同浓度NP的降解率均高于SLY8,说明SLY7对NP毒性的耐受力和代谢能力要强于SLY8.当SLY7和SLY8的初始浓度分别为10 mg/L和5 mg/L时,降解效果最佳,降解率分别为67.21%和62.66%.可见这2株菌适宜低浓度NP的生物降解.随着浓度的升高,2株菌对NP毒性的耐受力呈直线下降趋势,当底物浓度达到50 mg/L时,SLY8对NP的降解率降到了30%以下,而SLY7对NP的降解率也只有37.56%.这可能是由于NP在水中的溶解度较低(仅有5.43 mg/L),当NP初始浓度达到50 mg/L时,由于其疏水性造成NP呈油滴状漂浮于液体培养基表面,在培养基中分布不均匀,导致菌体不能很好地利用碳源,从而降低了菌株对NP的降解.

图3 初始壬基酚浓度对菌株降解效率的影响Fig.3 Effect of initial NP concentration on degradation efficiencies of strains
2.3 pH对菌株降解壬基酚能力的影响
图4为pH对菌株降解NP的影响.

图4 pH对菌株降解壬基酚效率的影响Fig.4 Effect of pH on NP degradation by strains
由图4可知,pH对菌株降解NP有显著影响.这是由于pH能影响培养基中营养物质的离子化程度,从而影响营养物质的吸收和有毒物质的毒性.当pH为4.0时,两株菌对NP的降解率均低于30%.随着pH的升高,降解率逐渐升高.当SLY7和SLY8的培养基初始pH分别为8.0和7.0时,菌株对NP的降解率均达到最大值,分别为70.54%和60.64%.之后,随着pH的升高降解率逐步下降,当pH为10.0时,SLY8的降解率降至25.11%,但SLY7的降解率仍有47.51%,可见SLY7对碱性环境具有较好的耐受力.pH过高或过低时,都能使NP降解酶的活性降低甚至失活,从而影响降解途径.因此,确定SLY7和SLY8的培养液最适初始pH分别为8.0和7.0.这与文献[15]研究的NP降解菌最佳产酶条件相符合.
2.4 温度对菌株降解壬基酚能力的影响
温度对菌株降解NP能力的影响见图5.

图5 温度对菌株降解效率的影响Fig.5 Effect of temperature on NP degradation by strains
从图5可以看出,在25~40℃范围内,2株菌都能较好地降解液体培养基中的NP,降解率都达到了50%以上,可见2株菌都具有较宽的温度适应范围.当SLY7的培养温度小于30℃,SLY8的培养温度小于35℃时,2株菌对NP的降解率随温度的升高而升高.文献[16]也曾报道过温度升高有利于NP的生物降解.这可能是由于温度的升高增加了NP在液体环境中的溶解度,利于菌体对营养物质的吸收.当SLY7的培养温度大于30℃,SLY8的培养温度大于35℃时,2株菌对NP的降解率随温度的升高而降低.这是由于过高的温度抑制了NP降解酶的活性和菌体的生长,从而影响菌株对NP的降解.当SLY7和SLY8的培养温度分别为30℃和35℃时,菌株对NP的降解效果最好,故确定SLY7和SLY8的最适宜培养温度分别为30℃和35℃.
2.5 投菌量对菌株降解壬基酚能力的影响
投菌量对菌株降解NP能力的影响见图6.

图6 投菌量对菌株降解效率的影响Fig.6 Effect of inoculating dosage on NP degradation by strains
如图6,对于SLY7,当投菌量在1%~3%时,降解率呈上升趋势;当投菌量大于3%时,降解效率变化不大,基本维持在70%左右.因为投菌量过大时,SLY7在培养的过程中会聚成菌团,不利于菌体和NP接触,限制了菌体的生长和代谢.投菌量对SLY8降解率的影响和SLY7相似,当投菌量在1%~5%时,降解率随投菌量升高而升高,当投菌量高于5%时,其降解率变化不大,基本维持在60%左右.由于NP高度疏水性造成其在培养基中分布不均匀,加入的菌量过多会使菌株争夺少量营养,种内斗争限制了菌株生长,因此过多的投菌量对NP降解率的提高效果不明显.当SLY7和SLY8的初始投菌量分别为3%和5%时,不仅有较高的降解率,而且还可以防止菌种浪费.
3 结论
1)从垃圾填埋场的垃圾渗滤液中,分离得到2株NP高效降解菌株SLY7和SLY8,经鉴定SLY7为施氏假单胞菌(Pseudomonas stutzeri),SLY8为非脱羧勒克菌(Leclercia adecarboxylata).
2)菌株SLY7的最佳降解条件为温度30℃,pH为8.0,投菌量3%(V/V),振荡速率120 r/min,在此条件下,历时3 d,对初始浓度为10 mg/L的NP的降解率可达72.83%.
3)菌株SLY8的最佳降解条件为温度35℃,pH为7.0,投菌量5%(V/V),振荡速率120 r/min,在此条件下,历时3 d,对初始浓度为5 mg/L的NP的降解率可达64.43%.
这些结果预示着施氏假单胞菌和非脱羧勒克菌在NP污染水体的生物修复方面具有应用价值.
References)
[1]Lu Zhijiang,Gan J.Analysis,toxicity,occurrence and biodegradation of nonylphenol isomers:A review[J].Environment International,2014,73:334-345.
[2] 熊杰,钱蜀,谢永洪,等.丰水期沱江水系环境内分泌干扰物分布特征[J].中国环境监测,2014,32 (2):53-57.
Xiong Jie,Qian Shu,Xie Yonghong,et al.Study on distribution characteristics of environmental endocrine disruptors(EEDs)in Tuojiang river during high flow period[J].Environmental Monitoring in China,2014,32(2):53-57.(in Chinese)
[3] 李先国,马燕燕,张大海.壬基酚生物降解研究进展[J].中国海洋大学学报:自然科学版,2013,43 (5):64-69.
Li Xianguo,Ma Yanyan,Zhang Dahai.Research progress on biodegradation of nonylphenol[J].Periodical of Ocean University of China:Science Edition,2013,43(5):64-69.(in Chinese)
[4]Wang Zhao,Yang Yuyin,Sun Weimin,et al.Nonylphenol biodegradation in river sediment and associated shifts in community structures of bacteria and ammoniaoxidizing microorganisms[J].Ecotoxicology and Environmental Safety,2014,106:1-5.
[5]Wang Zhao,Yang Yuyin,Sun Weimin,et al.Biodegradation of nonylphenol by two alphaproteobacterial strains in liquid culture and sediment microcosm[J].International Biodeterioration&Biodegradation,2014,92:1-5.
[6] 杨光富,魏云林.假单胞菌研究现状及应用前景[J].生物技术通报,2011(1):37-39.
Yang Guangfu,Wei Yunlin.The research status and application prospect of pseudomonas[J].Biotechnology Bulletin,2011(1):37-39.(in Chinese)
[7]Kaczorek E,Sałek K,Guzik U,et al.Biodegradation of alkyl derivatives of aromatic hydrocarbons and cell surface properties of a strain of Pseudomonas stutzeri[J].Chemosphere:Environmental Toxicology and risk Assessment,2013,90(2):471-478.
[8]Tandlich R,Vrana B,Payne S,et al.Biodegradation mechanism of biphenyl by a strain of Pseudomonas stutzeri[J].Journal of Environmental Science and Health,2011,46(4):337-344.
[9]Saikia N,Kumar S,Patel BKC,et al.Beta-Cyfluthrin biodegradation gene(s)associated in plasmid of Pseudomonas stutzeri(strain S1)[J].The Indian Journal of Agricultural Sciences,2012,82(10): 831-834.
[10]Larentis A L,Sampaio H C C,Carneiro C C,et al.Evaluation of growth,Carbazole biodegradation and anthranilic acid production by Pseudomonas stutzeri[J].Brazilian Journal of Chemical Engineering,2011,28 (1):37-44.
[11]Hassan S H,Kim S J,Jung A Y,et al.Biosorption ofheavy metals by lyophilized cells of Pseudomonas stutzeri[J].World Journal of Microbiology and Biotechnology,2009,25(10):1771-1778.
[12]Sarma P M,Duraja P,Deshpande S,et al.Degradation of pyrene by an enteric bacterium,Leclercia adecarboxylata PS4040[J].Biodegradation,2010,21 (1):59-69.
[13]Sarma P M,Bhattacharya D,Krishnan S,et al.Degradation of polycyclic aromatic hydrocarbons by a newly discovered enteric bacterium,Leclercia adecarboxylata[J].Applied and Environmental Microbiology,2004,70 (5):3163-3166.
[14]Perchet G,Sangely M,Goni M,et al.Microbial population changes during bioremediation of nitroaromaticand nitramine-contaminated lagoon[J].International Biodeterioration& Biodegradation,2008,61(4): 304-312.
[15] 张美珍,邓国志,张小凡,等.壬基酚降解菌产酶条件的优化[J].环境污染与防治,2012,34(6):46-50.
Zhang Meizhen,Deng Guozhi,Zhang Xiaofan,et al.Optimization of conditions on nonylphenol-degrading enzyme production[J].Environmental Pollution&Control,2012,34(6):46-50.(in Chinese)
[16]Yuan S,Yu CH,Chang B,et al.Biodegradation of nonylphenol in river sediment[J].Environmental Pollution,2004,127(3):425-430.
(责任编辑:顾 琳)
Isolation,screening of NP-degrading bacteria and the optimization of degradation conditions
Ma Juan1,2,Yang Fen2,Tang Yubin1*,Chen Fangyan1,Wang Xingang1
(1.School of Environmental and Chemical Engineering,Jiangsu University of Science and Technology,Zhenjiang Jiangsu 212018,China) (2.School of Biotechnology,Jiangsu University of Science and Technology,Zhenjiang Jiangsu 212018,China)
In order to effectively control the NP-polluted water and enrich microbial resources of NP-degrading bacteria,two bacterial strains were isolated from the landfill leachate.The two NP-degrading bacteria,designated strains SLY7 and SLY8.The morphology observation and 16S rDNA identification revealed that the two strains belonged to Pseudomonas stutzeri and Leclercia adecarboxylata,respectively.By shaking flasks tests,the effects of the conditions of degradation of NP by the strains was studied.SLY7 was determined that the optimum conditions were inoculum amount 3%,pH 8.0,and 30℃,on a shaker at 120 rpm for 3 d.Under these conditions,when the initial concentration was 10 mg/L,the degrading rate of NP reached 72.83%.SLY8 was determined that the optimum conditions were inoculum amount 5%,pH 7.0,and 35℃,on a shaker at 120 rpm.Under these conditions,the duration was 3 d,when the initial concentration was 5 mg/L,the degrading rate of NP reached 64.43%.
nonylPhenol;biodegradation;optimization of degradation conditions;Pseudomonas stutzeri;Leclercia adecarboxylata;16S rDNA
X172
:A
:1673-4807(2015)05-0501-06
10.3969/j.issn.1673-4807.2015.05.016
2015-03-21
马娟(1989—),女,硕士研究生.*通信作者:唐玉斌(1964—),男,博士,教授,研究方向为环境生物技术.E-mail:ybbill@163.com
马娟,杨芬,唐玉斌,等.壬基酚降解菌的分离筛选及其降解条件的优化[J].江苏科技大学学报:自然科学版,2015,29(5): 501-506.
