物理化学教学中相似公式的理解与记忆
2015-06-23师瑞娟刘俊龙
师瑞娟,刘俊龙
1.阜阳师范学院化学化工学院,安徽阜阳,236041;2.环境污染物降解与监测安徽省重点实验室,安徽阜阳,236041
物理化学教学中相似公式的理解与记忆
师瑞娟1,2,刘俊龙1,2
1.阜阳师范学院化学化工学院,安徽阜阳,236041;2.环境污染物降解与监测安徽省重点实验室,安徽阜阳,236041
针对物理化学课程中公式多、推导运算复杂的特点,对教学中出现的克劳修斯—克拉佩龙方程、凝固点降低公式、范特霍夫方程和阿伦尼乌斯方程四个相似公式进行了详细的解析;并结合实例推导,发现四个方程在本质上都反映了温度对体系变化的影响,平衡也许是这些公式相似的内在原因。
物理化学;克劳修斯—克拉佩龙方程;范特霍夫方程;凝固点降低公式;阿伦尼乌斯公式
物理化学课程理论性强,基本概念多、定律多、原理多、公式多,常常涉及大量枯燥的推导和机械的运算,学生在学习过程中容易产生畏难情绪[1]。在物理化学课程的不同章节中,有很多形式相似的公式,如克劳修斯—克拉佩龙方程(Clausius-Clapeyron equation)、化学反应的范特霍夫方程(Van't Hoff equation)、稀溶液的依数性——凝固点降低公式(Freezing Point Depression formula)和阿伦尼乌斯公式(Arrhenius equation),这些公式都反映温度对体系变化的影响。在教学过程中,通过对公式的分析理解,弄清楚这些相似公式间的联系,将有助于学生把握知识点及其相互关系的整体结构,更好地记忆及应用这些公式。
1 四个相似公式
1.1 克劳修斯—克拉佩龙方程(Clausius-Clapeyron equation)
克劳修斯—克拉佩龙方程(简称克—克方程)是用于描述单组分系统在两相平衡时压力随温度变化的方程,以鲁道夫·克劳修斯和埃米尔·克拉佩龙命名。对于有气相参加的相变化过程,在远低于临界温度的条件下,由于气相比容Vg要远远大于固体或液体的体积Vl(s),所以固体和液体的体积可以忽略,ΔV=Vg-Vl(s)≈Vg。以液体蒸发过程为例,在较低的压力和气体分子间作用力的前提下,气体可以视为理想气体,Vg=RT/p,于是有:
此式即是克—克方程的微分式[2]。
一般来说,相变焓是温度的函数。如果相变焓随温度的变化而变化不大,那么可以认为它是一定值。将上式积分,可得克—克方程的积分式:
不定积分式:
定积分式:
若已知两个不同温度下的饱和蒸汽压,或P-T图上的两个点(P1,T1)和(P2,T2),利用定积分式,就可以计算出液体的摩尔蒸发焓ΔvapHm。
1.2 范特霍夫方程(Van't Hoff equation)
范特霍夫方程是一个用于不同温度下计算某反应平衡常数的方程,由雅各布斯·亨里克斯·范特霍夫提出。假设参加反应的物质均处于各自的标准态,其微分式为:

不定积分式:
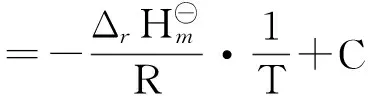
定积分式:
在恒容条件或者在低压下的气相反应,范特霍夫方程还可写作:
作定积分得:
1.3 凝固点降低公式(Freezing Point Depression formula)


1.4 阿伦尼乌斯公式(Arrhenius equation)
阿伦尼乌斯公式由瑞典斯凡特·奥古斯特·阿伦尼乌斯创立,是化学反应速率常数随温度变化关系的经验公式,适用于基元反应和非基元反应,甚至某些非均相反应,其微分式为:
可以看出,lnk随T的变化率与活化能Ea成正比。因此,活化能越高,温度升高时反应速率增加得越快,反应速率对温度越敏感。如果同时存在多个活化能值不同的反应,则高温对活化能高的反应有利,低温对活化能低的反应有利[3]。
若温度变化范围不大的情况下,活化能Ea可视作常数,则对上式作不定积分可得:
作定积分可得:
对于不同温度T下的速率常数κ值,其lnκ~1/T图应为一直线,直线的斜率和截距分别为-Ea/R和lnA,由此可以分别求得活化能Ea和指前因子A。
可以看出,四个公式在形式上相同或相似,那么这些公式为什么会相似,公式之间有没有相互联系呢?
2 相似公式的关联
2.1 凝固点降低公式与克-克方程的关联
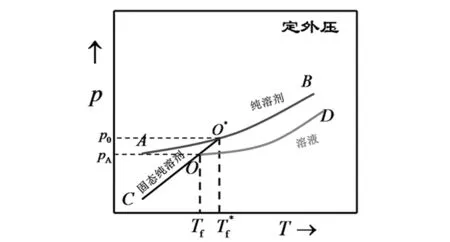
图1 稀溶液的凝固点下降示意图
在稀溶液的凝固点下降图中(图1),使用克-克方程对OO*线上气-液和气-固两相平衡进行分析,有
将两式相减,且有ΔsubHm-ΔvapHm=ΔfusHm,得:
得到稀溶液的凝固点降低公式。
2.2 范特霍夫方程与阿伦尼乌斯公式的关联
对于一个可以向正、逆两个方向进行的反应,正向反应的活化能Ea+减去逆向反应的活化能Ea-等于反应的热效应Q[5-6],即
Q=Ea+-Ea-
对于反应进度为1 mol的恒压反应,有:
Q=ΔrHm
对于反应进度为1 mol的恒容反应,有
Q=ΔrUm
得
对上式积分,可得:
k+=k+,oe-Ea+/RT;k-=k-,oe-Ea-/RT
即
k=k0e-Ea/RT
两边取对数并对T微分,得:
这就是阿伦尼乌斯公式。
2.3 克-克方程与范特霍夫方程的关联
对于单组分体系的气-液或气-固平衡,可以看作是化学反应的特例。设在某温度下,某纯物质A达到气-液两相平衡,即:
A(l)A(g)
若不考虑压力对液相的影响,且将该系统看作是一个复相化学平衡,则其饱和蒸汽压就是化学反应的平衡常数,且化学反应的摩尔反应焓就是纯物质A的摩尔蒸发焓。
由范特霍夫方程:
得
这就是克-克方程。
3 结 论
从这些相似公式的推导分析中可以发现,这四个公式都与平衡系统相关联,平衡也许是这些公式相似的内在原因。其中,克劳修斯-克拉佩龙方程是描述温度对单组分系统两相平衡的影响,范特霍夫方程和阿伦尼乌斯公式分别是从宏观热力学和微观动力学的角度来说明温度对化学反应的影响,凝固点降低公式则是根据理想稀溶液的热力学定义和相平衡原理说明了溶液组成的改变与凝固点温度的降低值之间的定量关系。可以看出,四个方程在本质上都是反映温度对体系变化的影响。
物理化学课程内容理论性强,内容多,知识跨度较大,只有系统的且有内在逻辑联系的教学内容,才有助于学生的理解与接受。因此,在教学中,教师应对教学内容进行比较、归纳、整理、综合,让知识系统化,以便于学生学习理解与记忆,从而不断提高教学效果。
[1]侯文华,姚天扬.物理化学课程教学探讨与实践[J].中国大学教学,2012(7):38-40
[2]刘俊吉,周亚平,李松林.物理化学[M].5版.北京:高等教育出版社,2009:137-139
[3]傅献彩,沈文霞,姚天杨.物理化学:上册[M].5版.北京:高等教育出版社,2005:233-235
[4]彭斌,杜程.从蒸气压的降低理解稀溶液的依数性质[J].当代教育理论与实践,2011,3(9):160-161
[5]兰翠玲,赵金和,曹秋娥.浅析Clausius-Clapeyron方程与Arrhenius公式的类似性[J].大学化学,2011,26(6):71-72
[6]谭富桃.用化学平衡常数证明影响化学平衡的因素[J].化学教育,2014,35(9):37-39
(责任编辑:汪材印)
宿州学院纳米功能材料及应用创新团队在国际科技期刊上发表高水平论文
近日,RSC Advances和Dalton Transactions分别发表了宿州学院纳米功能材料及应用创新团队两项最新研究成果:“A Facile Synthesis of Flower-Shaped TiO2/Ag microspheres and Application in Photocatalyst Label”(doi:10.1039/c4dt01276c)和“Long afterglow Sr4Al14O25:Eu,Dy phosphors as both scattering and down converting layer for CdS quantum dot-sensitized solar cells”(doi:10.1039/c4dt01276c)。
10.3969/j.issn.1673-2006.2015.01.033
2014-06-30
阜阳师范学院教学研究项目“科学教育专业物理化学实践型教学模式研究”(2012JYXM64);阜阳师范学院环境污染物降解与监测安徽省重点实验室委托专项“Re掺杂催化剂光催化降解水中有机污染物的研究”(2012HJJC02)。
师瑞娟(1979-),女,安徽阜阳人,博士,讲师,主要研究方向:物理化学。
G642.0
A
1673-2006(2015)01-0122-03
