聚丙烯酰胺电泳条带中微量DNA片段的回收与再扩增方法的改进
2015-06-23许美容贾奥琳邓晓玲
许美容,贾奥琳,郑 正,邓晓玲
(华南农业大学资源环境学院,广东广州510642)
聚丙烯酰胺电泳条带中微量DNA片段的回收与再扩增方法的改进
许美容†,贾奥琳†,郑 正,邓晓玲
(华南农业大学资源环境学院,广东广州510642)
【目的】研究聚丙烯酰胺凝胶电泳(PAGE)条带中微量DNA片段的回收和再扩增.【方法】比较了4种方法溶解聚丙烯酰胺凝胶的效果和回收微量核酸的效率.【结果和结论】Bioteke溶胶/结合液能获得极高的DNA片段回收率,可从仅含1.0~7.5 ng核酸的PAGE胶中有效回收到足量的片段;再扩增的效果与回收效率呈正相关;将液态混合液与杂质分离是成功进行再扩增的关键.本研究构建的一套快速、高效的PAGE多态性条带回收及再扩增的方法为分析生物遗传多样性成因提供了新途径.
聚丙烯酰胺凝胶电泳;微量DNA带回收;DNA片段再扩增
琼脂糖凝胶电泳和聚丙烯酰胺凝胶电泳(Polyacrylamide gel electrophoresis,PAGE)分别是常用的水平和垂直电泳方法.相对于琼脂糖凝胶电泳,PAGE因具有适用性广、分辨率高、上样量小、通量较高等特征[1-2],而被广泛应用于生物遗传多样性研究中的小片段DNA分离[3].随着生物技术的快速发展,PAGE衍生出 SDS-PAGE、2D-PAGE和 sulfate-PAGE等多种形式,普遍用于蛋白质的分离[4].
目前从琼脂糖凝胶中回收DNA片段的方法相对成熟,如挤压回收法、速冻-快速离心法与凝胶浸泡法[5],PAGE核酸回收的方法常采用的主要有水煮法[6]、研磨法[7]、液氮研磨法[8]等,但是这些方法并不适用于DNA量微小的试验.
本研究采用了4种方法从PAGE胶中回收微量DNA片段,并用再扩增的方法评价回收效果,建立了一套高效的PAGE条带回收和片段再扩增的方法,为后续克隆研究奠定了基础.
1 材料与方法
1.1 DNA提取与材料筛选
从广东和云南分别采集具有黄龙病(Huanglongbing,病原为Candidatus Liberibacter spp.)症状的砂糖橘Citrus reticulata Banco或马水橘Fortunella margarita(Lour.)Swingle和香橼Citrusmedica L.或柠檬Citrus limon样品.DNA提取:剪取0.15 g柑橘叶片中脉,磨碎后用植物DNA提取试剂盒(OMEGA,D2485-02)提取基因组总DNA.利用10 g·L-1的琼脂糖凝胶检测提取的DNA的质量.经柑橘黄龙病病原细菌的特异性引物UP2/DP2(UP2:5'-ATGTTGTGGTAGATCAGGTGACGGT-3';DP2:5'-GCAAAAGGCATAATCATTAAACCAA-3')鉴定,筛选出阳性的砂糖橘、马水橘、香橼和柠檬样品.
1.2 引物设计与PCR扩增
1.2.1 “Ca.L.asiaticus”SSR位点的筛选 从Genebank中下载到1.23 Mb和1.27 Mb的Psy62菌株和gxpsy菌株的全基因组序列(Genebank ID:gb∣CP001677.5和gb∣CP004005.1).利用Tandem Repeats Finder(version 4.07b)在线软件扫描分析候选的SSR位点信息;经PCR筛选,从33对不同候选SSR位点的引物中选择扩增产物条带丰富且多态性良好的引物SSR3F(5'-GTAGGAGTCCCCGAAAT-3')和SSR3R(5'-GCCTGTACGAGGTTTGA-3')用于本研究[9].
1.2.2 PCR扩增SSR基因 以筛选到的阳性DNA为模板,以上述引物进行常规PCR扩增.15μL的PCR体系含10~20 ng DNA、17.6μL灭菌ddH2O,10×Taq buffer(含 Mg2+,TianGen)、dNTPs(2.5 mmol·L-1,TianGen)各 1.5μL,正反向引物(10 μmol·L-1)各0.5μL及0.2μL Taq DNA聚合酶(2.5 mol·μL-1).将以上混合体系置于在Bio-RAD热循环仪上进行扩增;PCR扩增程序为:94℃预变性5 min,94℃变性30 s、56~60℃退火40 s、72℃延伸45 s,35个循环后72℃延伸10 min.利用10 g·L-1琼脂糖凝胶检测PCR扩增结果.
1.3 PAGE电泳条带的处理
PCR产物经聚丙烯酰胺凝胶电泳后采用银染法[10]染色.显色结束后,拍照获取谱带信息,并切下PAGE胶上的目的条带.
选用4种方法溶解含有DNA片段的PAGE胶:分别加入 100μL Elution buffer(OMEGA,D2485-01)、ddH2O、Buffer DE-A(AxyPrep,D5114KEI)和溶胶/结合液DE(Bioteke,DT1701),置于65℃水浴锅中温浴10 min.将其中一组样品的液态溶胶液用移液枪吸入已灭菌的1.5 mL离心管,与固态PAGE胶分离;另一组样品则不作分离处理.
用沉淀法收集DAN片段[11],以回收的10μL微量DNA为模板,用原对应的引物PCR扩增.电泳检测PCR扩增结果.
2 结果与分析
2.1 4种PAGE胶溶解方法的比较
选用的引物SSR3F/3R对不同来源的“Ca.L.asiaticus”菌株扩增谱带信息丰富,在PAGE胶上区分度大(图1),能够分离.选择能扩增出3个条带的第5个样品做后续试验.
经温浴后,OMEGA Elution buffer、ddH2O和AxyPrep溶胶液DE-A均无法溶解PAGE胶(图2A、2B、2C),而Bioteke溶胶/结合液DE处理后的PAGE胶变透明(图2D).
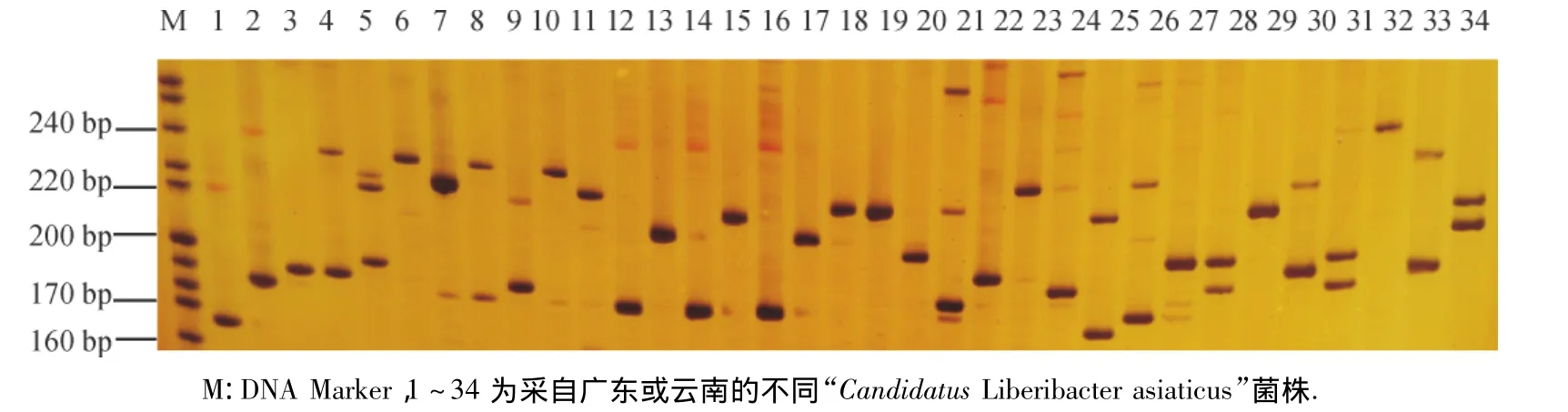
图1 不同“Candidatus Liberibacter asiaticus”菌株PCR产物的聚丙烯酰胺凝胶电泳谱带Fig.1 PAGE profiles of different“Candidatus Liberibacter asiaticus”strains amplified using primers SSR3F/3R

图2 4种不同的试剂溶解聚丙烯酰胺凝胶的效果比较Fig.2 Comparisons of the efficiency of four different reagents in polyacrylamide gel electrophoresis dissolvent
2.2 4种PAGE胶DNA回收片段的再扩增效果
回收的DNA片段经相应引物再扩增后用10 g·L-1琼脂糖凝胶电泳检测.前3种方法的回收产物作为模板未能再扩增到目的条带,而Bioteke溶胶/结合液DE回收的产物经再扩增后获得了清晰的目的条带(图3).表明简单的化学(Bioteke溶胶/结合液DE)+物理方法(65℃水浴10 min)可以将微量的DNA从PAGE胶中析出.
2.3 未溶解的PAGE胶对DNA回收效率的影响
为了验证水浴加热后的液态PAGE胶与未溶解的固态胶分离对DNA的获得率的影响,本试验对比了2组操作的再扩增效果.一方面,若不将液态PAGE胶与少量沉淀分离,在DNA沉淀过程中,经φ为75%的乙醇溶液洗涤干燥后重悬的过程中,少量透明的沉淀物会吸水膨胀,即含DNA的ddH2O会再次被PAGE胶快速吸收.另一方面,经分离的PAGE胶中沉淀的核酸样品能有效地被再扩增(图4A),而去除PAGE胶沉淀的样品经PCR再扩增不能获得目的条带(图4B).
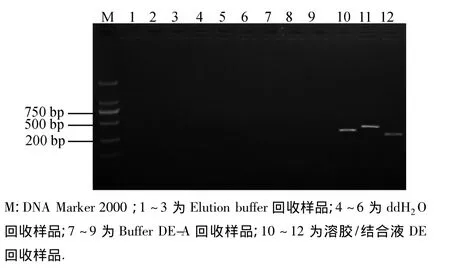
图3 以4种不同方法回收的DNA为模板进行再扩增的结果Fig.3 Agarose gel electrophoresis of reamplification bands using templates recovered by four different buffers

图4 将温浴后的液态溶液与少量固态沉淀分离的回收产物再扩增效果Fig.4 Agarose gel electrophoresis of PCR products amplified using liquidmatters separated or un-separated with pellets on the bottom of tube
3 讨论与结论
在“Ca.L.asiaticus”菌株的全基因组序列公布以后,“Ca.L.asisticus”的多样性研究迅速成为热点[12-14].“Ca.L.asiaticus”基因组中的短串联重复序列也被用于菌株多态性分析[15-16].以上多样性研究证明借助于PAGE可以很好地区分扩增产物的多态性.
较之琼脂糖凝胶电泳,PAGE在小分子片段的分离,特别是多条带区分中具有独特的优势[1-4].从PAGE胶中有效回收目的条带是分子生物学试验中进一步进行序列克隆、分析的基础.水煮法、研磨法、液氮研磨法、直接法等要求较大上样量,并不适合有效地回收PAGE胶中微量的核酸.由于PAGE胶在高温下不能溶解且其物理结构十分紧密[17],胶中的DNA很难在研磨、煮沸等条件下释放.本研究证明从PAGE胶中回收DNA片段的关键在于DNA从PAGE胶中释放并游离出来.
多次试验发现,从PAGE胶中回收核酸片段应注意:首先,含DNA的PAGE胶即使在-20℃条件下也不适合长时间保存(-20℃下存放超过10 d,DNA可能会部分降解);其次,应避免将样品长时间浸泡在溶解液中,溶解液可能引起DNA降解;第三,未溶解的胶体经干燥后的吸水能力强,能重新吸附DNA片段,从而导致DNA回收效率大大降低;再者,本试验中所用的溶胶液是针对于琼脂糖凝胶的,因而未能完全溶解PAGE胶,但是PAGE胶中的DNA可以在该条件下析出,并进入溶胶液.未将液态溶胶液与少量固态沉淀分离而导致再扩增失败的原因可能是残留的某化学物质抑制了PCR反应.
本试验通过试剂的选择和操作方法的简化,避免了对PAGE胶的破碎,从而减少了试验时间和操作步骤,并实现了快速高效批量地回收PAGE胶中微量的DNA目的小片段.
[1] CHRAMBACH A,RODBARD D.Estimation ofmolecular radius,free mobility,and valence using polyacrylamide gel electrophoresis[J].Anal Biochem,1971,40(1):95-134.
[2] CHEMICALSP F.Polyacrylamide gel electrophoresis[J].J Immunol,1980:54-55.
[3] 马啸,周永红,于海清.野生垂穗披碱草种质的醇溶蛋白遗传多样性分析[J].遗传,2006,28(6):699-706.
[4] RATH A,DEBER C M.Correction factors formembrane protein molecular weight readouts on sodium dodecyl sulfate-polyacrylamide gel electrophoresis[J].Anal Biochem,2013,434(1):67-72.
[5] 王春,陈琳玲,许灿新,等.简便快速的PCR产物回收方法[J].南华大学学报,2005,33(1):109-111.
[6] 章蕾,袁玲,黄建安,等.从非变性聚丙烯酰胺凝胶中回收DNA小片段的两种方法比较[J].中国农学通报,2011,27(7):227-230.
[7] 朱玉君,樊叶杨,庄杰云.从非变性聚丙烯酰胺凝胶回收纯化DNA样本[J].生物技术通报,2010(1):193-195.
[8] 周颐,王忆平.从非变性聚丙烯酰胺凝胶中快速高效回收DNA片段[J].生物技术通报,2013(5):194-198.
[9] 许美容,郑正,李昕晟,等.基于短串联重复和PAGE的柏橘黄龙病‘Candidatus Liberibacter asiaticns’种间遗传多样性[J].植物病理学报,2014,44(6):609-619.
[10]乐晓萍,杜鹏,张钦宪,等.聚丙烯酰胺凝胶银染技术改良[J].河南医科大学学报,2001,36(4):395-396.
[11]卢圣栋.现代分子生物学实验技术[M].北京,高等教育出版社,1993:56-57.
[12]LIU R,ZHANG P,PU X L,etal.Analysis of a prophage gene frequency revealed population variation of‘Candidatus Liberibacter asiaticus’from two citrus-growing provinces in China[J].Plant Dis,2011,95(4):431-435.
[13]ZHOU L J,POWELL C A,HOFFMAN M T etal.Diversity and plasticity of the intracellular plant pathogen and insect symbiont“Candidatus Liberibacter asiaticus”as revealed by hypervariable prophage genes with intragenic tandem repeats[J].Appl Environ Microb,2011,77 (18):6663-6673.
[14]WANG X F,ZHOU C Y,DENG X L,et al.Molecular characterization of amosaic locus in the genome of‘Candidatus Liberibacter asiaticus’[J].BMC Microbiol,2012,12(1):18.
[15]CHEN JC,DENG X L,SUN X A,et al.Guangdong and Florida populations of‘Candidatus Liberibacter asiaticus’distinguished by a genomic locuswith short tandem repeats[J].Phytopathology,2010,100(6):567-572.
[16]ISLAM M S,GLYNN JM,BAIY,etal.Multilocusmicrosatellite analysis of‘Candidatus Liberibacter asiaticus’associated with citrus Huanglongbing worldwide[J].BMC Microbiol,2012,12(1):39.
[17]蒋志飞.活性自由基聚合法制备聚丙烯酰胺及其水凝胶的研究[D].重庆:重庆大学,2007.
【责任编辑 霍 欢】
Im proved methods to recover and ream plify trace DNA fragments from the polymorphic PAGE band
XU Meirong†,JIA Aolin†,ZHENG Zheng,DENG Xiaoling
(College of Natural Resources and Environment,South China Agricultural University,Guangzhou 510642,China)
【Objective】To optimize the methods of recovery and reamplification of trace DNA fragments from polymorphic polyacrylamide gel electrophoresis(PAGE)bands.【Method】Effects of fourmethods of dissolving polyacrylamide gel and recovery efficiencies of trace nucleic acids were obtained.【Result and conclusion】Dissolving/Bing buffer from Bioteke kit showed high recovery rates of DNA fragments from PAGE gelswith only 1.0-7.5 ng nucleotide.Effects of amplification positively correlated with recovery efficiencies.The separation of liquid mixture and impurities was the key to successful amplification.This research forms a fast,efficient DNA recycling and amplification method from polymorphism PAGE,which provides a new approach to analyze the causes of genetic diversity.
PAGE;trace DNA fragments recovery;reamplification of DNA sequence
Q7
A
1001-411X(2015)02-0117-04
2014-02-13 优先出版时间:2015-01-21
优先出版网址:http://www.cnki.net/kcms/detail/44.1110.s.20150121.0941.014.html
许美容(1983—),女,讲师,博士,E-mail:meirongxu@scau.edu.cn;贾奥琳(1992—),女,E-mail:jia_aolin@163.com;†表示对本文贡献相同;通信作者:邓晓玲(1966—),女,教授,博士,E-mail:xldeng@scau.edu.cn
国家自然科学基金(G31201480);农业部公益性行业(农业)专项(201003067);广东省自然科学基金(S2012040007627)
