蜡样芽孢杆菌LJ01的鉴定及亚硝酸盐还原酶性质*
2015-06-23刘冬梅罗彤晖杨丹霞黄娟吴晖余以刚李理
刘冬梅 罗彤晖 杨丹霞 黄娟 吴晖 余以刚 李理
(华南理工大学轻工与食品学院,广东广州510640)
蜡样芽孢杆菌LJ01的鉴定及亚硝酸盐还原酶性质*
刘冬梅 罗彤晖 杨丹霞 黄娟 吴晖 余以刚 李理
(华南理工大学轻工与食品学院,广东广州510640)
从豆瓣酱中筛选出一株能高效降解亚硝酸盐的菌株LJ01,经鉴定为蜡样芽孢杆菌.通过测定LJ01细胞中不同组分的酶活,研究了亚硝酸盐还原酶的初步定位.LJ01经100mg/L的NaNO2诱导后,用溶菌酶破壁,粗酶液先经阴离子DEAE Sepharose Fast Flow层析柱分离,测定不同蛋白组分a、b、c降解亚硝酸盐的活力,利用0.1mol/L无机电子供体丁二酸和亚硫酸钠等鉴定出组分c为亚硝酸盐还原酶,再经葡聚糖凝胶G-150层析柱分离,获得较纯的亚硝酸盐还原酶,每升发酵液可得到0.54mg活性酶蛋白,酶蛋白活力达到4004.89U/mg,得率为2.37%,纯化后其NiR的比活力提高了17.57倍.经SDS-PAGE电泳后确定LJ01中亚硝酸盐还原酶的单体分子质量约为30ku.
蜡样芽孢杆菌;亚硝酸盐还原酶;亚硝酸盐降解;16S rDNA;细胞定位
亚硝酸盐是一种潜在的致癌物质,在蔬菜发酵过程中极易积累,给产品带来潜在的食品安全问题,且过量摄入亚硝酸盐可诱发高铁血红蛋白症[1],因此严格控制食品中亚硝酸盐的含量非常重要.许多研究表明亚硝酸盐是亚硝胺的前体物,亚硝胺是一种强致癌物,可以诱发消化系统中的多种癌变,如胃癌、肠癌和肝癌.鉴于食品中可能存在超标亚硝酸盐污染、肉制品中含有亚硝酸盐、水产养殖水体亚硝酸盐超标等可能导致食品安全潜在问题,寻求有效控制或降解亚硝酸盐的方法势在必行.
加入食用安全(GRAS)的微生物是目前用于食品中亚硝酸盐降解的主要方法之一,主要有植物乳杆菌(Lactobacillus plantrum)[2]、短乳杆菌(Lactobacillus brevis)[3]、干酪乳杆菌(Lactobacillus casei)[4].还可利用NiR进行亚硝酸盐的生物降解,但是要得到大量的食用安全的NiR还没有很好的方法.NiR是一种还原酶,主要催化反硝化过程中的亚硝酸盐还原为一氧化氮,催化过程中存在电子传递,因此NiR要发挥其催化作用需要电子供体与电子受体,电子供体将电子传递给NiR,随后亚硝酸盐从该酶上得到电子而被还原,其中亚硝酸盐为其电子受体[5],而其电子供体尚未明确.
笔者所在课题组在分析豆瓣酱中的微生物种群时,发现其中的菌株LJ01有很强的降解亚硝酸盐的能力,当NaNO2质量浓度为20~200mg/L时,在24h内LJ01能将亚硝酸盐完全降解;当NaNO2质量浓度为250mg/L时,降解率为99.31%.在NiR的研究领域,从芽孢杆菌中进行NiR的性质和纯化研究鲜有报道.文中首先对菌株LJ01进行了分子和生理生化方面的鉴定,用盐酸萘乙二胺法测定NaNO2含量而测定NiR酶活,并从LJ01细胞内提取出NiR酶液,依次通过阴离子DEAE Sepharose Fast Flow凝胶层析柱、葡聚糖G-150凝胶层析柱的分离纯化,利用无机物电子供体丁二酸和亚硫酸钠对分离后的组分进行了鉴定,最后还利用SDS-PAGE电泳对NiR的分子质量进行确定.
1 材料与方法
1.1 实验材料
1.1.1 实验菌株
蜡样芽孢杆菌Bacillus cereus LJ01由笔者所在课题组从豆瓣酱中分离纯化所得,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.9360.
1.1.2 材料与试剂
营养肉汤,生化试剂,购自广东环凯微生物科技有限公司;盐酸萘乙二胺,分析纯,华东师范大学化工厂生产;对氨基苯磺酸,分析纯,天津市北联精细化学品开发有限公司生产;HEPES、胰蛋白酶抑制剂、牛血清蛋白,生化试剂,购自广州市齐云生物技术有限公司;氯化钠、氢氧化钠、亚硝酸钠,分析纯,天津市福晨化学试剂厂生产;溶菌酶,生化试剂,购自北京天恩泽生物公司;二硫苏糖醇(DTT),生化试剂,购自上海Sigma公司;Tris,生化试剂,购自健阳生物科技有限公司;聚乙二醇20000,生化试剂,韩国夏普公司生产.
1.1.3 试剂溶液及培养基
50mmol/L HEPES缓冲液(pH=7.4);50mmol/L Tris-HCl缓冲液(pH=8.0);NiR酶提缓冲液:在100mL的50mmol/L HEPES缓冲液(pH=7.4)中加入0.5mL的1mol/L的DTT,使其终浓度为5mmol/L,并在其中加入0.1mL的2g/L胰蛋白酶抑制剂,混合均匀后即为NiR酶提缓冲液;种子培养基(1L):10g大豆蛋白胨,5g氯化钠,3g酵母提取粉;NiR诱导发酵培养基(1L):10 g大豆蛋白胨,5 g氯化钠,3 g酵母提取粉,20mL 5g/L NaNO2溶液.
1.2 主要仪器与设备
紫外可见光分光光度计(上海棱光技术有限公司生产);PHS3-C pH计(上海精密科学仪器有限公司生产);5804R台式冷冻离心机(德国艾本德公司生产);层析柱;HL-2B恒流泵(上海沪西分析仪器厂有限公司生产);DYCZ-24DN电泳槽(北京市六一仪器厂生产);酶标仪;01J2003-04立式压力蒸汽灭菌锅(上海博迅实业有限公司生产);Biostat Aplus 5L发酵罐(德国Sartorius公司生产).
1.3 实验方法
1.3.1 菌株的分子生物学鉴定和生理生化鉴定
DNA的提取参照参考文献[6]进行.
PCR扩增方法如下.16SrDNA引物及序列为M13F(-47):CGCCAGGGTTTTCCCAGTCACGAC; M13R(-48):AGCGGATAACAATTTCACACAGG A.首先以菌株LJ01的DNA为模板,以M13F(-47)和M13R(-48)引物在一定条件下扩增,然后利用琼脂糖电泳鉴定PCR产物的特异性.割胶回收纯化PCR产物后克隆到质粒pMD18-T,并转化至感受态细胞E.coli DH 5α,最后测序验证重组克隆中PCR产物的序列信息.重组克隆条件:氨苄青霉素抗性;质粒DNA体积:10~20μL;含质粒的菌液体积:200~300μL;储存条件:-20℃.
生理生化鉴定:分离株的一般形态生理生化检测分析可参照伯杰氏细菌鉴定手册(第9版)[7]进行.
1.3.2 系统进化分析
把测序结果与BLAST中的序列进行比对,将搜索出的相关序列以FASTA格式导入多序列比对工具CLUSTALX(versionl.83)中,比对结果使用MEGA (version5.0)中的邻接法(Neighbor-Joiningmethod)构建系统进化树,然后输出进化树图.
1.3.3 亚硝酸盐测定
亚硝酸盐含量的测定参考国标GB/T 5009.33—2010《食品中亚硝酸盐与硝酸盐的测定》中的盐酸萘乙二胺法进行,绘制标准曲线方程:Y=0.0404x-0.0024(式中Y为吸光值;x为亚硝酸盐质量浓度,单位为mg/L;回归系数为0.9999).采用紫外可见光分光光度法测定NiR酶蛋白质含量,以牛血清蛋白为标准蛋白,测定不同浓度牛血清蛋白在280nm处的吸光值,绘制标准曲线方程:Y'=0.618x'-2.133(式中Y'为吸光值×1000;x'为蛋白质量浓度,单位为mg/L;回归系数为0.9996).
1.3.4 NiR酶活力的测定
粗酶酶活测定体系:在1.5mL离心管中加入粗酶液100μL、浓度500mg/L的NaNO2溶液100μL,再用50mmol/L HEPES缓冲液(pH=7.4)定容到500μL,使亚硝酸盐的终浓度为100mg/L,于37℃下反应24h后,按1.3.3节的方法测定NaNO2含量.
葡聚糖凝胶层析纯化酶酶活测定体系:在1.5mL离心管中加入目的酶液100μL、阴离子0或100mmol/L洗脱蛋白液100μL、100μL的500mg/L NaNO2,使其终浓度为100mg/L,再用HEPES缓冲液定容到500μL,于37℃下反应24h后,按1.3.3节的方法检测NaNO2的含量.
确定NiR组分酶活测定体系:在1.5mL离心管中加入目的酶液(0、100、或200mmol/L)100μL、100μL的500mg/L NaNO2,使其终浓度为100mg/L,然后加入100μL的 0.1 mol/L丁二酸或亚硫酸钠,再用HEPES缓冲液定容到500μL,于37℃下反应24 h后,按1.3.3节的方法检测NaNO2的含量.
亚硝酸盐还原酶的酶活单位定义为:在37℃条件下,每分钟催化还原1ng亚硝酸钠所用酶量为一个酶活力单位.酶活(U/mg)计算公式如下:酶活= m/(Mt),其中m为降解的亚硝酸钠的质量,ng;M为反应物中酶蛋白质的质量,mg;t为反应时间,min.
1.3.5 细胞内外亚硝酸盐还原酶的确定
至22~24 h达到最大的亚硝酸盐降解量约为200mg/L.将活化LJ01种子液以2%的体积分数接种至含200mg/LNaNO2的发酵培养基中,于30℃,180 r/min摇床培养24h后,即得含NiR的LJ01细胞液(简称为CBINR).将CBINR分成两份:第1份离心20min后(8000 r/min,4℃),取上清液过0.22μm的膜,收集过膜后的液体为细胞外酶组分;第2份进行超声破碎(55%,10min,2 s停2 s),离心20min后(8 000 r/min,4℃)取上清液,即为细胞外酶和细胞内酶组分.所得的细胞外和细胞内酶、细胞外酶按照1.3.3节的方法测NiR的酶活.细胞内和细胞外的NiR酶活测定分别做3个平行.
1.3.6 亚硝酸盐还原酶的分离纯化
(1)NiR粗酶液的制备.将活化LJ01种子液以2%的体积分数接种至NiR诱导发酵培养基中,于30℃和180 r/min摇床培养24 h后,将CBINR离心10min(8000 r/min,4℃)后,弃去上清液后,用无菌水洗后离心10min(8000 r/min,4℃),清洗和离心重复2次得含NiR的LJ01细胞(简称为CINR)并称重,将CINR悬浮于NiR酶提缓冲液中,成为终质量浓度为200g/L(湿菌体重/缓冲液)的菌悬液,在该菌悬液中加入20.0g/L的溶菌酶,使溶菌酶浓度为0.10%(体积分数),混匀,于30℃下静置4h以充分溶解CINR的细胞壁,得到细胞周质组分后离心20min(8000 r/min,4℃),上清液为CINR粗酶液.
(2)DEAE Sepharose Fast Flow交换层析.取40mL CINR粗酶液上样至 DEAE Sepharose Fast Flow离子交换层析柱(2.6 cm×20 cm),先用不含NaCl的50mmol/L HEPES缓冲液(pH=7.4)将杂蛋白洗脱下来,再用0~300mmol/L NaCl的50mmol/L HEPES缓冲液(pH=7.4)进行梯度洗脱,流速为1mL/min,分部收集洗脱液,每管收集洗脱液1.5mL,按照1.3.3节的方法测定每管洗脱液的蛋白质含量,按照1.3.3和1.3.4节的方法测定降解亚硝酸盐的活性及测定NiR酶活,收集和合并有NiR酶活的组分,再用聚乙二醇20000浓缩至所需浓度,于4℃保存备用.
(3)Sephadex G-150葡聚糖凝胶过滤层析.将10 mL经聚乙二醇20000浓缩后的酶液上样于预先用50mmol/L、pH=8.0的Tris-HCl缓冲液平衡好的Sephadex G-150葡聚糖凝胶柱(1.6 cm×50 cm)过滤层析,再用同一缓冲液洗脱,分部收集,洗脱流速为0.5mL/min,每管收集洗脱液3mL,按照1.3.3节的方法测定每管洗脱液的蛋白质含量,按照1.3.3和1.3.4节的方法测定降解亚硝酸盐的活性及测定NiR酶活,收集和合并含有NiR酶活的组分,再用聚乙二醇20000浓缩至所需浓度,于4℃保存备用.
1.3.7 亚硝酸盐还原酶分离纯化后蛋白质性质的鉴定
在NiR酶活反应体系中加入100μL的蛋白组分a,b或c、100μL NaNO2溶液(500mg/L)、100μL的0.1mol/L的丁二酸溶液或亚硫酸钠溶液、200μL HEPES缓冲液,反应14h后,按照1.3.3节方法测定体系的亚硝酸盐含量,分别计算组别No.1-No.6(见表1)的比酶活,单位为U/mL.

表1 NiR组分的性质鉴定反应体系Table 1 Reaction system for identifying the NiR fraction
1.3.8 NiR分子质量的SDS-PAGE电泳鉴定
将粗酶液、过DEAE Sepharose Fast Flow交换层析柱后的酶液、过Sephadex G-150柱层析后的酶液分别进行SDS-PAGE电泳分析,分离胶为12.5%,浓缩胶为4%,电极缓冲液为Tris-甘氨酸,电压先为80 mV,后为100mV,电泳完成后,进行考马斯亮蓝染色,再脱色后拍照.
2 结果与讨论
2.1 菌株LJ01的16S rDNA克隆测序
本研究选择克隆的质粒为pMD18-T[8],同时以与该质粒相匹配的M13引物[9-10]来进行克隆测序.将具有降解亚硝酸盐的菌株LJ01的16S rDNA的PCR产物经克隆后进行测序,将所测得的序列(见图1)上传至NCBI网站,检索号为KM058698.将LJ01的16S rDNA序列通过BLAST与NCBI数据库比对可知,菌株LJ01与蜡样芽孢杆菌相似度很高,因此初步鉴定菌株LJ01属于芽孢杆菌属.根据16S rDNA克隆测序的序列绘制系统进化树(见图2),可知LJ01与蜡样芽胞杆菌Bacillus cereus F837/76具有较高的相似性.

图1 LJ01的16S rDNA序列Fig.1 The 16S rDNA sequences of LJ01
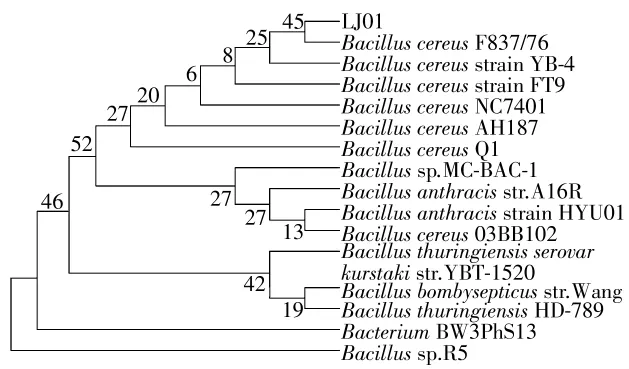
图2 LJ01进化树Fig.2 Phylogenetic tree of LJ01
2.2 LJ01生理生化鉴定
对菌株LJ01进行生理生化特征分析表明,菌株LJ01菌落表面干燥呈不规则状,边缘不整齐且有凸起,菌体能运动,杆状,革兰氏染色为阳性,有芽孢,兼性厌氧生长试验结果为阳性,接触酶试验为阳性,氧化酶试验为阴性,能液化明胶,还原硝酸盐,能水解淀粉,苯丙氨酸脱氨酶为阴性,能耐受2%~10%的NaCl浓度,不能利用柠檬酸盐,卵凝脂酶试验为阳性,吲哚试验为阴性,脲酶试验为阴性,酪素水解为阴性,酪氨酸水解为阴性,V-P试验为阳性,不能利用L-阿拉伯糖、D-木糖、D-甘露糖、葡萄糖,可以利用D-葡萄糖,能在30、40℃下生长,在50℃下不生长.综合菌株LJ01的保守序列16S rDNA的序列信息、进化树、形态特征和生理生化特征,对照伯杰细菌鉴定手册[7],鉴定菌株LJ01为蜡样芽胞杆菌(Bacillus cereus).
2.3 LJ01的亚硝酸盐还原酶的初步定位
采用细胞组分法分离细胞NiR,对各组分进行降解亚硝酸盐活力测定,结果如表2所示.LJ01细胞内外组分的NaNO2降解量为94.04mg/L,而细胞外组分的NaNO2降解量为19.04mg/L,得到细胞内组分的NaNO2降解量为75mg/L,说明细胞内组分对亚硝酸盐的降解量比细胞外组分强,表明菌株LJ01的NiR主要位于细胞内.根据文献报道[4],NiR是一种胞内酶,且位于细胞周质或者是结合在细胞膜上的酶,Blackmore等[11]用细胞裂解法分析 Wolinella succinogenes中的NiR,证实NiR主要位于细胞内.与空白相比,细胞外组分仅能少量降解亚硝酸钠,原因可能为:①离心力较高造成个别细胞破裂,细胞周质组分流失,致使上清液中有少量NiR;②细胞外确实有少量NiR,但是由于酶活较低,因此不考虑细胞外的NiR组分.通过测定细胞组分的NiR酶活,初步证实了LJ01的NiR是一种胞内酶.用溶菌酶处理得到的粗酶主要来源于细胞周质,此组分有较高的酶活,进一步说明LJ01的NiR主要位于细胞内,但NiR在细胞膜和细胞质的精确定位还需要运用免疫胶体金等精确的定位方法[12].
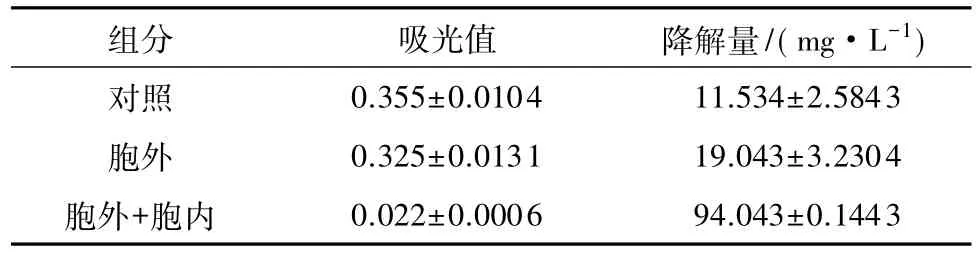
表2 LJ01中NiR的细胞内外定位Table 2 Extracellular and intracellular localization of NiR in LJ01
2.4 NiR的分离纯化
LJ01粗酶液过DEAE Sepharose Fast Flow后的蛋白洗脱曲线如图3所示,从左到右蛋白峰a、b、c的洗脱盐浓度分别为0、100、200mmol/L,而当盐浓度大于300mmol/L时无蛋白峰洗出.a、b、c单个蛋白组分无NiR酶活,当组分a与c、b与c分别混合时有NiR酶活,a与b组分混合时无NiR酶活,表明组分c是一个关键的组分.亚硝酸盐的降解是一种氧化还原反应,在此反应中必须有电子提供者和接受者,是电子受体,NiR具有传递电子和实现催化反应的酶[13],上述现象表明为实现降解亚硝酸盐,除了NiR外,还需要电子提供者.Coyne等[14]的研究表明,一种反硝化细菌中不会同时存在两种NiR,但是可能存在多种电子供体,因此推测,经200mmol/L氯化钠洗脱下来的蛋白组分c是目标蛋白NiR,同时说明a、b两种洗脱蛋白在降解亚硝酸盐过程中不可或缺;Moir等[15]的研究表明,经100mmol/L氯化钠洗脱出的蓝铜蛋白为假天青蛋白,是NiR的电子供体的一种,所以a、b两种电子供体的蛋白混合没有NiR活性.收集有NiR活性的组分c,用聚乙二醇20000浓缩后于-4℃下贮存以备用.对组分c进行洗脱,洗脱曲线见图4.由图可知,洗脱过程中出现3个不同的蛋白峰1、2、3,也需要加入组分a或b才有NiR酶活,蛋白峰2的NiR活性最强,收集有NiR活性的组分,用聚乙二醇20000浓缩后于-4℃下保存备用.
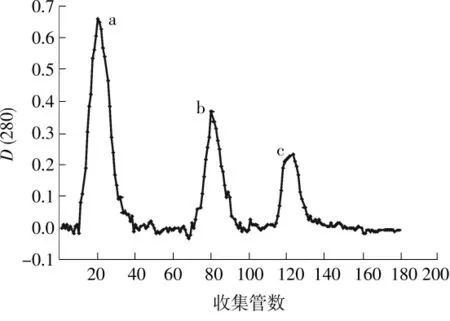
图3 LJ01粗酶液的DEAE Sepharose Fast Flow层析Fig.3 Chromatography of LJ01 crude enzyme solution on DEAE Sepharose Fast Flow
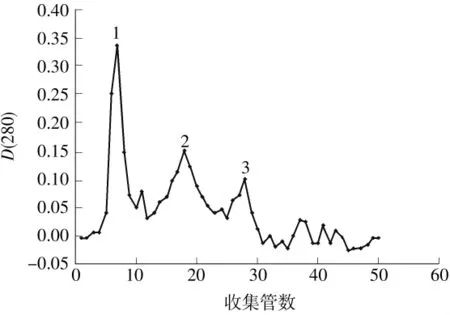
图4 NiR的Sephadex G-150凝胶过滤层析Fig.4 Gel chromatographic separation of NiR on Sephadex G-150
为进一步验证组分a和b为电子供体蛋白质、组分c为NiR,用可提供电子的化合物丁二酸、亚硫酸钠等进行亚硝酸盐降解,结果如表3所示.从表3可以看出,亚硫酸钠和丁二酸均可以为NiR提供电子,但组分a、组分b与亚硫酸钠和丁二酸反应均无NiR活性,而组分c与亚硫酸钠和丁二酸反应后均有NiR活性,表明组分c中含有NiR,也进一步证实了组分a和b中含有亚硝酸盐降解的电子供体,同时在相同浓度下,丁二酸提供电子的能力比亚硫酸钠强.
组分c经葡聚糖凝胶层析后被收集到的蛋白质进行SDS-PEAG电泳分析(见图5),条带4、5与2、3相比,在相同处出现条带,单体的分子质量最可能为60ku,这与Vigara等[16]研究的粒藻中含铁氧还原蛋白的亚硝酸盐还原酶(其分子质量为63 ku)接近.由于是变性电泳的结果,LJ01中组分c是三聚体或二聚体还需要进一步研究.Coyne等[14]指出,NiR是在厌氧条件下产生的酶,研究发现蜡样芽孢杆菌LJ01在有氧情况下可以产生NiR,而且含量低但NiR活性高.Moir等[15]发现在厌氧或需氧情况下培养的细胞中仅检测到NiR是cd1型,经SDS-PAGE电泳后确定LJ01中亚硝酸盐还原酶的单体分子质量约为30 ku,与文献[16-17]中报道的二聚体蛋白cd1型亚硝酸盐还原酶单体分子质量接近,与Cu型亚硝酸盐还原酶单体分子质量(约为36ku)相差较大,因而推测菌株LJ01产生的亚硝酸盐还原酶可能为cd1型.
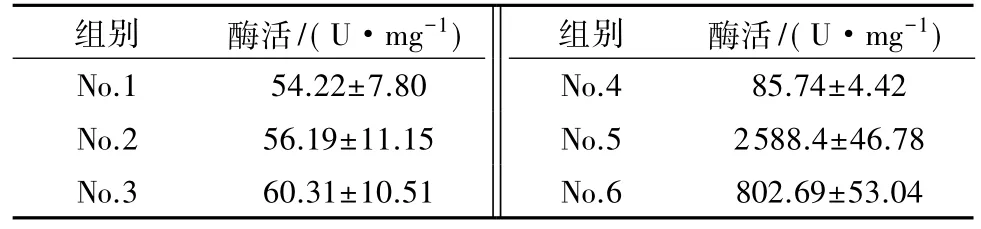
表3 加入电子供体后各洗脱峰的酶活Table 3 Enzyme activity of each eluting peak after adding an electron donor

图5 LJ01中NiR的电泳图Fig.5 Electrophoretogram of NiR in LJ011—蛋白标准品;2—粗酶液;3—经DEAE Sepharose Fast Flow阴离子交换层析后组分;4—葡聚糖G-150凝胶层析后19管组分;5—葡聚糖G-150凝胶层析后18管组分
2.5 LJ01的NiR纯化后的酶活
LJ01各部纯化后的结果见表4,从表中可以看出,通过离子交换柱层析分离和凝胶过滤层析分离纯化,所得的蛋白逐渐减少,凝胶过滤后只得到0.54mg蛋白(原料为从1L菌液中提取得到的400mg粗蛋白),但是还未达到电泳纯,分离纯化过程中NiR酶被提纯了17.57倍,酶活得率为2.37%,经葡聚糖凝胶纯化后的NiR酶活达到4004.89U/mg.
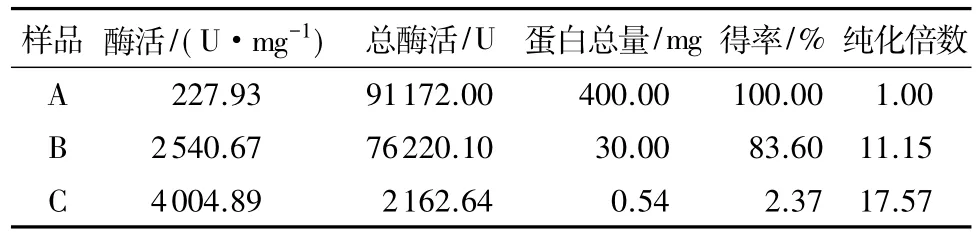
表4 LJ01中的NiR纯化结果1)Table 4 Purification results of NiR in LJ01
3 结语
从豆瓣酱中筛选出一株能高效降解亚硝酸盐的菌株LJ01,综合其形态、生理生化特性以及16S rDNA基因序列,将LJ01鉴定为蜡样芽孢杆菌.通过测定LJ01细胞中不同组分的酶活研究了亚硝酸盐还原酶的初步定位.LJ01经100mg/L的NaNO2诱导后,用溶菌酶破壁后的粗酶液先经阴离子DEAE Sepharose Fast Flow层析柱分离,测定不同蛋白组分a、b、c降解亚硝酸盐的活力,利用0.1mol/L无机电子供体丁二酸和亚硫酸钠等鉴定出组分c为亚硝酸盐还原酶,再经葡聚糖凝胶G-150层析柱分离,获得较纯的亚硝酸盐还原酶,酶活达到4004.89U/mg,得率为2.37%,纯化后其NiR的酶活提高了17.57倍.经SDS-PAGE电泳后确定LJ01中亚硝酸盐还原酶的单体分子质量约为30 ku.关于蜡样芽孢杆菌中NiR的研究还未见报道,因此对LJ01中的NiR需要进一步研究.例如,进一步纯化以得到纯度更高度NiR蛋白,制备NiR抗体进行细胞内精确定位,为更好地纯化提供借鉴;另外还需要对LJ01中NiR的结构和性质做更深入的研究.
[1] Santamaria P.Nitrate in vegetables:toxicity,content,intake and EC regulation[J].Journal of the Science of Food and Agriculture,2006,86(1):10-17.
[2] Oh CK,Oh M C,Kim SH.The depletion of sodium nitrite by lactic acid bacteria isolated from kimchi[J].Journal of Medicinal Food,2004,7(1):38-44.
[3] Paik H D,Lee J Y.Investigation of reduction and tolerance capability of lactic acid bacteria isolated from kimchiagainstnitrate and nitrite in fermented sausage condition[J].Meat Science,2014,97(4):609-614.
[4] Liu DM,Wang P,Zhang X Y,etal.Characterization ofnitrite degradation by Lactobacillus casei subsp.rhamnosus LCR 6013[J].PLOSone,2014,9(4):1-7.
[5] 马放,王弘宇,周丹丹,等.好氧反硝化菌株X31的反硝化特性[J].华南理工大学学报:自然科学版,2005,33 (7):42-46.
Ma Fang,Wang Hong-yu,Zhou Dan-dan,et al.Denitrification characteristics of an aerobic denitrifying bacterium pseudomonas chloritidismutans strain X31[J].Journal of South China University of Technology:Natural Science Edition,2005,33(7):42-46.
[6] Green M R,Sambrook J,Russell D,et al.Molecular cloning a laboratory manual[M].Cold Spring Harbor:Cold Spring Harbor Laboratory Press,2000.
[7] Buchanan R E,Gibans N E.Bergey’s manual of systemaic bacteriology[M].Beijing:Science Press,1984.
[8] Qi F,Yao L,Tan X,et al.Construction,characterization and application ofmolecular tools formetabolic engineering of Synechocystis sp.[J].Biotechnology Letters,2013,35(10):1655-1661.
[9] Lin Y,Xiong G.Molecular cloning and sequence analysis of the chitinase gene from Bacillus thuringiensis serovar alesti[J].Biotechnology Letters,2004,26(8):635-639.
[10] Zhang L L,Lin J,Luo L,et al.A novel Bacillus thuringiensis strain LLB6,isolated from bryophytes,and its new cry2Ac-type gene[J].Letters in Applied Microbiology,2007,44(3):301-307.
[11] Blackmore R,Roberton A M,Brittain T.The purification and some equilibrium properties of the nitrite reductase of the bacterium Wolinella succinogenes[J].The Biochemistry Journal,1986,233(2):547-552.
[12] Coyne M S,Arunakumari A,Pankratz H S,et al.Localization of the cytochrome cd1 and copper nitrite reductases in denitrifying bacteria[J].Journal of Bacteriology,1990,172(5):2558-2562.
[13] Kuznetsova S,Zauner G,Aartsma T J,et al.The enzyme mechanism of nitrite reductase studied atsingle-molecule level[J].Proceedings of the National Academy of Sciences,2008,105(9):3250-3255.
[14] Coyne M S,Arunakumari A L A,Averill B A,et al.Immunological identification and distribution of dissimilatory heme cd1 and nonheme copper nitrite reductases in denitrifying bacteria[J].Applied and EnvironmentalMicrobiology,1989,11(55):2924-2931.
[15] Moir JW B,Baratta D,Richardson D J,et al.The purification of a cd1-type nitrite reductase from,and the absence of a copper-type nitrite reductase from,the aerobic denitrifier Thiosphaera pantotropha;the role of pseudoazurin as an electron donor[J].European Journal of Biochemistry,1993,212(2):377-385.
[16] Vigara J,García-Sánchez M I,Garbayo I,et al.Purification and characterization of ferredoxin-nitrite reductase from the eukaryotic microalga Monoraphidium braunii[J].Plant Physiology and Biochemistry,2002,40(5): 401-405.
[17] Kataoka K,Yamaguchi K,Sakai S,et al.Characterization and function of Met150Gln mutant of copper-containing nitrite reductase from Achromobacter cycloclastes IAM1013[J].Biochemical and Biophysical Research Communications,2003,303(2):519-524.
Identification and Nitrite Degradation Ability of Bacillus cereus LJ01
Liu Dong-mei Luo Tong-hui Yang Dan-xia Huang Juan Wu Hui Yu Yi-gang Li Li
(School of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640,Guangdong,China)
A strain LJ01 with strong nitrite degradation abilitywas isolated from fermented bean paste and was identified as Bacillus cereus.Then,the primary cell localization of this nitrite reductasewas examined bymeasuring the enzyme activity of different cellular components from LJ01 cell.After LJ01 was induced by 100mg/L sodium nitrite solution and treated with lysozyme,the crude enzyme solution of LJ01 was first separated by means of the anion DEAE Sepharose Fast Flow chromatography,and the nitrite degradation activity of fractions a,b and c wasmeasured.Moreover,by using inorganic electron donors such as 0.1mol/L succinic acid and sodium sulfite solution,fraction c was identified as a critical nitrite reductase and was separated by Sephadex G-150 column to get pure protein.The identification results show that 0.54mg of active enzyme protein with an activity of 4004.89U/mg can be obtained from 1L of the fermentation liquid,and that the specific NiR activity of the purified enzyme increases by 17.57 foldswith a recovery of 2.37%.In addition,SDS-PAGE results show that themonomermolecularmass of LJ01 is about 30ku.
Bacillus cereus;nitrite reductase;nitrite degradation;16S rDNA;cell localization
s:Supported by the National Natural Science Foundation of China(31101254),the Natural Science Foundation of Guangdong Province(S2011010005679)and the Key Science and Technology Program of Guangdong Province(2013B020312002,2014A020208019,412051029089)
Q939.97
10.3969/j.issn.1000-565X.2015.06.021
1000-565X(2015)06-0135-07
2014-10-28
国家自然科学基金资助项目(31101254);广东省自然科学基金资助项目(S2011010005679);广东省科技攻关项目(2013B020312002,2014A020208019,412051029089);华南理工大学中央高校基本科研业务费专项资金资助项目(D2116760)
刘冬梅(1972-),女,博士,副教授,主要从事食品微生物的利用与控制研究.E-mail:liudm@scut.edu.cn
