适用于细粒棘球蚴囊液蛋白质组分析的双向电泳技术
2015-06-23李居怡刘巧媚黄文静阮周莹邓艾平
李居怡,刘巧媚,黄文静,阮周莹,邓艾平
(1.武汉市中心医院药学部,湖北武汉 430021;2.武汉市第三医院医务处,湖北武汉 430061;3.武汉市中心医院内分泌科,湖北武汉 430021;4.武汉市中心医院眼科,湖北武汉 430021)
◇技术方法◇
适用于细粒棘球蚴囊液蛋白质组分析的双向电泳技术
李居怡1,刘巧媚2,黄文静3,阮周莹4,邓艾平1
(1.武汉市中心医院药学部,湖北武汉 430021;2.武汉市第三医院医务处,湖北武汉 430061;3.武汉市中心医院内分泌科,湖北武汉 430021;4.武汉市中心医院眼科,湖北武汉 430021)
目的 建立适用于细粒棘球蚴囊液蛋白质组的双向电泳分离条件。方法 冷冻干燥法制备囊液总蛋白提取物,观察不同的蛋白样品处理方法、IPG胶条p H范围和电泳上样量对双向电泳图谱的影响。结果 经ReadyPrepTM2-D Cleanup Kit处理的提取物上样量为400μg,在p H7~10范围的胶条进行双向电泳分离,可获取蛋白斑点较多、重复性较好的二维电泳图谱。结论 建立的细粒棘球蚴囊液双向电泳技术及图谱,可为细粒棘球蚴虫蛋白质组学的研究提供理论依据。
细粒棘球蚴;囊液;蛋白质组学;双向电泳
细粒棘球蚴病(囊型包虫病)是由细粒棘球绦虫幼虫引起的一种人畜共患寄生虫病,该病呈世界性分布[1]。我国是细粒棘球蚴病发病率最高的国家之一,尤其在畜牧业高度发达的西北地区,包虫病已成为高发性地方病[2]。包虫病在西北地区的广泛流行,严重地危害当地广大人民群众的健康水平,并在一定程度上制约了当地经济的发展。因此,包虫病的早期预防、早期诊断将为提高广大人民群众的生活质量产生积极的意义,而寻找包虫病有诊断价值的抗原是目前包虫病防治的热点之一。
目前,蛋白质组学的核心技术——双向电泳技术,第一向基于蛋白质的等电点不同用等电聚焦分离,第二向则按分子量的不同用SDS-PAGE分离,把复杂蛋白混合物中的蛋白质在二维平面上分开,样品中的蛋白经过2次垂直方向上的分离,其结果可为一张拥有近千个蛋白点的“繁星图”,利用计算机软件的分析,基质辅助激光解吸附飞行时间质谱(MALDI-TOE-MS)以及氨基酸分析等鉴定技术[3],从大规模水平上研究蛋白质的特征,包括蛋白质的表达水平、翻译后的修饰、蛋白与蛋白
相互作用等,由此获得蛋白质水平上的关于疾病发生、细胞代谢等过程的整体而全面的认识。我们以细粒棘球蚴囊液为实验材料进行双向电泳技术的建立和条件优化,以期能为细粒棘球蚴蛋白质组学的进一步研究奠定基础,并为包虫病有诊断价值抗原的研究奠定基础。
1 材料与方法
1.1 材料细粒棘球蚴囊液的收集:从宁夏医科大学附属医院包虫病患者手术摘除的完整包囊,无菌条件下抽取囊液,于冻干机冻成粉末,-85℃保存备用。
1.2 方法
1.2.1 细粒棘球蚴囊液总蛋白的提取与处理 取细粒棘球蚴囊液冻干粉末5 mg,加入预冷的裂解液[9 mol/L尿素,0.065 mol/L 3-(3-cholamidopropyl)dimethyl-ammonio-1-propane sulfonate(CHAPS),0.065 mol/L dithiothreitol(DTT),0.021 mol/L protease inhibitor cocktail],充分振荡混匀,于4℃放置1 h,再以12 000×g、4℃离心30 min,收集上清液,保存于-85℃备用,蛋白浓度测定采用Bradford[4]法。
TCA-丙酮沉淀法[5]处理提取物:取上述400μL上清液加入等体积预冷的1.22 mol/L TCA/丙酮,-20℃沉淀过夜,12 000×g、4℃离心15 min,收集沉淀,沉淀用预冷的丙酮(含0.020 mol/L DTT,适量protease inhibitor cocktail)重悬,-20℃静置30 min,14 000×g、4℃离心15 min,弃上清,所得沉淀加入200μL样品水化液[8 mol/L尿素,0.065 mol/L CHAPS,0.065 mol/L DTT,0.003 mol/L Bio-Lyte(p H:3-10),0.15×10-5mol/L溴酚蓝],保存于-85℃,蛋白浓度测定采用Bradford法。
ReadyPrepTM2-D Cleanup Kit(除盐试剂盒)处理提取物,参照BIO-RAD公司ReadyPrepTM2-D Cleanup Kit说明书逐步对提取物进行处理,最后在样品的沉淀中加入400μL样品水化液,保存于-85℃,蛋白浓度测定采用Bradford法。
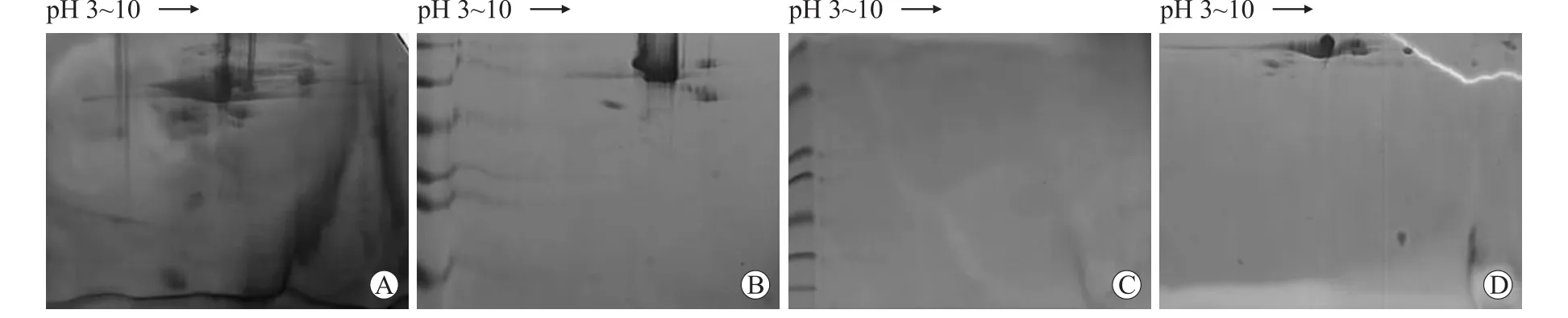
图1 细粒棘球蚴囊液样品的不同处理方法的比较Eig.1 Comparison of hydatid-cyst fluid protein extracted by different extraction methods from Echinococcus granulosus
AurumTMSerum Protein Mini Kit(除高峰度蛋白试剂盒)处理提取物,参照BIO-RAD公司AurumTMSerum Protein Mini Kit说明书逐步对提取物进行处理,对所得上清液蛋白采用Bradford法测定其蛋白浓度。
1.2.2 双向电泳 取上述蛋白处理后的蛋白溶液200μL,将预制冷冻在-20℃保存的immobilized p H gradient(IPG)胶条(p H:3~10,7 cm;p H:7~10,7 cm)在室温放置10 min。第一向等电聚焦采用下列参数:主动水化50 V 12 h(20℃);Step1 250 V线性30 min;Step2 500 V快速30 min;Step3 4 000 V线性3 h;Step4 4 000 V快速20 000 Vh;Step5 500 V快速任意时间。聚焦电泳完毕,胶条在平衡液I(6 mol/L尿素、0.375 mol/L Tris-HCl(p H 8.8)、2.17 mol/L甘油、0.069 mol/L SDS、0.13 mol/L DTT)中振荡平衡15 min,再换平衡液Ⅱ(6 mol/L尿素、0.375 mol/L Tris-HCl(p H8.8)、2.17 mol/L甘油、0.069 mol/L SDS、0.135 mol/L碘乙酰胺)振荡平衡15 min。平衡后的胶条放入0.52 mol/L的SDS-PAGE中电泳,待溴酚蓝指示到达凝胶边缘时结束电泳。
1.2.3 凝胶染色与图像分析 凝胶采用考马斯亮蓝法染色,采用GS-800 Calibrated Densitometer投射扫描2-DE凝胶,用PDQuest 8.0 2D Analysis Software对所得图像进行分析。
2 结 果
2.1 细粒棘球蚴囊液样品的不同处理方法的比较提取的样品未经任何处理,经双向电泳分离(样品处理方法的比较均用p H 3~10胶条,蛋白取样量为400μg)后,蛋白聚集明显,点与点之间没有界限(图1A)。经ReadyPrepTM2-D Cleanup Kit处理后的样品,蛋白斑点较图A清晰很多,条纹明显减少(图1B)。经AurumTMSerum Protein Mini Kit处理后的样品,图上几乎没有蛋白斑点(图1C)。经TCA-丙酮沉淀法处理的样品,单个蛋白斑点明显增多(图1D)。
2.2 不同p H范围胶条的比较由图1可见,蛋白斑点主要集中在胶的上方碱性区域,在胶的酸性端有很大空白。故分别以p H 3~10与p H 7~10胶条进行双向电泳,比较二者对囊液蛋白提取物蛋白的分离效果。结果显示,p H 7~10胶条分离囊液聚集蛋白的效果好于p H 3~10(图2)。

图2 细粒棘球蚴囊液样品的不同p H范围胶条等电聚焦的比较Eig.2 Comparison of hydatid-cyst fluid protein with different p H range of IPG strip from Echinococcus granulosus
2.3 不同样品上样量的比较图3中,在p H 7~10的胶条范围,图3C(400μg)上样量是图3B(200μg)的2倍,蛋白的斑点总数明显多于图3B,但是不足的是在p H 8位置的蛋白聚集比图3B严重。在p H 3~10的胶条范围,图3A(400μg)上样量是图3E(800μg)的1/2,是图3D的2倍,图3A较图3D(200μg)蛋白斑点清晰很多,而较图3E少了一些蛋白斑点,提示囊液中有些蛋白量非常小。
3 讨 论
双向电泳技术是目前分离组分复杂的组织总蛋白的最有效技术,也是蛋白质组学研究的主要技术之一。双向电泳图谱的高分辨率、高重复性是准确分析鉴定细粒棘球蚴虫相关蛋白的必备条件。本研究对蛋白样品处理方法、电泳上样量和IPG胶条p H范围进行了一系列改进与优化,获得了蛋白斑点数目较多而且较清晰的图谱,能满足后期的质谱分析。
有学者研究发现,用电泳方法分析人体棘球蚴液,其中44%为白蛋白,39%为α-球蛋白及β-球蛋白,17%为γ-球蛋白,棘球蚴液中的蛋白质具有抗原性[6]。本研究通过采用不同的方法对提取物进行处理后发现棘球蚴液大部分蛋白集中在分子质量60 ku左右、p H在8左右,通过AurumTMSerum Protein Mini Kit处理后发现,凝胶图上几乎没有蛋白斑点。提示,在除高峰度蛋白的同时把其他的蛋白一并除去,在建立细粒棘球蚴囊液双向电泳图谱时,不建议采用除高峰度蛋白试剂盒。通过p H 3~10与p H 7~10两种胶条做等电聚焦后发现,样品中的蛋白主要在碱性区域,用p H 7~10胶条分离蛋白的效果更好,得到的单个蛋白斑点更多。而上样量的差异显示,蛋白的上样量越大,得到的蛋白斑点相应较多,然而,白蛋白、球蛋白的聚集就会相应地密集,难以辨别,提示样品中的有些蛋白量很小,常规上样量很难能辨别它们。

图3 细粒棘球蚴囊液不同样品上样量的比较Eig.3 Comparison of hydatid-cyst fluid protein with different loading amount from Echinococcus granulosus
ROTT等[7]研究发现,细粒棘球绦虫抗原B(Eg AgB)是细粒棘球蚴囊液的一种主要抗原成分,是大分子热稳定脂蛋白;Eg AgB是常用的诊断细粒棘球蚴病的抗原,有较高的特异性和确诊率[8]。本研究试图建立细粒棘球蚴囊液蛋白质组的双向电泳图谱,为后期质谱鉴定做好基础工作,为质谱技术鉴定出囊液中的各种蛋白、寻找有价值的诊断抗原提供基础理论依据。
[1]MCMANUS DP,ZHANG W,LI J,et al.Echinococcosis[J]. Lancet,2003,362(9392):1295-304.
[2]CRAIG PS.Epidemiology of human alveolar echinococcosis in China[J].Parasitol Int,2006,55:221-225.
[3]兰彦,柳正良,钱小红.蛋白质组学—开辟21世纪药物研究的新思路[J].国外医学药学分册,2000,27(3):129-133.
[4]NOBLE JE,BAILEY MJ.Quantitation of protein[J].Methods Enzymol,2009,463:73-95.
[5]CILIA M,FISH T,YANG X,et al.A comparison of protein extraction methods suitable for gel-based proteomic studies of aphid proteins[J].J Biomol Tech,2009,20(4):201-15.
[6]LI JY,JU Y,WANG XF,et al.Analysis of the chemical components in hydatid fluid from Echinococcus granulosus[J].Rev Soc Bras Med Trop,2013,46(5):605-610.
[7]ROTT MB,FERNANDEZ V,FARIAS S,et al.Comparative analysis of two different subunits of antigen B from Echinococcus granulosus:gene in Escherichia coli and serological evaluation[J].Acta Trop,2000,75(3):331-340.
[8]GONZA LG,LORENZO C,NIETO A.Improved immunodiagnosis of cystic hydatid disease by using a synthetic peptide with higher diagnostic value than that of its parent protein,Echinococcus granulosus antigen B[J].J Clin Microbiol,2000,38(11):3979-3983.
(编辑 卓选鹏)
Two-dimensional electrophoresis for proteomics analysis of hydatid fluid of the Echinococcus granulosus
LI Ju-yi1,LIU Qiao-mei2,HUANG Wen-jing3,RUAN Zhou-ying4,DENG Ai-ping1
(1.Department of Pharmacy,the Central Hospital of Wuhan,Wuhan 430021;2.Medical Department,the Third Hospital of Wuhan,Wuhan 430061;3.Department of Endocrinology,the Central Hospital of Wuhan,Wuhan 430021;4.Department of Ophthalmology,the Central Hospital of Wuhan,Wuhan 430021)
Objective To establish two-dimensional electrophoresis(2-DE)technology for hydatid fluid of the parasiteEchinococcus granulosus.Methods We extracted total proteins ofEchinococcus granulosusby lyophilization and studied the changes of 2-DE picture under different methods of dealing with the protein samples,p H range of IPG strip and quantitative loading of the samples.Results The two-dimensional collection of illustrative plate with better resolution and repetition was achieved when the hydatid fluid dealt with ReadyPrepTM2-D Cleanup Kit was analyzed using 400μg of quantitative loading and IPG strips p H 7-10.Conclusion The established 2-DE method and maps of hydatid fluid of the parasiteEchinococcus granulosuscan provide theoretical evidence for proteomic study ofEchinococcus granulosus.
Echinococcus granulosus;hydatid fluid;proteome;two-dimensional electrophoresis
R183.4
A
10.7652/jdyxb201505027
2014-09-28
2015-02-24
国家自然科学基金资助项目(No.30960360);武汉市临床医学科研项目(No.WX11A02,WZ15D19)Supported by the National Natural Science Eoundation of China(No.30960360);Wuhan Clinical Medical Research Project(No. WX11A02,WZ15D19)
邓艾平.E-mail:187076605@qq.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150817.1537.004.html(2015-08-17)
