百草枯促进肺间质细胞增殖依赖上皮细胞TGF-β信号
2015-06-23李晓青吴梦茹
高 烨,李晓青,吴梦茹,梁 欢
(西安交通大学医学部第一附属医院急诊科,陕西西安 710061)
百草枯促进肺间质细胞增殖依赖上皮细胞TGF-β信号
高 烨,李晓青,吴梦茹,梁 欢
(西安交通大学医学部第一附属医院急诊科,陕西西安 710061)
目的 观察百草枯(Paraquat,PQ)诱导人肺间质成纤维细胞HEL299纤维化增殖过程中肺上皮细胞的重要作用及其调节的信号机制。方法 应用体外人肺上皮细胞和间质细胞共培养系统,MTT法检测PQ对人肺间质成纤维细胞HEL299和HPAEpiC细胞增殖的影响,ELISA检测共培养体系中转化生长因子-β(TGE-β)变化,Real-time PCR和Western blot检测上皮HPAEpiC细胞的TGE-β信号通路变化对肺间质成纤维细胞HEL299增殖的影响。结果 PQ对肺间质成纤维细胞HEL299体外增殖依赖于上皮细胞的存在。PQ促进肺上皮HPAEpiC细胞TGE-β的分泌,进而促进肺间质成纤维细胞增殖;阻断上皮细胞TGE-β信号将明显减少间质HEL299细胞的增殖。结论 PQ促进人肺间质细胞上皮HEL299的增殖依赖微环境中上皮HPAEpiC细胞的TGE-β信号。本研究结果阐述了PQ诱导肺纤维化的一种新机制。
百草枯;肺纤维化;转化生长因子-β(TGE-β)
百草枯(paraquat,PQ)是一种高效的除草剂,在世界范围内广泛使用。我国的PQ中毒发病率不断增加,死亡率近100%,主要的发病机制是诱导肺纤维化,进而呼吸衰竭死亡,目前缺乏有效措施,主要是其发病分子机制不清楚[1-2]。我们前期的研究发现,PQ可以诱导肺上皮细胞发生“EMT”样改变,主要通过上皮细胞自分泌TGE-β信号调控[3]。本研究从细胞微环境角度证实PQ可诱导肺间质细胞纤维化依赖于上皮细胞的TGE-β信号通路,阻断上皮细胞的TGE-β信号通路将明显抑制间质细胞增殖,提示上皮细胞TGE-β信号可能是PQ中毒的潜在治疗靶点。
1 材料与方法
1.1 材料
1.1.1 细胞株 人肺上皮细胞株HPAEpiC和肺间质成纤维细胞HEL299购自美国ATCC。
1.1.2 主要试剂 百草枯(Sigma公司);DMEM(高糖型,Gibco公司);新生胎牛血清(杭州四季青生物技术公司);四甲基偶氮唑盐(MTT,Sigma公司);二甲基亚砜(DMSO,Sigma公司);ELISA试剂盒(上海伊科赛公司);总RNA快速提取试剂盒(East 200,Eastagen Biotech);逆转录试剂盒(fermentas,MBI公司);引物由北京三博远志生物技术有限责任公司合成;TGE-β肽由美国Pharmingen公司合成;检测及中和抗体购自ABCM公司。
1.2 方法
1.2.1 细胞培养 人肺上皮HPAEpiC细胞和肺间质成纤维细胞HEL299用含有100 m L/L胎牛血清(ECS)的DMEM、100 U/m L青霉素和100 mg/L链霉素的DMEM,在50 m L/L CO2的37℃细胞培养箱内常规培养。
1.2.2 MTT法检测细胞增殖 2×103人肺上皮HPAEpiC细胞和(或)肺间质成纤维细胞HEL299接种于96孔板,24 h细胞贴壁后,加入不同浓度的(400、200、100、50、10、0μmol/L)PQ溶液,每个组设3个平行孔。继续培养24 h后,各孔加入20μg的MTT溶液(5 g/L),置37℃培养箱中孵育4 h,再加入150μg二甲基亚砜(DMSO),振荡10 min,使结晶物充分溶解,静置后在酶联仪上选择检测波长490 nm比色测定各孔的吸光度(A值)。
1.2.3 共培养体系 体外人肺上皮和间质细胞共培养体系使用4μm孔直径Transwell系统。1×103人肺上皮HPAEpiC细胞接种于Transwell上室中,同时5×103肺间质细胞接种Transwell下室内。使用SiRNA或中和抗体阻断上皮HPAEpiC细胞TGE-β信号,培养体系中加入100μmol/L PQ,37℃、50 m L/L CO2孵箱孵育48 h后移去上室,检测下室肺间质细胞生长,每组设3个复孔。
1.2.4 ELISA法检测共培养体系上清液中TGE-β含量 1×103人肺上皮HPAEpiC细胞接种于24孔板或者Transwell上室中,或5×103肺间质细胞接种Transwell下室内,按照100μmol/L的PQ处理细胞培养48 h后,收集细胞上清液,检测各组细胞上清液中TGE-β含量。每组设3个复孔。
1.2.5 Real-time PCR检测细胞TGE-βm RNA表达 取对数生长期人肺上皮HPAEpiC细胞,调整细胞密度为5×104接种于6孔板,PQ终浓度为100 μmol/L,37℃、50 m L/L CO2孵箱孵育48 h。实验重复3次。按照试剂盒操作要求,提取总RNA,逆转及PCR扩增,即1μg总RNA,使用SuperscriptⅢ酶进行逆转录。实时定量PCR反应使用Bio-Rad公司CEX96系统,以目的基因mRNA/β-actin mRNA比值来表示mRNA的相对表达。
1.2.6 Western blot检测细胞目的蛋白表达 胞裂解使用RIPA缓冲液(Tris-CL 7.4,150 mmol/L NaCl,10 m L/L Triton X-100,10 m L/L sodium deoxycholate,10 m L/L SDS)。20μg蛋白样品分别上样到8%~12%的SDS/PAGE分离凝胶上,然后转移到PVDE膜上。50 g/L脱脂牛奶室温封闭1 h,加入特异性一抗4℃过夜。PBS-T洗涤3次后,加入HRP偶联的二抗室温孵育1 h,用ECL系统检测TGE-β蛋白表达。
1.3 统计学分析应用SPSS 10统计分析软件进行统计分析。计量数据均以均数±标准差(±s)表示,两组间差异应用Student-t检验分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 PQ对人间质细胞增殖依赖上皮细胞我们首先检测了PQ对肺间质HEL299细胞增殖的影响。以不同浓度PQ和HEL299细胞孵育,在不同孵育时间点收集细胞,使用MTT法检测PQ对肺上皮细胞的增殖影响。结果如图1A所示,PQ诱导间质细胞死亡呈现剂量和时间依赖性关系,在第3天不同浓度之间进行t检验分析,差异有统计学意义(P<0.05)。PQ抑制HEL299细胞的IC50值为210.3μmol/L(图1B),结合IC50和生长曲线,我们确定100μmol/L PQ用于后续实验研究。
2.2 PQ增加人肺间质细胞体外增殖能力依赖于上皮细胞存在我们既往研究证实,模拟体内PQ中毒过程证实100μmol/L PQ与HPAEpiC细胞孵育24 h,可使肺上皮细胞发生形态学改变。本研究应用体外共培养系统(图2A),结果显示,与对照空白细胞相比较,PQ可明显增加肺间质HEL299细胞体外增殖能力(图2B),在第3天两组间进行t检验分析,差异有统计学意义(P<0.05)。PQ处理人肺间质细胞的增殖可能依赖于上皮细胞分泌的存在。
2.3 PQ诱导人肺间质细胞增殖依赖于上皮细胞TGF-β信号既然PQ诱导肺间质细胞增殖依赖于上皮细胞的存在,那么上皮细胞是通过何种信号来调节间质细胞增殖。体外的结果显示,不同剂量的PQ可诱导肺上皮TGE-β分泌量增加(图3A),在0、50、75、100μmol/L浓度之间进行t检验分析,差异有统计学意义(P<0.05)。我们模拟体内浓度,在HEL299细胞加入100μmol/L PQ和(或)2μg/L TGE-β合成肽,体外生长实验结果显示,与DMSO对照细胞相比,TGE-β可以促进PQ诱导的肺间质细胞体外增殖(图3B、3C),差异有统计学意义(P<0.05)。提示PQ诱导肺间质细胞增殖依赖于上皮细胞的TGE-β信号的活化。
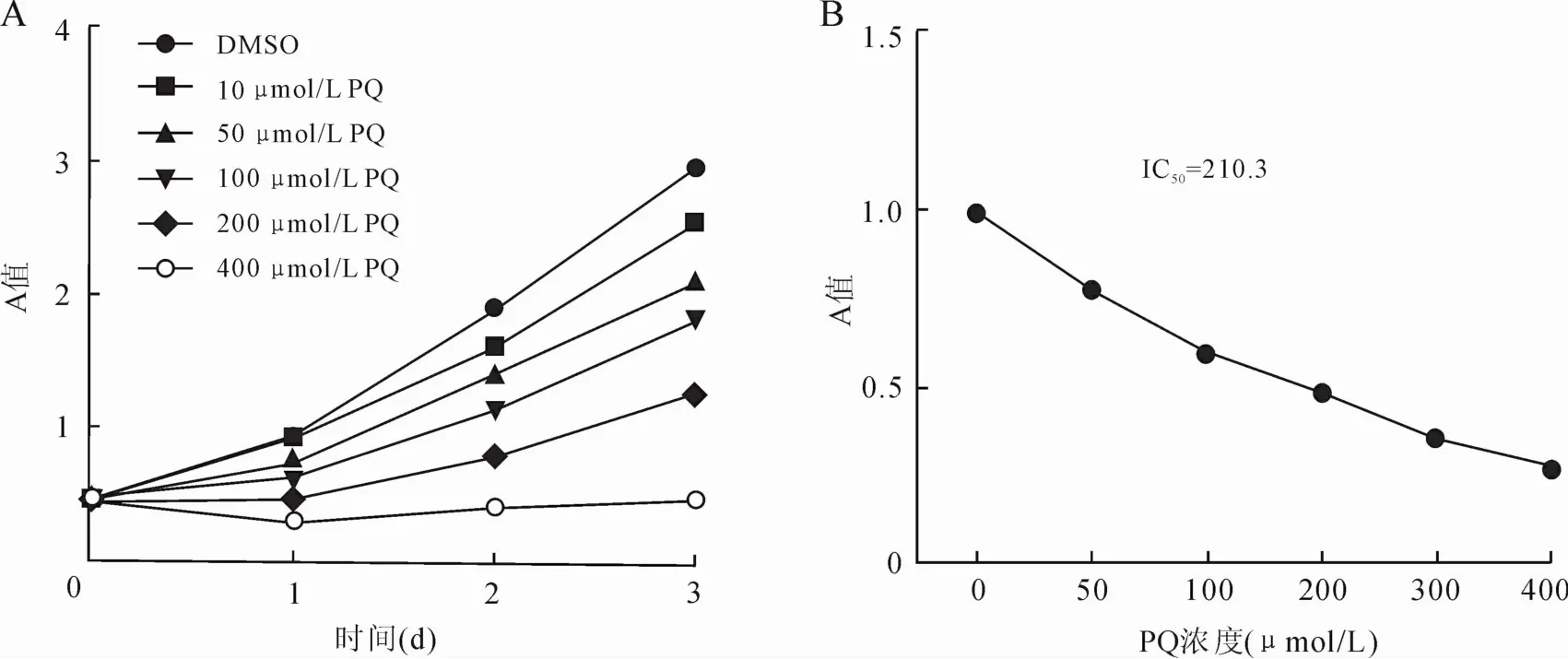
图1 MTT法检测PQ对HEL299细胞增殖的影响Eig.1 The growth of HEL299 cells was determined by MTT assay

图2 PQ促进人肺间质细胞增殖依赖上皮细胞HPAEpiC存在Eig.2 Promotion of human lung stroma cell HEL 299 growth by PQ depended on the existence of epithelial HPAEpiC cells

图3 PQ增加HPAEpiC细胞分泌TGF-β,进而促进肺间质细胞HEL299的增殖Eig.3 PQ could increase HEL 299 cell growth via the secretion of TGE-βby HPAEpiC cells
2.4 阻断上皮细胞TGF-β信号通路将抑制PQ诱导人肺间质细胞增殖如上述结果所示,PQ可以诱导肺间质细胞增生依赖于上皮细胞TGE-β信号活化,那么抑制肺上皮细胞TGE-β信号是否可以逆转PQ诱导的间质增生。如图4A所示,应用体外上皮和间质细胞共培养体系,应用siRNA敲除上皮细胞TGE-β或特异性中和抗体中和共培养体系TGE-β信号(图4B上图Q-PCR,下图Western blot),与对照组比较,可明显逆转PQ诱导的肺间质HEL299细胞增殖(图4C),差异有统计学意义(P<0.05),提示特异性阻断上皮细胞TGE-β信号,将可能抑制PQ介导的肺间质细胞增生。
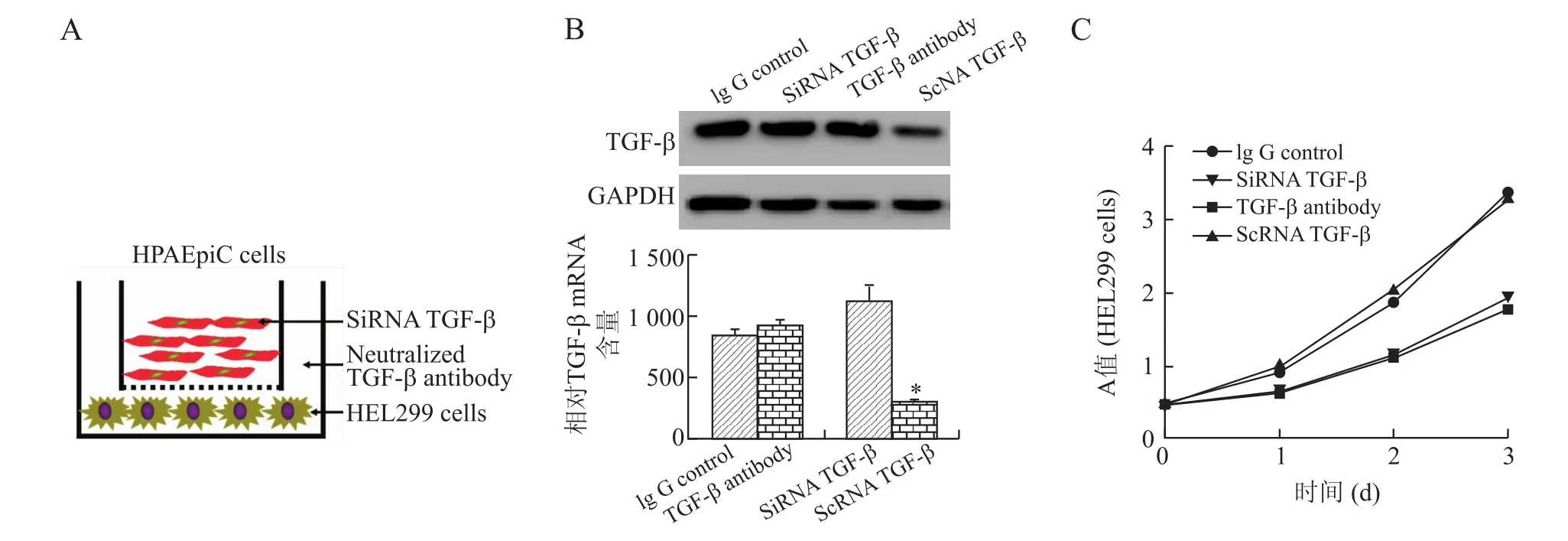
图4 SiRNA或TGF-β中和抗体阻断HPAEpiC细胞分泌TGF-β,将抑制肺间质细胞HEL299的增殖Eig.4 Knocking-down/blocking TGE-βby SiRNA or antibody led to the inhibition of HEL299 cells
3 讨 论
百草枯(paraquat,PQ)中毒是急诊科常见的疾病之一,其发病率不高,但死亡率近100%。其主要的发病机制是诱导肺纤维化,进而呼吸衰竭死亡,目前缺乏有效措施[1]。我们前期的研究发现,PQ可以诱导肺上皮细胞发生“EMT”样改变,主要通过上皮细胞自分泌TGE-β信号调控[3]。本研究从肺脏细胞微环境角度着手,进一步证实PQ诱导的肺间质细胞纤维化依赖于上皮细胞的TGE-β信号通路,应用特异性siRNA和抗体阻断肺上皮细胞的TGE-β信号通路将明显抑制间质细胞增殖,提示上皮细胞TGE-β信号可能是PQ中毒的潜在治疗靶点。
肺脏是PQ中毒的重要靶器官之一,主要表现为肺水肿、缺氧和呼吸衰竭,最终发生肺纤维化,引起长期限制性的肺功能障碍而死亡。其主要病理改变为肺脏间质细胞增生,大量炎症细胞浸润,最终不可逆地影响肺通气功能[2]。
TGE-β是肺上皮细胞分泌的重要细胞因子,其通过与受体结合激活下游的信号通路,促进细胞增殖和迁移等[4-6]。TGE-β下游信号分子的传递需要两种单跨膜丝氨酸/苏氨酸受体(Ⅰ、Ⅱ型受体)及Smads蛋白的参与[7]。已经报道,激活TGE-β信号,可以引起肝脏和肾间质细胞增殖,促进纤维化发生,阻断细胞TGE-β信号,将延缓肝和肾硬化的发生,其分子机制为调节前胶原和结缔组织生长因子的表达,促进成纤维细胞的增殖和表型转化,促进细胞外基质的分泌和沉着[8-9],提示TGE-β在间质细胞增生中发挥着重要作用。此外,大量研究报道,激活上皮细胞的TGE-β将促进上皮细胞增殖,促进上皮间质化改变,说明TGE-β在上皮和间质的增殖中发挥着不可或缺的作用。
我们首先从肺脏微环境着手,建立能模拟体内环境的上皮间质共培养体系。结果发现,肺上皮细胞在PQ处理后可以明显增加TGE-β表达,但大剂量PQ可以减少TGE-β分泌可能与上皮细胞死亡有关。上皮细胞分泌的TGE-β是促进间质细胞的重要源动力,阻断上皮细胞TGE-β将可能从源头上阻止间质细胞的增生的启动,具有重要的临床意义。我们部分研究结果与LANG等[10]研究结果类似,其研究显示PQ作用于人肺成纤维细胞MRC-5后,TGE-β1水平显著升高。
本实验通过建立体外上皮和间质细胞共培养体系,提出了PQ可诱导肺间质细胞增生依赖上皮TGE-β信号,阻断TGE-β信号将抑制间质细胞介导的肺纤维化。本研究对PQ致肺纤维化的治疗提供了新的思路。
[1]GAWARAMMANA IB,BUCKLEY NA.Medical management of paraquat ingestion[J].Br J Clin Pharmacol,2011,72:745-757.
[2]GONG P,LU Z,XING J,et al.Traditional Chinese medicine xuebijing treatment is associated with decreased mortality risk of patients with moderate paraquat poisoning[J].PLoS One,2015,10(4):e0123504.
[3]高烨,赵娜,李晓青,等.百草枯诱导肺上皮细胞上皮间质转化促进肺纤维化[J].临床和实验医学杂志,2014,13(18):1491-1493.
[4]孙文铸,毕黎琦.大鼠肺纤维化形成过程中IGF-I和TGF-β1的表达[J].吉林大学学报:医学版,2007,33(2):231-234.
[5]杨俊玲,吴艳峰,董春玲,等.肺纤维化小鼠肺泡灌洗液及肺组织中IL-10和TGF-β1的动态表达[J].吉林大学学报:医学版,2005,31(4):536-538.
[6]彭海兵,曹福源,王建行,等.槲皮素对硅肺纤维化大鼠肺组织TGF-β1、磷酸化P38 MAPK表达及血清TNF-α水平的影响[J].郑州大学学报:医学版,2014,49(5):711-715.
[7]MATSUZAKI K.Smad phospho-isoforms direct context-dependent TGF-βsignaling[J].Cytokine Growth Factor Rev,2013,24(4):385-399.
[8]SHEPPARD D.Epithelial-mesenchymal interactions in fibrosis and repair.Transforming growth factor-βactivation by epithelial cells and fibroblasts[J].Ann Am Thorac Soc,2015,Suppl 1:S21-3.
[9]MENG XM,TANG PM,LI J,et al.TGF-β/Smad signaling in renal fibrosis[J].Front Physiol,2015,6:82.doi:10.3389/ fphys.2015.00082.
[10]LANG YD,CHANG SF,WANG LF,et al.Chymase mediates paraquat-induced collagen production in human lung fibroblasts[J].Toxicology Letters,2009,193:19-25.
(编辑 卓选鹏)
Paraquat-induced proliferation of pulmonary stroma fibroblast cells
depends on epithelial cell TGF-βsignaling
GAO Ye,LI Xiao-qing,WU Meng-ru,LIANG Huan
(Department of Emergency,the Eirst Affiliated Hospital of Xi'an Jiaotong University Health Science Center,Xi'an 710061,China)
Objective To investigate the paraquat(PQ)-induced proliferation of stroma fibroblast cells and dissect the mechanisms of epithelial cells'role in the lung microenvironments.Methods HEL299 cell IC50 was determined by MTT assay.TGF-βwas assayed by ELASA.The TGF-βm RNA and protein expressions were also assayed by real-time PCR and Western blot in HPAEpiC-HEL299 cells co-cultured system following paraquat treatment.Results PQ IC50 cutoff in HEL299 cells was 210.3μmol/L.Compared with DMSO control group,PQ could induce the proliferation of lung stroma fibroblast HEL299 cells,which was dependent on the signaling of epithelial HPAEpiC cell TGF-β.However,inhibition of TGF-βsignaling by si RNA or specific antibody abolished PQ-mediated HEL299 cell proliferation.Conclusion PQ's promoting the proliferation of human lung stroma cells depends on the signaling of epithelial cell TGF-β.Our conclusion provides a new mechanism for PQ-induced pulmonary fibrosis and blocking epithelia TGF-βsignaling will be a potential therapeutic target for PQ toxicity.
paraquat;pulmonary fibrosis;transforming growth factor-β(TGF-β)
R595
A
10.7652/jdyxb201505009
2015-02-28
2015-05-28
陕西省自然科学基金资助项目(No.2013JM4069)Supported by the Natural Science Eoundation of Shaanxi Province(No.2013JM4069)
高烨.E-mail:xiaogaoego@163.com
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20150717.1723.014.html(2015-07-17)
