基于单壁碳纳米管修饰电极测定贝诺酯片剂中贝诺酯的含量
2015-06-23孔粉英李金燕
孔粉英,吕 遥,李金燕,陆 燕,王 伟
(1.盐城工学院 化学化工学院,江苏 盐城 224051;2.上海红双喜有限公司,上海 200070)
基于单壁碳纳米管修饰电极测定贝诺酯片剂中贝诺酯的含量
孔粉英1,吕 遥2,李金燕1,陆 燕1,王 伟1
(1.盐城工学院 化学化工学院,江苏 盐城 224051;2.上海红双喜有限公司,上海 200070)
运用循环伏安法研究了贝诺酯在单壁碳纳米管修饰电极上的电化学行为。在B-R缓冲溶液(pH 5.0)中,贝诺酯于1.10 V ( vs . SCE)电位处有一个峰形很好的氧化峰。与裸玻碳电极相比,贝诺酯在修饰电极上的电位正移了约30 mV,峰电流增加了近5倍。在最佳的实验条件下,贝诺酯的氧化峰电流与其浓度(2.8×10-6~1.4×10-4mol/L)呈现出良好的线性关系,检出限为4.8×10-7mol/L。该方法用于实际样品贝诺酯片剂的检测中,结果令人满意。
单壁碳纳米管;贝诺酯;化学修饰电极;电化学测定
贝诺酯(benorilate)[2-乙酰氧基苯甲酸对乙酰氮基苯酯]又名扑炎痛、苯乐莱、解热安,是非甾体类解热镇痛药,环氧酶抑制剂[1],结构式如图1所示。它把扑热息痛和阿斯匹林二者结合为一体,既具有阿司匹林的解热镇痛抗炎作用,又保持了扑热息痛的解热作用,并且还克服了它们副作用较大的缺点[2],在临床上应用很广。
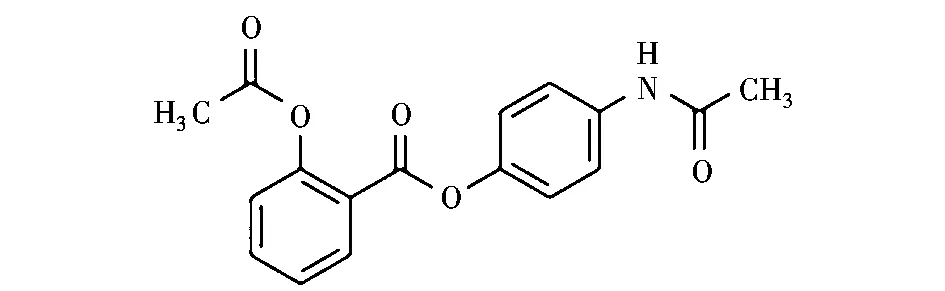
图1 贝诺酯的结构式Fig.1 Structural formula of benorilate
有关贝诺酯的测定方法,文献报道的很少。迄今为止,主要有分光光度法[3-4]和高效液相色谱法[5-7]。王成胤等[8-9]基于贝诺酯的电化学活性分别在碳糊电极和纳米银修饰的碳糊电极上测定了药物中贝诺酯的含量,但是由于电活性物质在碳糊电极上容易脱落,故稳定性和重现性不好。本文尝试了用单壁碳纳米管修饰电极来研究贝诺酯的电化学行为。碳纳米管修饰电极将碳纳米管的优良性能与化学修饰电极的优点结合起来,能显著降低反应物的过电位和检测限,增大反应物的响应电流,是一种理想的电极修饰材料[10]。实验中,我们发现单壁碳纳米管修饰电极对贝诺酯的氧化具有明显的电催化作用,大大地提高了贝诺酯的氧化峰电流。接着我们优化了影响贝诺酯氧化峰电流测定的各种因素,建立了一种简单、快速、灵敏测定贝诺酯片剂中贝诺酯的新方法。
1 实验部分
1.1 仪器和试剂
LK98BII电化学工作站(天津兰力科化学电子高技术有限公司);三电极体系:单壁碳纳米管修饰或者裸玻碳电极作为工作电极,铂丝作为对电极,饱和甘汞电极(SCE)作为参比电极;KS-300D型超声波清洗器(宁波科生仪器厂);pHS-3C型数字酸度计(杭州东星仪器设备厂)。贝诺酯(上海顺勃生物工程技术公司)溶于无水乙醇配制成1.0×10-3mol/L的标准溶液,使用时用水逐级稀释至所需浓度;N,N-二甲基甲酰胺(DMF);0.04 mol/L B-R(磷酸、硼酸和醋酸混合液)缓冲溶液;单壁碳纳米管(中国科学院成都有机化学所);其它试剂均为分析纯,所有试剂均未经纯化;实验用水为二次蒸馏水。
1.2 修饰电极的制备
首先将玻碳电极依次用粒径为0.3 μm和0.05 μm的Al2O3在抛光绒布上打磨,接着分别放入到无水乙醇和二次蒸馏水中超声清洗5 min,自然晾干备用;然后在10 mL的DMF溶液中加入5 mg羧基化后的单壁碳纳米管,超声振荡40 min,使单壁碳纳米管均匀分散在DMF溶液中;最后用微量进样器移取15 μL该分散液于抛光的玻碳电极表面,置于红外灯下,待溶剂完全挥发后即可制得单壁碳纳米管修饰电极。
1.3 电化学测试
准确移取10 mL B-R缓冲溶液到电解池中,然后将单壁碳纳米管修饰玻碳电极放入到该缓冲溶液中,进行多次的循环伏安扫描,直到得到稳定的循环伏安曲线;然后在此缓冲溶液中加入一定体积的贝诺酯标准溶液,记录其伏安曲线,测量1.10 V处的氧化峰电流。每次测定完成后,把修饰电极放在空白缓冲溶液中进行多次的循环伏安扫描,用以除去吸附在修饰电极表面的贝诺酯。
2 结果与讨论
2.1 贝诺酯的电化学研究
首先,我们采用循环伏安法考察了贝诺酯(1.0×10-5mol/L)在不同电极上的电化学行为,如图2所示。贝诺酯在裸玻碳电极上(曲线a)出现一个灵敏度不高的氧化峰,峰电位为1.08 V;经过单壁碳纳米管修饰后,出现了显著的氧化峰(曲线c),峰电位位于1.10 V。相比裸玻碳电极峰电位正移了近30 mV,而且峰电流显著增加,说明单壁碳纳米管加速了贝诺酯和电极间的电子传递速率,对贝诺酯有较强的电催化作用;在阴极化扫描过程中,没有相应的还原峰出现,说明贝诺酯在单壁碳纳米管修饰电极上的电极反应是一个完全不可逆过程。曲线2b为单壁碳纳米管修饰电极在空白的B-R缓冲溶液中的循环伏安图。由图2b可以看出,该修饰电极在空白的B-R缓冲溶液中没有任何的电化学响应。同裸电极相比,背景电流较大。背景电流大是由于单壁碳纳米管修饰到电极后增大了电极表面积。另外贝诺酯的氧化峰电流随扫描次数的增加从第2圈起明显降低,最后趋于稳定,这说明反应物或产物在修饰电极表面发生了吸附。本文以贝诺酯第1圈的氧化峰电流为测定信号。
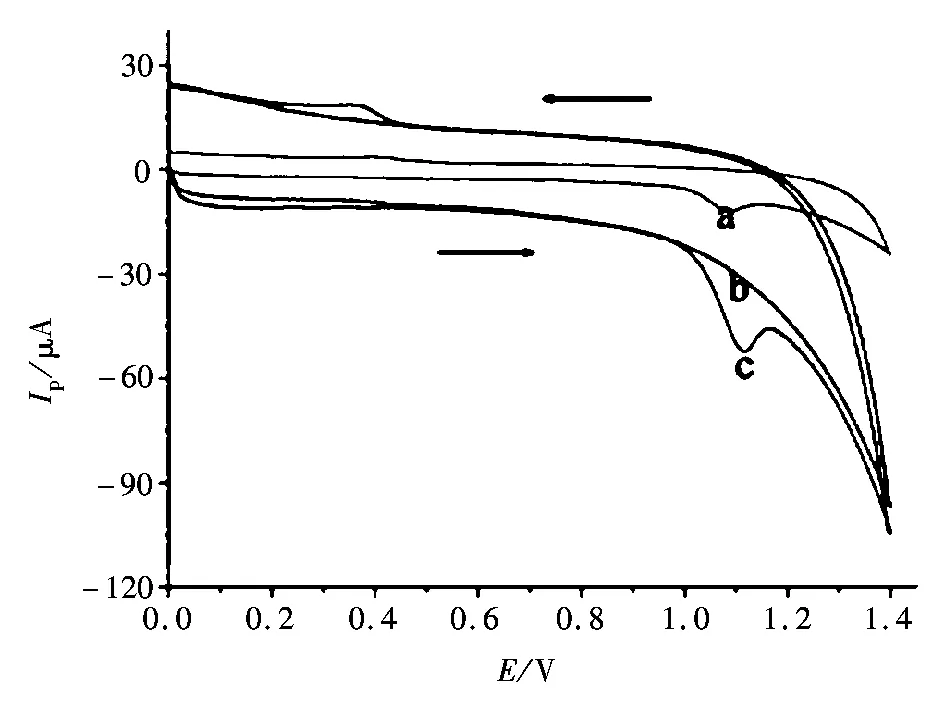
图2 贝诺酯在不同修饰电极上的循环伏安图Fig.2 Cyclic voltammograms of benorilate at different modified electrodes
2.2 最佳条件的选择
2.2.1 支持电解质的选择
本实验比较了贝诺酯在KCl、H2SO4、HAc、H3PO4、NaOH以及各种不同pH值的缓冲溶液中的电化学响应,如pH 3.5~5.6的0.1 mol/LNaAc-HAc缓冲溶液、pH 5.0~8.0的0.1 mol/L Na2HPO4-NaH2PO4缓冲溶液、pH 8.0~11.0的0.1 mol/L NH3-NH4C1缓冲溶液、pH 1.0~5.0的0.1 mol/L酒石酸-NaOH缓冲溶液以及pH 2.0~12.0的0.04 mol/L B-R缓冲溶液。结果表明贝诺酯在0.04 mol/L B-R缓冲溶液中氧化峰峰电流较高、峰型较好,而且背景电流较低,所以在接下来的实验中选取的支持电解质为0.04 mol/L B-R缓冲溶液。
2.2.2 pH值的影响
在pH 3.0~9.0的B-R缓冲溶液中,用循环伏安法研究了pH值对贝诺酯氧化峰电流影响,如图3所示。由图3可知,贝诺酯的氧化峰电流先随pH值的增大而显著增加,在pH值为5.0时达到最大值;随后随pH的增大而缓慢降低,且峰形变差。故选择pH 5.0的B-R缓冲溶液作为分析体系。
至于氧化峰电位Ep,则随pH值的增大而逐渐负移。在pH 为3.0~9.0时,Ep与pH呈现良好的线性关系(如图4所示),线性方程为Ep(V)=1.240-0.030 1 pH (r=-0.989 7),表明氢离子参加了贝诺酯的电极反应。

图3 B-R缓冲溶液的pH对贝诺酯氧化峰电流的影响Fig.3 Effect of B-R buffer solution pH on the oxidation peak current of benorilate

图4 B-R缓冲溶液的pH对贝诺酯氧化峰电位的影响Fig.4 Effect of B-R buffer solution pH on the oxidation peak potential of benorilate
2.2.3 碳纳米管用量的影响
贝诺酯氧化峰电流与单壁碳纳米管分散液用量(即膜厚)的关系,如图5所示。当用量小于15 μL时,随着单壁碳纳米管分散液用量的增加,贝诺酯的氧化峰电流逐渐增大;当单壁碳纳米管分散液的用量由15 μL增加到18 μL时,贝诺酯的氧化峰电流变化不大;当单壁碳纳米管分散液的用量超过18 μL,贝诺酯的氧化峰电流逐渐降低。上述现象的机理是:分散液用量较少时,单壁碳纳米管吸附的贝诺酯的量较少,峰电流较低;当分散液用量较多(超过18 μL)时,尽管膜变厚了,但是电极的有效面积很难进一步增加,相反,由于部分碳纳米管易于从电极表面脱落而使膜变得不稳定,故峰电流反而降低。因此实验中单壁碳纳米管分散液的用量为15 μL。
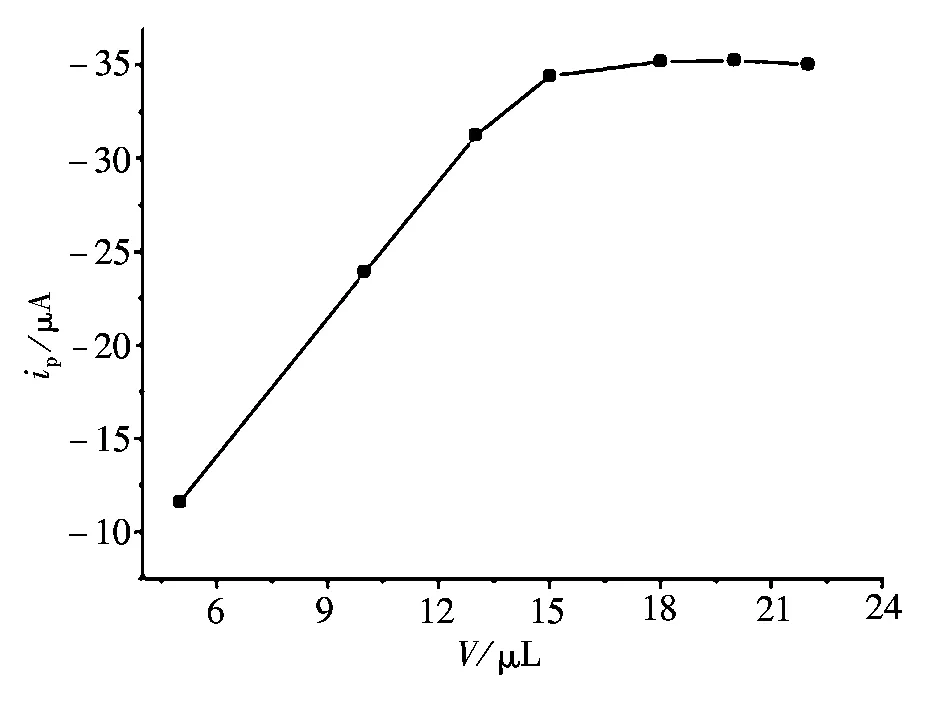
图5 单壁碳纳米管分散液的用量对贝诺酯氧化峰电流的影响Fig.5 Effect of the amount of SWNT suspension on the oxidation peak current of benorilate
2.2.4 扫描速度的影响
在单壁碳纳米管修饰电极上,用循环伏安法研究了扫描速度与贝诺酯氧化峰电流的关系。发现贝诺酯的氧化峰电流随扫描速度的增加而增大,在25~250 mV/s的范围内,贝诺酯的氧化峰电流(ip)与扫描速度(υ)之间呈良好的线性关系(图6),线性方程为:ip(μA)=-16.62-144.2υ(V/s)(r=-0.984 6),表明该电极过程是受吸附控制的。另外,随扫描速度的增大,充电电流也逐渐增大,为了获得较好的信噪比,实验中选择的扫描速度为100 mV / s。
2.3 校准曲线

图6 扫描速度对贝诺酯氧化峰电流的影响Fig.6 Effect of scanning rate on the oxidation peak current of benorilate in B-R buffer
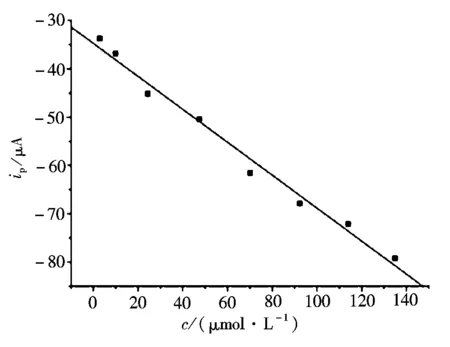
图7 贝诺酯的氧化峰电流与其浓度的关系Fig.7 The relationship of oxidation peak current of benorilate and its concentration
在以上优化的实验条件下,考察了贝诺酯的氧化峰电流与其浓度之间的关系,如图7所示。由图7可以看出,在贝诺酯浓度为2.8×10-6~1.4×10-4mol/L时,贝诺酯的氧化峰电流与其浓度呈现出良好的线性关系,线性回归方程为
ip(μA)=-34.78-0.340 5c(μmol/L)
(R2=0.975 4),检出限为4.8×10-7mol/L。
2.4 干扰实验
在上述体系中,对1.0×10-5mol/L的贝诺酯进行了干扰实验。研究表明100倍的Zn2+、Cu2+、Mg2+、Ca2+、Fe3+、Al3+、Pb2+、抗坏血酸、葡萄糖几乎不干扰贝诺酯的测定(相对误差﹤5%),说明单壁碳纳米管修饰电极对贝诺酯的测定有很好的选择性。
2.5 稳定性与重现性
将同一支玻碳电极按照同样的修饰方式修饰5次,接着浸入到同样浓度的贝诺酯溶液中,得出贝诺酯的氧化峰电流偏差为3.1%;同一支单壁碳纳米管修饰电极在5份相同浓度的贝诺酯溶液中测定,5次测定的峰电流偏差很小;同一支玻碳电极每天重复测定3次,15 d后,贝诺酯的氧化峰电流下降了6.8%。
2.6 样品分析
将10片贝诺酯片剂(湖南汉森制药有限公司,标示量0.5 g/片)研细,混匀后准确称取适量(相当于贝诺酯0.5 g),用无水乙醇溶解定容至100 mL,静置12 h后取上层清液进行测定。对样品进行6次平行测定,平均值为0.49 g/片,与标示值0.5 g/片(高效液相色谱测定)相近,相对平均偏差为4.0%。用标准加入法测定回收率,结果见表1。由表1可知,平均回收率为101.4%。

表1 贝诺酯回收率的测定(n=6)
3 结论
以单壁碳纳米管修饰电极为工作电极,系统地研究了贝诺酯在B-R缓冲溶液中的电化学行为。考察了影响峰电流的各种因素,在最佳的实验条件下,贝诺酯的氧化峰电流与其浓度(2.8×10-6~1.4×10-4mol/L)呈现出良好的线性关系,检出限为4.8×10-7mol/L。本文建立的在单壁碳纳米管修饰电极上测定贝诺酯的方法有较高的选择性、稳定性和重现性,可用于实验样品贝诺酯片剂的测定中。
[1] Day O R, Graham G G, Williams K M, et al. Clinical pharmacology of non-steroidal anti-inflammatory drugs[J].Pharmacol. Ther. , 1987,33(2-3):383-433.
[2] Martindale. The Extra Pharmacopocia[M].26th ed. London:the pharmaceutical Press,1977:188-189.
[3] Chen Z D, Du K R, Zeng J Z, et al. Study on relation of dissolution of benorilate tablets with drug concentration in human plasma[J].Chin. J. Pharm. Anal., 2002, 22(1):55-56.
[4] 吕红.红外分光光度法鉴别贝诺酯片[J].黑龙江医药, 2008,21(5):4-5.
[5] 张蕾,马晶,张云婷,等.HPLC 测定贝诺酯片的含量[J].华西药学杂志,2009,24(6):657-658.
[6] 陈庆先,朱 晶,刘鹏飞.HPLC法测定小儿贝诺酯散中贝诺酯的含量[J].中国医药指南,2011,9(29):236.
[7] 陈莹,莫连峰,唐宁.HPLC法测定贝诺酯片的含量[J].西北药学杂志,2008,23(5):261-262.
[8] Wang C Y, Hu X Y, Chen Q, et al. Differential pulse voltammetry for determination of benorilate in pharmaceutical formulations at carbon paste electrode[J].Anal. Lett., 2005,38(5):861-873.
[9] Wang C Y, Hu X Y. Determination of benorilate in pharmaceutical formulations and its metabolite in urine at carbon paste electrode modified by silver nanoparticles[J].Talanta, 2005,67(3):625-633.
[10] Wang T, Fu Y C, Bu L J, et al. Facile Synthesis of prussian blue-filled multiwalled carbon nanotubes nanocomposites: Exploring filling/electrochemistry/mass-transfer in nanochannels and cooperative biosensing mode[J].J. Phys. Chem. C, 2012,116(39):20 908-20 917.
(责任编辑:孙新华)
启 事
本刊已入编《中国学术期刊(光盘版)》、“中国期刊网”、“万方数据——数字化期刊群”、《中国科技期刊数据库》、《美国化学文摘》和《CEPS华艺中文电子期刊》,作者著作权使用费在本刊稿酬中一并给付(另有约定者除外)。对此不同意者,请在来稿时说明。
Determination of Benorilate in Benorilate Tablets by Single-wall Carbon Nanotube-modified Electrode
KONG Fenying1, LÜ Yao2, LI Jinyan1, LU Yan1, WANG Wei1
(1.School of Chemistry and Chemical Engineering, Yancheng Institute of Technology, Yancheng Jiangsu 224051, China;2.Shanghai Double Happiness Co., Ltd, Shanghai 200070, China)
The electrochemical behaviors of benorilate at single-wall carbon nanotabes (SWNTs)-modified glassy carbon electrode (GCE) have been investigated by cyclic voltammetry. At the SWNTs-modified GCE, benorilate yields a well-defined oxidation peak at 1.10 V (vs. SCE) in a Britton-Robinson (B-R) buffer solution (pH 5.0). Compared with the bare GCE, the peak potential shifted positively about 30 mV, and the peak current increased 5 times. Under the optimal conditions, the oxidation peak current of benorilate is linear with its concentration in the range of 2.8×10-6~1.4×10-4mol/L, and the detection limit is 4.8×10-7mol/L. The proposed method has been applied to the determination of benorilate in drug tablets, and the results are satisfied.
Single-wall carbon nanotube; Benorilate; Chemically modified electrode; Electrochemical determination
10.16018/j.cnki.cn32-1650/n.201504001
2015-09-12
孔粉英(1979-),女,河北邢台人,讲师,博士,主要研究方向为新型功能纳米材料的合成及其生物传感。
R927.2
A
1671-5322(2015)04-0001-05
