基于多模态MRI的AD分类模型
2015-06-23陈俊杰
武 政,相 洁,梁 红,曹 锐,陈俊杰
(太原理工大学 计算机科学与技术学院,太原 030024)
基于多模态MRI的AD分类模型
武 政,相 洁,梁 红,曹 锐,陈俊杰
(太原理工大学 计算机科学与技术学院,太原 030024)
利用多模态磁共振成像数据,构建静息态功能网络,提取了网络属性及结构像中萎缩灰质的灰质体积作为分类特征,训练SVM分类器。实验结果表明,利用结构和功能组合特征,可以区分MCI与正常对照(准确率91.7%),AD与正常对照(准确率100%),AD与MCI(准确率87.8%),有效提高了两类疾病的分类正确率。结果说明提出的分类模型是一种较好的辅助诊断模型。
结构MRI;功能MRI;静息态脑功能网络;阿尔兹海默症;分类
阿尔兹海默(Alzheimer′s Disease,AD)是老年期常见的慢性精神衰退性疾病,发病率较高,到2050年时预估全球每85人就有一人罹患本病[1]。AD现有药物治疗非常有限,但早期发现、治疗能减缓疾病进程。轻度认知障碍(Mild Cognitive Impairment,MCI)是介于正常老化和AD之间的过渡阶段,患者存在记忆或其它认知障碍,但达不到痴呆的诊断标准[2]。研究表明,约44%的MCI患者在3年后转化为AD,平均年转化率为15%[1],而正常老年人每年仅1%~2%发展为AD[2]。由于AD不可逆转,因此对MCI患者的临床前预警和早期干预治疗尤为重要。
目前,AD、MCI 的诊断方法主要包括:神经心理学测试、神经影像学检查、脑脊液检查等。磁共振成像(Magnetic Resonance Imaging,MRI)检查已经逐渐成为一种主要的检查方式,其中,结构影像学(structural MRI,sMRI)和功能影像(functional MRI,fMRI)学检查应用尤为广泛。由于静息态fMRI技术能够反映大脑自发的功能活动,有助于探讨脑区间自发活动的同步性以及大脑中存在的自发功能神经网络,基于静息态fMRI构建的脑功能网络可以从全脑角度研究和理解阿尔茨海默病疾病的病理机制,研究结果表明AD患者脑功能网络的拓扑性质发生了异常变化。结构影像学检查也表明,与正常人相比,MCI患者存在海马和内嗅皮层萎缩。但是,目前影像学检查大多依赖医生的经验,工作量大,且不能充分发掘图像中蕴含的丰富信息,利用机器学习算法提取静息态功能网络异常拓扑属性以及sMRI异常灰质体积等特征,建立阿尔茨海默病的辅助诊断模型,将有助于改善目前诊断工作量大的现状。
神经影像学研究表明AD、MCI患者存在海马、颞叶、前额等部分脑区的结构改变或认知功能改变,许多研究均发现双侧海马、杏仁体及内嗅皮层、颞叶沟间距、后扣带回和丘脑的结构或功能异常。与正常对照组相比,MCI、AD患者在完成记忆任务时内侧颞叶激活下降,但在记忆编码时其右侧海马旁回的激活程度增加[3-6],完成视觉记忆任务时较正常老年对照组所激活的功能区明显增多,多分布于右侧额上回、双侧颞中回、额中回及双侧扣带回的前部,并且MCI组较AD组右侧海马旁回、右侧豆状核、右侧梭状回、左侧额下回、左侧缘上回及双侧扣带回的激活区增多。这些研究均表明AD、MCI的认知受损非少数几个脑区受损导致,属于弥漫性脑疾病。近年来,不少研究人员通过构建大脑结构或功能网络,并采用图论的方法分析脑网络的全局特性与节点特性,依此来探索脑网络中的关键脑区和关键通路异常的变化规律[7-8]。
文章将在已有研究的基础上,利用sMRI、fMRI多模态磁共振数据,通过构建静息态脑功能网络,提取异常的网络节点属性,同时基于体素形态学方法(Voxel Based Morphometry,VBM)提取感兴趣区的灰质体积作为特征,训练SVM分类器,构建AD、MCI的辅助诊断模型。
1 研究方法
采用技术路线如图1所示,AD、MCI的分类模型采用结构和功能两类分类特征,一方面基于VBM提取感兴趣区域的灰度体积;另一方面通过fMRI数据构建静息态脑功能网络,计算网络局部和全局属性,并筛选存在显著差异脑区的节点属性作为功能影像特征。

图1 阿尔茨海默症与轻度认知障碍分类模型
1.1 被试
采用入组标准较严格的ADNI数据集(Alzheimer′s Disease Neuroimaging Initiative,ADNI)[9]。该数据集包括MCI、AD、正常对照(Normal Control,NC)等多组数据。各组被试的入组标准如下:
1)NC。简易智能精神状态检查量表(Mini-Mental State Examination,MMSE)得分介于24~30,临床痴呆评定量表(Clinical Dementia Rating,CDR)得分为0,非抑郁,非MCI,非痴呆。
2)EMCI被试。MMSE得分介于24~30,CDR为0.5,韦氏记忆量表(Wechsler Memory Scale Logical Memory I)得分9~11。
3) AD被试。MMSE得分介于22~26之间,CDR为0.5或1.0,符合NINCDS/ADRDA标准。
参与本研究的被试为符合上述标准且均来源于ADNI同一次扫描,同时具有fMRI和sMRI影像数据,并且有简明精神量表(Mini-mental State Examination,MMSE)得分的被试。被试的基本情况如表1所示。
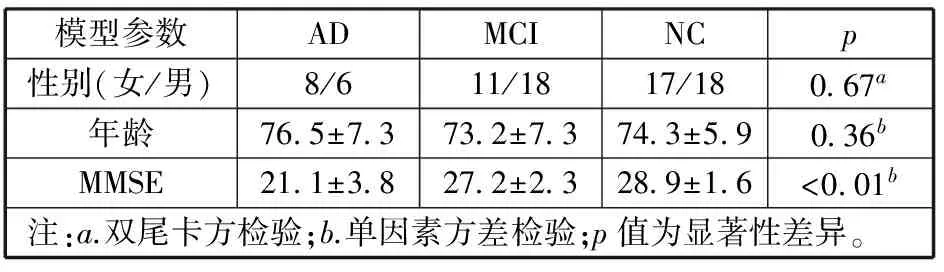
表1 fMRI实验中被试的基本情况
1.2 数据预处理
fMRI数据的预处理使用DPARSF[9]进行,首先对数据集进行时间片校正和头动校正,所有被试的水平头动均小于2 mm且转动小于2度。接着对头动校正后的图像进行空间标准化,将其标准化到3 mm体素的MNI标准空间中。最后进行低频滤波(0.01~0.08 Hz),以降低低频漂移及高频的生物噪音。
sMRI数据预处理采用REST进行,预处理过程包括空间标准化,脑组织分割和平滑(平滑核为8 mm),利用统计参数检验方法对每一个体素做统计检验,并对这些体素进行解剖学定位。采用方差检验等方法对被试进行组间统计分析,根据统一阈值和体素数,得到组间灰质密度或体积的差异区域。
1.3 构建脑功能网络
采用AAL模板[10],将全脑分割为90个脑区(左右半脑各45个),每个脑区被定义为网络中的一个节点。计算同一个脑区中所有体素的平均时间序列作为该区域的时间序列,对于所得到的每个脑区时间序列,计算两两之间的偏相关系数,得到90×90的关联矩阵。
通常,根据设定的阈值,将关联矩阵转化为二值的邻接矩阵,也就是说当节点i和节点j的偏相关系数大于某一特定阈值时,矩阵元素aij的值为1,表示节点i和j之间存在连接,否则aij的值为0。但是如果四组被试设置相同的相关系数阈值,则会造成每组被试网络中边的数量不一致,网络规模也就不一致,在此基础上进行网络属性和节点属性的分析是没有意义的。因此,大多数研究均采用稀疏度S来确定节点之间是否建立边,使不同被试的脑网络具有相同的规模。其中S是指网络中实际存在的边数与网络中可能存在的最大边数(设为N)的比值。本研究中采用在相同稀疏度下对比NC、MCI、AD的脑网络。具体方法为,设定稀疏度阈值之后,将关联矩阵的相关系数递减排序,如节点i与节点j之间的相关系数在(S×N)个之前,则在节点i与节点j建立一条单向边。由于目前没有单个稀疏度阈值设置的黄金标准,稀疏度范围的选取不同的研究者选取的结果有所不同。本研究的稀疏度选取范围为8%~30%,间隔0.01。
1.4 网络统计特征及分析
常用的脑网络节点属性包括节点度、节点中心度、节点效率等指标。无向无权脑网络G(N,K)中的节点属性描述如下,其中N表示网络中的节点总数,K表示边数。
1)节点度。节点i的度定义为与该节点相连的边的数目,反映了该节点与网络G中其他节点之间的关系,也体现了该节点在网络中的地位和作用,其公式可表示为式(1),
(1)
式中:aij表示网络中第i个节点与第j个节点之间的连接数。
2)节点中间中心度。节点i的中间中心度定义为网络中所有的其它节点对之间最短路径中通过该节点的最短路径数,反映了节点i在网络中的重要性,具有高中间中心度的节点是网络中的信息交流枢纽,其公式可表示为式(2),
(2)
式中:σmn表示节点m和n之间的最短路径数;σmn(i)表示节点m到n经过的最短路径数。
3)节点效率。节点i的效率定义为该节点与网络中其他节点的最短路径的调和平均数,衡量一个节点对网络中其他节点的信息传播的能力,其公式可表示为式(3),
(3)
式中:dij表示节点i和j之间的最短路径长度,反映了该节点到网络中其他节点的难易程度。
1.5 分类器训练与测试
采用单因素方差分析方法,取p<0.001为差异有统计学意义,10个相邻体素为体素阈值,分析患者灰质萎缩的区域,提取这些区域的灰度体积作为结构影像数据的分类特征。对每个节点属性的不同稀疏度下的平均值AUC进行K-S检验,具有显著差异(p<0.05)的脑区的AUC值作为功能影像数据的分类特征。
文中先采用SVM算法,利用网格算法进行参数寻优获得最佳分类准确率,再用5折交叉验证,将数据样本随机分成5份,其中一份作为测试集,剩余4份作为训练集。重复5次,将最后得到的平均准确率,作为分类模型的分类准确率。
2 结果
2.1 患者灰质萎缩的区域及灰质体积
方差检验结果表明AD、MCI的右侧海马、右侧颞中回、右侧颞下回、右侧梭状回、左侧颞中回、左侧颞下回、左侧海马区域存在显著的组间差异(图2为这些区域的灰质体积)。结果表明,随着病情的加重,除双侧楔前叶外,大部分区域都呈现灰质体积减小的趋势。
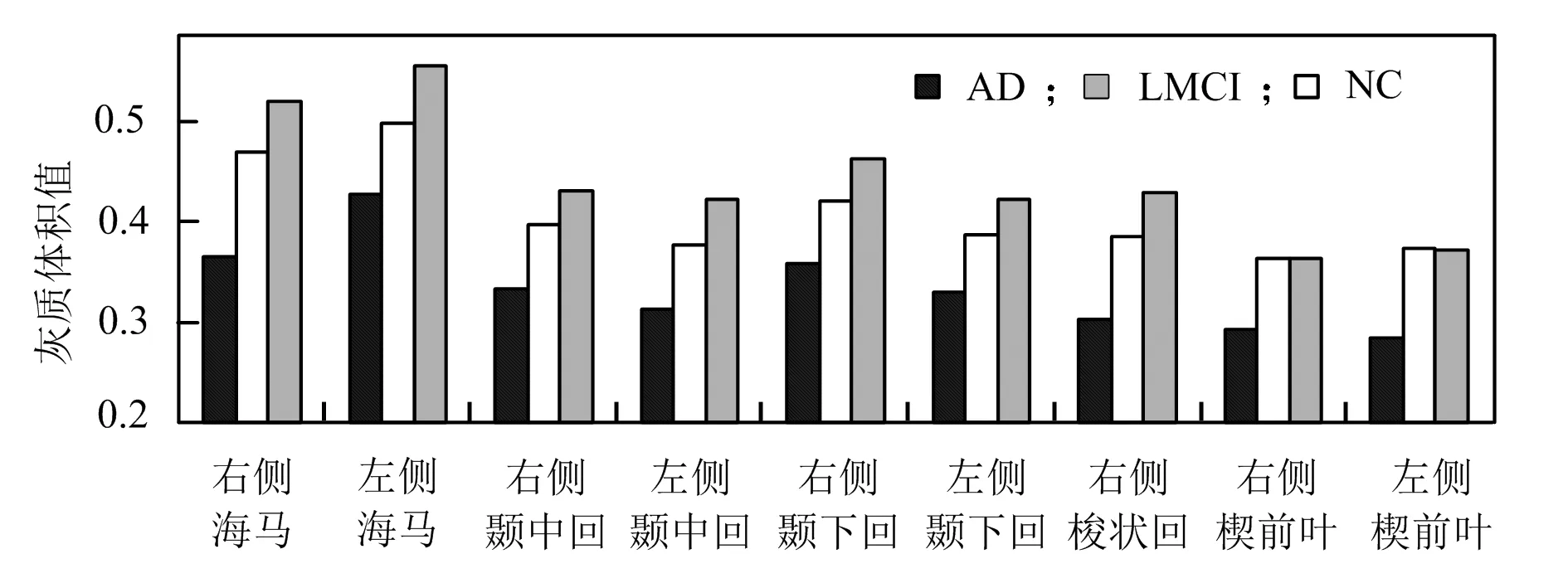
图2 AD、MCI患者灰质萎缩区域及灰质体积
2.2 患者脑功能网络中的异常节点
对比正常老年人与MCI患者脑网络中各脑区的节点属性,发现颞横回(HES)、枕上回(SOG)、顶下缘角回(IPL)、前扣带和旁扣带脑回(ACG)、回直肌(REC) 、楔前叶(PCUN)、眶部额中回(ORBmid)等脑区的节点中心度在多个网络稀疏度下均存在显著差异(p<0.05),颞横回(HES)、枕上回(SOG)、顶上回(SPG)等脑区的节点效率在多个网络稀疏度下均存在显著差异(p<0.05);相对于EMCI,LMCI患者的三角部额下回(IFGtriang)、嗅皮质(OLF) 等脑区的节点中心度在多个网络稀疏度下均存在显著差异(p<0.05),三角部额下回(IFGtriang)、眶部额下回 (ORBinf) 等脑区的节点效率在多个网络稀疏度下均存在显著差异(p<0.05);相对于LMCI,AD患者的三角部额下回(IFGtriang)、岛盖部额下回(IFGoperc)、角回(ANG) 等脑区的节点中心度在多个网络稀疏度下均存在显著差异(p<0.05),岛盖部额下回(IFGoperc)、缘上回(SMG)、三角部额下回(IFGtriang)、颞上回(STG) 等脑区的节点效率在多个网络稀疏度下均存在显著差异(p<0.05)。
2.3 分类结果
表2给出了5折交叉验证的SVM训练结果。其结果表明,使用脑网络局部属性进行AD与NC,MCI与NC,AD与MCI的分类正确率分别为70.6%,78.3%,71.4%;加入MMSE量表得分之后,正确率分别为83.9%,80.0%,72.2%,加入结构特征之后,正确率分别为100%,91.7%,87.6%;
如果同时使用结构特征、功能网络特征与MMSE量表,正确率达到100%,91.7%,87.8%。
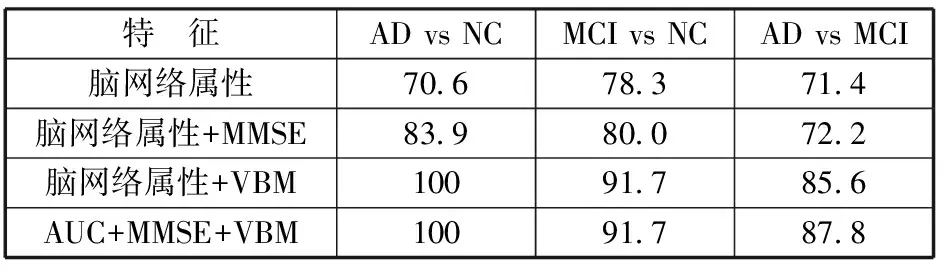
表2 分类结果 %
2.4 结果分析
研究发现AD、MCI的功能与结构都与正常对照存在一些差异,这些差异与已有的研究结论较为一致。图2结果表明AD、MCI的右侧海马、右侧颞中回、右侧颞下回、右侧梭状回、左侧颞中回、左侧颞下回、左侧海马区域的灰度体积值逐渐下降。国内外基于VBM方法的很多研究表明,AD患者和MCI患者在双侧海马存在皮质萎缩[11-12]。AD的病理发展是早期在内嗅皮质、海马旁回和颞顶叶区域发生神经元丢失,然后逐渐蔓延至前脑部区域[13],实验的结果显示AD和MCI在海马区域灰质萎缩最严重,然后是颞叶和额叶,与AD病理改变的范围和发生方式接近。研究中还发现了包括额叶、颞叶、边缘系统和基底节等区域的多个节点的网络拓扑属性存在异常,说明AD、MCI认知功能受损并非由少数脑区受损导致,而是全脑多个脑区均有不同程度的损伤。这些脑区与记忆、听觉、语言、注意力等认知紧密相关,与AD患者认知功能障碍的行为表现是一致,即,AD除明显的记忆障碍外,其他认知功能,如语言、注意力、视空间功能等均有不同程度的受损,其中记忆功能的损伤最为普遍。
3 总结
文中提出了综合提取结构特征和功能特征,并结合MMSE量表的AD、MCI诊断模型。其中,功能特征提取静息态脑功能网络中异常节点属性,结构特征提取右侧海马、右侧颞中回、右侧颞下回、右侧梭状回、左侧颞中回、左侧颞下回、左侧海马等区域的灰质体积。AD与NC,MCI与NC,AD与MCI的分类正确率大于85%,结果说明提出的分类模型是一种较好的辅助诊断模型。
[1] Misra C,Fan Y,Davatzikos C.Baseline and longitudinal patterns of brain atrophy in MCI patients,and their use in prediction of short-term conversion to AD:results from ADNI[J].NeuroImage,2009,44:1414-1422.
[2] Petersen R C,Negash S.Mild cognitive impairment:An overview[J].CNS Spectrums,2008,13(1):45-53.
[3] Bischkopf J,Busse A,Angermeyer MC.Mild cognitive impairment-a review of prevalence,incidence and outcome according to current approaches[J].Acta Psychiatrica Scandinavica,2002,106:403-414.
[4] Wee Chongyaw,Yap Pewthian,Kevin Denny,et al.Resting-state multi-spectrum functional connectivity networks for identification of MCI patients[J].PLOS ONE,2012,7(5):e37828.
[5] 丁 萍,魏文石,嵇 鸣,等.轻度认知障碍和轻度Alzheimer 病海马体积和1H-MRS 对比研究[J].实用放射学杂志,2008,24:1313-1316.
[6] Saka E,Dogan E A,Topcuoglu M A,et al.Linear measures of temporal lobe atrophy on brain magnetic resonance imaging (MRI) but not visual rating of white matter changes can help discrimination of mild cognitive impairment (MCI) and Alzheimer′s disease(AD)[J].Arch of Gerontol and Geriatr,2007,44(2):141-151.
[7] Xie T,He Y.Mapping the Alzheimer′s brain with connectomics[J].Front Psychiatry,2012,2:77.
[8] Wang J,Zuo X,Dai Z,et al.Disrupted functional brain connectome in individuals at risk for Alzheimer′s disease[J].Biol Psychiatry,2013,73(5):472-481.
[9] Yan C G,Zang Y F.DPARSF:a MATLAB toolbox for “Pipeline”data analysis of resting-state fMRI[J].Front Syst Neurosci,2010,4:13.
[10] Tzourio-Mazoyer N,Landeau B,Papathanassiou D,et al.Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain[J].Neuroimage,2002,5(1):273-289.
[11] Aisen P S,Petersen R C,Donohue M C,et al.Clinical Core of the Alzheimer′s Disease Neuroimaging Initiative:progress and plans[J].Alzheimer′s & Dementia,2010,6(3):239-246.
[12] Kaufer D I,Cummings J L,Ketchel P.Validation of the NPI-Q,a brief clinical form of the Neuropsychiatric Inventory[J].Journal of Neuropsychiatry and Clinical Neurosciences,2000,12(2):233-239.
[13] Pfeffer R I,Kurosaki T T,Harrah C H,et al.Measurement of functional activities in older adults in the community[J].Journal of gerontology,1982,37(3):323-329.
(编辑:朱倩)
The AD Classification Model Based on Multimodality MRI
WU Zheng,XIANG Jie,LIANG Hong,CAO Rui,CHEN Junjie
(CollegeofComputerScienceandTechnology,TaiyuanUniversityofTechnology,Taiyuan030024,China)
The multi-modal magnetic resonance imaging data were used to construct rest functional networks,then,the network properties and the gray matter volume of atrophy gray matter in structures images were extracted as the classification feature to train the SVM classifier.Experimental results show that the combination of structural and functional characteristics can differentiate MCI and normal control (accuracy of 91.7%),AD and normal controls (accuracy of 100%),AD and MCI (accuracy of 87.8%),thus effectively improving the classification accuracy rate of two types of diseases.It shows that the classification model described in this paper is an effective diagnosis model.
sMRI;fMRI;resting state functional brain networks;alzheimer′s disease; classification
2014-06-26
国家自然科学基金资助项目:抑郁症fMRI数据分析方法及辅助诊断治疗模型研究(61170136,61373101);山西省自然科学基金资助项目(2011011015-4);北京市博士后工作经费资助项目(Q6002020201201)
武政(1989- ),女,山西孝义人,在读硕士,主要从事人工智能、数据挖掘、脑信息学的研究,(E-mail)wuzheng0208@link.tyut.edu.cn
陈俊杰(1956-),男,教授,博士生导师,(Tel)13803497372
1007-9432(2015)01-0085-04
TP18;TP399
A
10.16355/j.cnki.issn1007-9432tyut.2015.01.017
