杂多酸对燃料电池质子交换膜稳定性的影响
2015-06-19马双春鲁伊恒陈颖冯文权李寒旭
马双春,鲁伊恒,陈颖,冯文权,李寒旭
(安徽理工大学化工学院,安徽淮南232001)
杂多酸对燃料电池质子交换膜稳定性的影响
马双春,鲁伊恒,陈颖,冯文权,李寒旭
(安徽理工大学化工学院,安徽淮南232001)
采用硅烷偶联剂、磷钼酸及硅钨酸对全氟磺酸离子膜进行了表面改性,制备了燃料电池质子交换复合膜。测定了升温速率为5、10、20和30℃/min时的热重曲线及不同温度时膜的质子电导率。实验结果表明,复合膜的热分解过程经历三个阶段,热降解峰温向低温区偏移,并计算了第一和第二阶段的表观活化能。当温度高于363.3℃时,复合膜的热稳定性优于原膜;在-30~0℃和20~90℃区间,原膜与复合膜的质子电导率均随温度的升高而增大,复合膜的质子电导率明显优于原膜。
质子交换膜;杂多酸;表面处理;质子电导率
质子交换膜的低湿度、耐高温和较高的质子电导率是聚合物电解质膜燃料电池(PEMFCs)研究的重要课题[1],目前主要的研究内容有:膜的性能研究[2];制备新型复合膜如磷钨酸改性聚乙烯醇-醋酸乙烯-衣康酸共聚物膜[3];电导率的测定[4-6];SiO2膜改性[7];Nafion复合膜用于提高温度及低湿度的耐久性[8];Nafion掺杂吸水金属颗粒如Nafion-SiO2、Nafion-MZP(多孔磷酸锆)、硫酸磺化Nafion-SiO2复合膜的制备[9];提高膜在高温下的保水能力;寻找可替代水的高沸点物质离子液体,如SPEEK掺杂质子惰性的离子液体1-乙基-3-甲基咪唑乙基硫酸盐制备复合质子交换膜,保证了膜在高温下的质子传导能力;二氧化硅涂覆聚酰胺/Nafion复合膜;Nafion-浮石复合膜、聚乙烯醇-磷酸锆-磷钨酸复合膜、金属氧化物SiO2、TiO2、Al2O3和ZrO2与Nafion乳液制备复合膜等。而杂多酸如磷钼酸及硅钨酸对国产全氟磺酸离子膜的改性及对膜阻抗电导率的影响,鲜有文献报道。为此,本文开展磷钼酸及硅钨酸对国产质子交换膜的改性研究,探讨膜的热稳定性及温度对膜质子电导率的影响,这对于提高质子交换膜的耐久性和质子电导率具有重要的指导意义。
1 实验
1.1 原料与仪器
质子交换膜(全氟磺酸离子交换膜),外观无色透明,厚度80μm,工业合格品;磷钼酸H3[P(Mo3O10)4]·H2O(AR);硅钨酸H4[Si(W3O10)4]·H2O(AR);无水乙醇(AR);偶联剂[KH-570, -(甲基丙烯酰氧)丙基三甲氧基硅烷];去离子水。
1.2 磷钼酸、硅钨酸复合质子交换膜的制备
制备方法:取一定尺寸的质子交换膜,用去离子水洗涤2次,取出用滤纸吸干。将膜于60℃恒温干燥0.5 h。取出膜,浸入乙醇水溶液(体积比为1∶3)中溶胀,30℃恒温水浴30 min后,取出,干燥,备用。分别称取磷钼酸1.825 g(0.01 mol)、硅钨酸2.88 g(0.01 mol)、KH-570 0.496 g(0.02 mol),用适量乙醇溶解、搅拌、混合得混合液。将膜浸入到混合溶液中,30℃恒温3 min后取出,晾干,60℃真空干燥6 h,得复合膜备用。
1.3 热失重分析
磷钼酸、硅钨酸复合膜的TG-DTG(热重-微分热重)测定是在美国TA公司Q5000 V3.15 Build 263型热重分析仪上进行,非等温热失重测定以氧化铝做参比物,气氛为氮气,流量为75 mL/min,升温速率为10℃/min,升温区间250~650℃,试样质量为1.50~2.50 mg。
1.4 阻抗电导率
CHI660D电化学工作站,阻抗频率范围为1~1×106Hz,扰动电压为10 mV。用三电极体系的电化学阻抗仪进行测试,参比电极为饱和甘汞电极,辅助电极为Ag-AgCl电极,工作电极为玻碳电极。
1.5 低温阻抗电导率
0℃阻抗测定:将电解质溶液置于冰浴冷却,直至溶液温度达到0℃左右,分别测定原膜及复合膜的阻抗电导率。-30~0℃阻抗测定:将电解质溶液置于-35℃甲醇浴中冷却,直至溶液温度达到-30℃,分别测定原膜及复合膜的阻抗电导率,测量仪器、电极及电解液等同上。
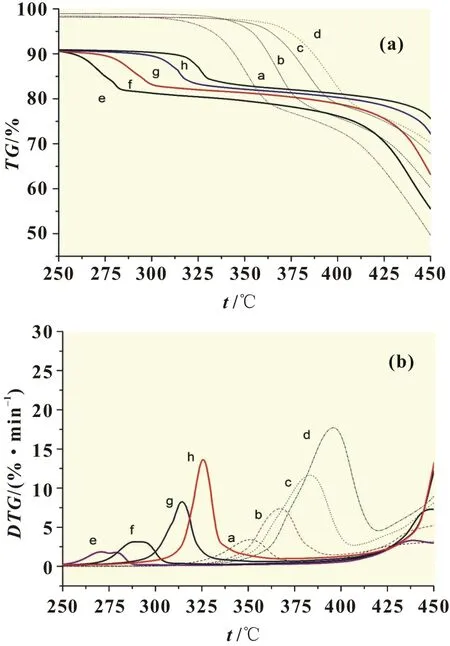
图1 250~450℃时膜的热重曲线

图2 450~650℃时膜的热重曲线
2 结果与讨论
2.1 热稳定性
图1和图2分别为250~450℃及450~650℃时膜的热重曲线,图中a、b、c、d为改性前原膜的热重曲线[2],升温速率分别为5、10、20和30℃/min;e、f、g、h为改性后复合膜的热重曲线,升温速率分别为5、10、20和30℃/min。固体高分子电解质材料可以根据Kissinger方程(式1)和Flynn-Wall-Ozawa方程(简称F-W-O法)(式2),计算动力学参数如表观活化能、指前因子和线性系数[2]:

式中:β为升温速率,℃/min;p为峰温,K;为指前因子,min-1;为8.314 kJ/mol;为表观活化能,kJ/mol。
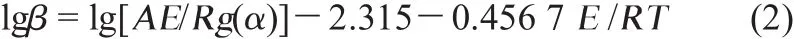
式中:(α)为积分机理函数;为热力学温度,K。

图3 ln(β/p2)与1/p及与α的关系曲线
在Kissinger法中,ln(β/p2)与1/的关系曲线如图3(a)所示。表1为不同升温速率时复合膜的峰温数据,p1、p2和p3分别为第一、第二和第三阶段不同升温速率时的峰温,以该法计算的复合膜,第一和第二阶段的表观活化能分别为76.44和254.38 kJ/mol,线性系数分别为0.997 7和0.999 5,标准方差分别为0.058 84和0.027 88;而在第一和第二阶段,原膜热分解的表观活化能分别为145.16和187.19 kJ/mol[2]。

表1 不同升温速率时复合膜的峰温数据
在F-W-O法中,转化率α不同时lgβ与1/的线性关系如表2所示,表2中第一阶段α=0.10~0.22,第二阶段α=0.23~ 0.35。将复合膜热降解的表观活化能与α作曲线,如图3(b)所示,当α<0.22时,变化较小,可以近似为一个分解阶段;而当α>0.23时,缓慢增加,此时反应处于第二分解阶段;当α为0.45~0.82区间时,反应处于第三分解阶段,此时分解反应与第二阶段部分重叠,是由于磷钼酸、硅钨酸与全氟磺酸离子膜之间强烈的相互作用及复杂反应所致。

表2 F-W-O法复合膜热分解的表观活化能
当α为0.10~0.35时,由F-W-O法计算的的平均值为139.21 kJ/mol;其中在第一阶段复合膜的α为0.10~0.22、温度区间为250~375℃时,由F-W-O法计算的平均表观活化能为77.97 kJ/mol,与Kissinger法计算的结果(76.44 kJ/mol)接近,平均值为77.21 kJ/mol。第二阶段热分解的α为0.23~0.84,温度区间为375~525℃,其中α为0.23~0.35时,由F-W-O法计算的复合膜的平均值为200.45 kJ/mol(见表2),而该阶段Kissinger法计算的值为254.38 kJ/mol,两种方法的平均值为227.42 kJ/mol。在第一阶段复合膜的活化能较原膜小67.95 kJ/mol,这是由于磷钼酸和硅钨酸含有大量结晶水且缓慢释放的缘故,在第二阶段复合膜较原膜大40.23 kJ/mol,推测磷钼酸和硅钨酸高温脱水生成聚偏磷酸、氧化钼、氧化硅、氧化钨及含氟碳化物,阻碍了膜进一步降解[10]。
以β为5℃/min为例,由TG曲线可见,在小于或等于250℃时,原膜最大失重α为0.017,这是由于原膜较为干燥、无水分的缘故,而复合膜热分解的最大失重α为0.096,推测是金属颗粒磷钼酸、硅钨酸带入的结晶水及少量溶剂等溢出的结果,其中释放的水分在100℃之前为物理吸附,在100~250℃之间为化学吸附。
由DTG曲线可见,复合膜在200~350℃区间发生第一分解反应,最大转化率α为0.21;原膜在250~380℃区间发生第一分解反应,最大转化率α为0.24;复合膜分解的峰温为271.2℃,较原膜(352.0℃)低,最大分解速率为1.83%/℃,较原膜(3.44%/℃)小,分解区间与原膜(250~380℃)相比向左偏移。当环境温度超过363.3℃(即复合膜与原膜TG曲线交点)时,复合膜热分解的α小于原膜,即复合膜的热稳定性高于原膜。
复合膜在350~550℃区间发生第二分解反应,最大转化率为0.84,残余物为0.16,推测为氧化硅、氧化钨、聚磷酸及碳化物等;而原膜在380~550℃区间发生第二分解反应,最大转化率为0.96,残余物为0.04,应为碳化物。分解区间与原膜(380~550℃)相比亦向左偏移,复合膜热分解的峰温为437.9及484.2℃,为双头峰,原膜热分解的峰温为476.3℃。复合膜的最大分解速率为3.31及3.25%/℃,原膜为3.75%/℃。
当温度低于363.3℃时,复合膜热分解的α(最大0.21)大于原膜,这可能是复合膜中的结晶水及挥发物溢出及磺酸基脱落的缘故,表明复合膜在此区间的稳定性能不及原膜;当温度超过363.3℃时,复合膜热分解的α小于原膜,此时复合膜的热稳定性高于原膜,推测为磷钼酸及硅钨酸中的聚磷酸及金属氧化物等阻碍了氟碳链进一步降解的结果。
2.2 温度对阻抗谱的影响
从图4(a)原膜的阻抗谱可以看出,20~30℃时Re约3 500~2 500Ω,而在40~70℃时,ZRe在1 300~1 000Ω,可见阻抗变化较小;当环境温度为80~90℃时,Re约800~900Ω,此时温度对阻抗值影响不大。而从图4(b)复合膜的阻抗谱可以看出,在20℃时Re约530Ω,在30~70℃时Re在150~300Ω区间,Re呈逐渐下降趋势;当环境温度为80~90℃时,Re在100~120Ω区间。可见改性后20℃时,复合膜的阻抗仅相当于原膜的1/7,这表明改性后复合膜的阻抗下降明显。

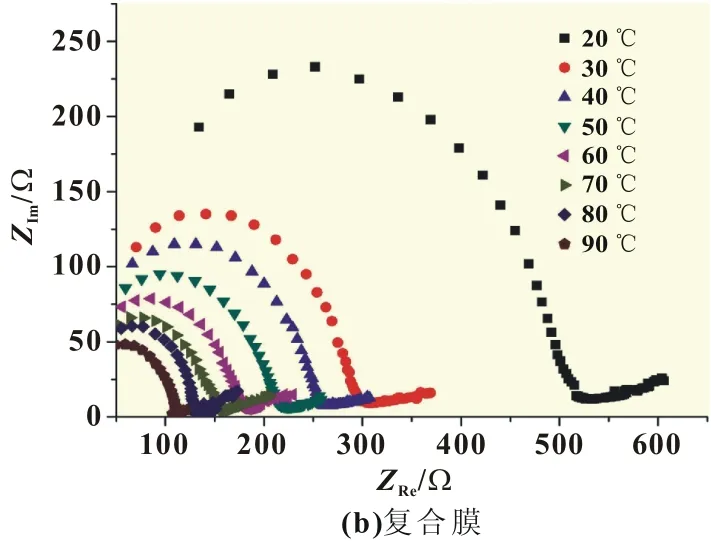
图4 温度对膜阻抗谱的影响
从图5(a)原膜的阻抗谱可以看出,0℃时Re为4 900Ω,在-30℃时Re为10 600Ω。从图5(b)复合膜的阻抗谱可以看出,在0℃时Re约700Ω,在-30℃时Re约1 500Ω;改性后在0和-30℃时,复合膜的阻抗分别为原膜的14.28%和14.15%,可见在低温区复合膜的阻抗较原膜显著降低。
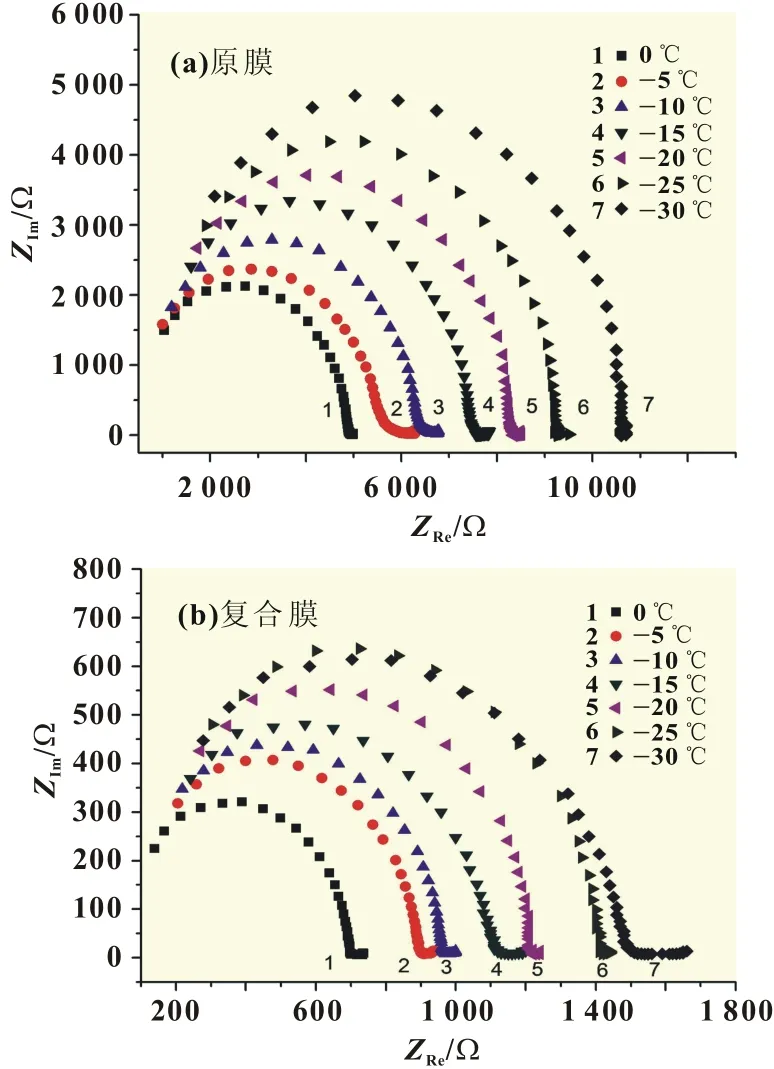
图5 低温对膜阻抗谱的影响
2.3 温度对阻抗电导率的影响
膜的本体电阻值b分别取图4及图5曲线中高频半圆与低频直线交点对应的横坐标值,若测试频率不过高或体系电导率较高时,高频半圆没有出现,b取高频端点的横坐标值,不同温度时样品离子电导率的公式为σ=/b·,式中:σ为质子电导率,S·cm-1;为电解质膜的厚度,cm;b为电解质膜的体积电阻,Ω;为电极和电解质膜的接触面积,cm2。根据以上公式可算出膜的质子电导率。
在-30~0℃时,原膜及复合膜的分别为2.73及2.6 cm2;在20~90℃时,原膜及复合膜的分别为3.45及4.0 cm2。以上测试中原膜及复合膜的分别为80×10-4及121× 10-4cm。
图6和图7分别为20~90℃及-30~0℃区间温度对膜电导率的影响曲线。由图6可以看出,从20℃升至90℃时,随着温度的上升,电导率有逐渐增大的趋势,膜的导电性明显改善,这是由于升高温度有利于提高膜内部的水含量及水分子的热运动,使质子更易于穿过质子膜到达阴极。原膜的电导率从6.71×10-7S·cm-1升至27.0×10-7S·cm-1,复合膜的电导率从57.1×10-7S·cm-1升至275.0×10-7S·cm-1。如图7所示,从-30℃升至0℃时,随着温度的升高,电导率有逐渐增大的趋势,从曲线斜率可见,与图6相比,图7中电导率增加缓慢,这是由于低温区氢质子活性下降的原因。图7中原膜的电导率从2.76×10-7S·cm-1升至5.93×10-7S·cm-1,而复合膜的电导率从31.0×10-7S·cm-1升至67.0×10-7S·cm-1。

图6 20~90℃区间温度对膜质子电导率的影响
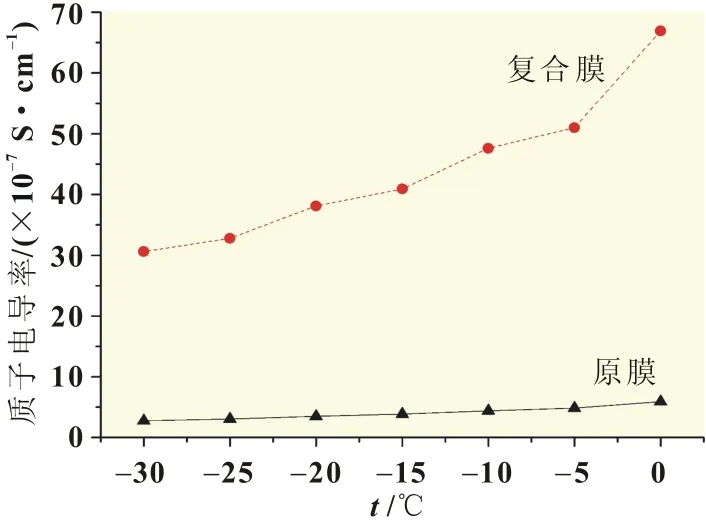
图7 -30~0℃区间低温对膜质子电导率的影响
3 结论
通过磷钨酸及硅钨酸改性复合膜的热重及质子电导率测定,结果表明,复合膜的热降解过程分为三个阶段,第一和第二阶段的平均表观活化能分别为77.21和227.42 kJ/mol,前者较原膜减小67.95 kJ/mol,后者较原膜增大40.23 kJ/mol。当温度超过363.3℃时,复合膜的热稳定性优于原膜;当温度低于363.3℃时,复合膜耐温性能不及原膜。环境温度对膜质子电导率影响较大,当温度从-30℃升至90℃时,原膜和复合膜的质子电导率均呈升高趋势;在90℃时,复合膜及原膜的质子电导率分别为2.75×10-5S·cm-1和2.70×10-6S·cm-1。
[1]ZHANG H W,SHEN P K.Recent development of polymer electrolyte membranes for fuel cells[J].Chem Rev,2012,112(5): 2780-2832.
[2]魏风,鲁伊恒,刘伟龙,等.质子交换膜的热降解行为[J].电源技术,2012,36(12):1819-1823.
[3]ANIS A,AL-ZAHRANI S M,BANTHIA A K,et al.Fabrication and characterization of novel crosslinked composite membranes for direct methanol fuel cell application-part I.poly(vinyl alcohol-Covinyl acetate-Co-itaconic acid)/phosphotungstic acid based membranes[J].Int J Electrochem Sci,2011(7):2461-2487.
[4]杨金燕,魏小兰,黄敏文.低湿度下质子交换膜燃料电池的交流阻抗分析[J].中山大学学报:自然科学版,2010,49(6):137-140.
[5]马宁,蔡芳昌,殷浩,等.交流阻抗法测试质子交换膜电导率的影响因素[J].高分子材料科学与工程,2012,28(11):130-133.
[6]侯俊波,俞红梅,邵志刚,等.质子交换膜燃料电池的0℃以下耐受性[J].电池,2007(6):4-7.
[7]鲁伊恒,魏风,吕玉卫,等.纳米SiO2表面处理对质子交换膜热稳定性的影响[J].高分子材料科学与工程,2013,29(1):84-88.
[8]SAHU A K,JALAJAKSHI A,PITCHUMANI S,et al.Endurance of Nafion-composite membranes in PEFCs operating at elevated temperature under low relative-humidity[J].J Chem Sci,2012,124(2): 529-536.
[9]KE C C,LI X J,SHEN Q,et al.Investigation on sulfuric acid sulfonation of in-situ sol-gel derived Nafion/SiO2composite membrane [J].International Journal of Hydrogen Energy,2011,36(5):3606-3613.
[10]TIAN H,SAVADOGO O.Silicotungstic acid Nafion composite membrane for proton-exchange membrane fuel cell operation at high temperature[J].Journal of New Materials for Electrochemical Systems,2006,9:61-71.
Effects of heteropoly acid on stability of proton exchange membrane used in fuel cell
MA Shuang-chun,LU Yi-heng,CHEN Ying,FENG Wen-quan,LI Han-xu
Using silane coupling agent and phosphomolybdic acid and silicon tungsten acid to modify the surface of perfluorinated sulfonic acid ion-exchange membrane,the composite membrane used in fuel cells was prepared. When the heating rate respectively was 5,10,20 and 30℃/min,TGA curves and proton conductivity at different temperatures were determined.Experimental results show that the thermal decomposition process of composite membranes are through three stages.The peak temperature of thermal degradation was moved toward the low temperature zone offset,the apparent activation energy of the first and second stages were calculated.When the temperature was higher than 363.3℃,thermal stability of the composite film was better than the original membrane. At-30℃to 0℃and 20℃to 90℃range,proton conductivity of original membrane and composite membrane were gradually increased with the increase of the temperature,proton conductivity of the composite film was better than the original film.
proton exchange membrane;heteropolyacids;surface treatment;proton conductivity
TM 911.4
A
1002-087 X(2015)03-0484-04

2014-08-16
安徽省国际科技合作计划资助项目(06088018);淮南市科技计划资助项目(2011A07923)
马双春(1990—),男,山东省人,硕士研究生,主要研究方向为燃料电池膜及电极材料。
鲁伊恒,副教授,E-mail:yhlu2000@163.com
