例谈物质的提纯和鉴别
2015-06-15徐会洋马逸群
徐会洋+马逸群
一、物质的提纯
采用适当的操作方法,把混合物中的杂质分离出去,从而保留一种有效成分,这一过程叫做物质的提纯,又叫除杂。
1.物质提纯的基本原则
(1)不增:除杂过程中不能增加新的杂质。
(2)不减:有效成分不能减少,即除杂试剂与有效成分不反应,操作过程中有效成分不能流失等。
(3)易分:有效成分与杂质容易分离,多将杂质转变为沉淀、水、气体等。
2.物质提纯的常用方法
(1)过滤法:将不溶于液体的固体与液体分离的一种方法。如净化浑浊的井水时,通过过滤即可除去泥沙等不溶物,得到澄清透明的水。
(2)结晶法:混合物中两种固体的溶解度存在明显的差异,就可以采用降温结晶的方法将它们分离。如除去KNO3中混有的少量NaCl,可以先将混合物溶于水,制成较高温度下的KNO3饱和溶液,降温后大部分KNO3结晶析出,NaCl仍留在溶液中,再过滤即得纯净的KNO3。
(3)蒸发法:根据杂质与有效成分的挥发性不同,可以通过蒸发的方法使它们分离。如氯化钠溶液中含有杂质盐酸,可以通过蒸发使HCl挥发,从而留下纯净的氯化钠溶液;从蔗糖溶液里提取蔗糖,也是通过蒸发达到目的的。
(4)蒸馏法:根据混合液体(或液—固体系)中各组分的沸点不同,使低沸点的组分蒸发、冷凝,从而实现所含组分的分离。如实验室利用硬水制取蒸馏水,通过加热到100℃使水蒸发进入冷凝装置,钙、镁化合物等杂质则留在了蒸馏器中。
(5)酸溶法:将杂质溶解到酸溶液中的一种提纯方法。如除去Cu粉中的少量CuO,可以向混合物中加入稀盐酸或稀硫酸,使CuO全部溶解,再过滤即得纯净的铜。
(6)沉淀法:将杂质转化为沉淀的一种方法,因为沉淀易于清除。如果杂质中含有OH-,可以加入含有Cu2+或Fe3+的盐溶液,使杂质转变为Cu(OH)2或Fe(OH)3沉淀而滤出;如果杂质中含有CO2-3,可以加入含有Ca2+或Ba2+的盐溶液,使杂质转变为CaCO3或BaCO3沉淀而滤出;如果杂质中含有SO2-4,可以加入含有Ba2+的盐溶液,使杂质形成BaSO4沉淀而滤出;如果杂质中含有Cl-,可以加入含有Ag+的盐溶液,使杂质形成AgCl沉淀而滤出。
(7)气化法:将杂质转化为易于逸出反应体系的气体的一种方法。如除去NaCl溶液中混有的Na2CO3,可以向混合溶液中逐滴加入稀盐酸,直至无气泡放出,即得纯净的NaCl溶液。
(8)互变法:通过化学反应,将杂质转化为有效成分。如清除CO2中混有的少量CO,可以将混合气体通过灼热的CuO,CO即被氧化成CO2,如此既除去了杂质气体CO,又增加了有效成分CO2的量。
(9)置换法:通过置换反应,将杂质转化为容易分离的物质。如除去FeSO4溶液中混有的少量CuSO4,可以利用Fe粉置换出Cu,再滤去Cu和过量的Fe,即得较为纯净的FeSO4溶液。
(10)吸收法:一般是除去气体中杂质的提纯方法。如除去H2中混有的水蒸气、CO2等杂质,可以将混合气体依次通过盛有NaOH溶液、浓H2SO4的洗气瓶,从而得到纯净、干燥的H2。
(11)加热法:通过加热(或高温煅烧),使杂质变为气体逸出。如除去生石灰中混有的少量石灰石,可以将混合物煅烧至恒重,即得较为纯净的生石灰。
需要说明的是,生产、生活中提纯物质时,常将几种提纯方法联合起来使用。如粗盐的提纯,先通过溶解将粗盐中的有效成分(氯化钠)变成液体,再通过过滤将液体(盐水)与不溶性杂质(泥沙)分离,接下来,蒸发盐水即得精盐。
3.走进中考
例1(广东)下列除去杂质(括号内)的方法正确的是()
A.CO(CO2):通过灼热的氧化铜
B.NaOH溶液(Na2CO3):加适量稀盐酸
C.NaCl溶液(盐酸):加热蒸发
D.铁粉(氧化铜粉末):加入足量稀硫酸
解析:本题主要涉及蒸发法、气化法、酸溶法等提纯方法。将A项中混合气体通过灼热的氧化铜时,有效成分CO被反应,而杂质CO2仍然存在(合理的除杂试剂是NaOH溶液)。向B项中混合溶液里加入稀盐酸时,不仅除去了杂质Na2CO3,同时也破坏了有效成分NaOH(合理的除杂试剂是石灰水)。加热C项中混合溶液时,HCl很快挥发,正好留下有效成分NaCl的溶液。向D项中固体混合物加入稀硫酸时,不仅除去了杂质氧化铜,同时清除了有效成分铁粉(正确的除杂方法是用磁铁吸引)。
答案:C
例2(上海)除去溶液中的少量杂质,试剂选择正确的是()
选项溶液杂质试剂ANaNO3Na2CO3适量BaCl2溶液BCaCl2稀盐酸足量CaCO3固体CZnSO4CuSO4足量铜粉DFe2(SO4)3Na2SO4足量NaOH溶液解析:本题主要涉及沉淀法、气化法、互变法、置换法等提纯方法。A项中除杂试剂BaCl2溶液虽然能清除杂质Na2CO3,但反应又引入了新杂质NaCl\[合理的除杂试剂是Ba(NO3)2溶液\]。B项中除杂试剂CaCO3与杂质稀盐酸反应,能生成有效成分CaCl2和极易逸出的CO2气体,且过量的CaCO3过滤即可除去。C项中的除杂试剂铜粉与杂质CuSO4不反应(合理的除杂试剂是锌粉)。D项中的除杂试剂NaOH溶液与杂质Na2SO4不反应,反而与有效成分Fe2(SO4)3反应。
答案:B
例3(泰州)下列除去杂质(少量)的方法中,正确的是()
选项物质杂质除杂方法AH2HCl通过饱和的Na2CO3溶液BKNO3晶体NaCl高温下制成饱和溶液,降温结晶,过滤,洗涤烘干CNaCl晶体Na2CO3加稍过量稀盐酸,蒸发结晶DKCl溶液K2SO4加稍过量Ba(NO3)2溶液,过滤解析:本题主要涉及沉淀法、气化法、结晶法、互变法和吸收法等提纯方法。A项中除杂试剂Na2CO3溶液虽然能清除杂质HCl气体,但反应又产生CO2气体,混入H2之中成为新的杂质(合理的除杂试剂是NaOH溶液)。B项中有效成分KNO3的溶解度受温度变化的影响很大,杂质NaCl的溶解度受温度变化的影响很小(且NaCl含量少),所以KNO3中混入少量NaCl时,可以使用冷却热饱和溶液(降温结晶法)的方法提纯。C项中除杂试剂稀盐酸既能将杂质Na2CO3清除掉,又同时产生有效成分NaCl,且过量的盐酸通过加热蒸发即可除去,可得到纯净的NaCl晶体。D项中的除杂试剂Ba(NO3)2溶液虽能除去杂质K2SO4,但反应同时产生了新的杂质KNO3,而且过量的Ba(NO3)2也混入了KCl溶液中不易除去(合理的除杂试剂是BaCl2溶液)。
答案:BC
例4(十堰)为除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4得到NaCl,可将粗盐溶解于水,然后进行下列六项操作:①过滤、②加适量盐酸、③加过量Na2CO3溶液、④加过量NaOH溶液、⑤加过量BaCl2溶液、⑥蒸发,正确的操作顺序是()
A.①④⑤③②⑥B.④①③⑤②⑥
C.⑤④③②①⑥D.⑤④③①②⑥
解析:本题主要涉及沉淀法、结晶法和过滤法等提纯方法。粗盐中不仅含有不溶性泥沙,还含有三种可溶性杂质(所含杂质离子分别是SO2-4、Mg2+、Ca2+),可以将这些杂质转化为沉淀除去。因为每一步的除杂试剂都过量,所以后加入的除杂试剂,不仅要除去对应的杂质,还要把先加入的除杂试剂的过量部分除去,如Na2CO3就必须在BaCl2的后面加入,这样Na2CO3既能清除杂质CaCl2,又能清除过量的BaCl2;NaOH、NaCO3这两种除杂试剂的过量部分,最后用盐酸除去;既然盐酸是最后加入的除杂试剂,那么Na2CO3、NaOH、BaCl2这三种除杂试剂中最后加入的那种除杂试剂一定要能与盐酸反应,所以与盐酸不反应的BaCl2溶液不能在加入盐酸的前一步加入。综上,除杂试剂的加入顺序是:NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸;或BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸;或BaCl2溶液→Na2CO3溶液→NaOH溶液→盐酸。
答案:D
二、物质的鉴别
物质的鉴别,是指采用适当的检验方法,对可能存在的物质进行确认,也叫物质的区别、区分。
1.物质鉴别的原则
(1)避同求异:所用方法能使有关成分呈现不同的实验现象,从而由实验现象准确推出存在的物质。
(2)先后有序:先取样(因为是破坏性实验),再鉴别;先观察物理特征(有无明显的颜色、气味等特征),再使用特征反应(有无沉淀、气体、变色等现象出现)。
2.物质鉴别的常用方法
①不限定试剂:方法开放,有多种试剂可以选择使用,如酸或碱的鉴别。
②限定一种试剂:只允许使用一种鉴别试剂,当把这种试剂分别加入n种待鉴物质中时,能出现n种不同的实验现象。如鉴别石灰水、稀盐酸、氯化钠三种无色溶液,只用石蕊溶液这一种试剂即可完成鉴别任务。
③不另选试剂:先找出有物理特征的物质(通过看颜色、闻气味),再用它作下一步的鉴别试剂(无试剂鉴别就此转化为有试剂鉴别),如鉴别FeCl3、HCl、NaCl、Ca(OH)2四种溶液,不用其他试剂就可以完成。如果几种待鉴溶液都是无色的,则采用两两混合法(若n种溶液呈现n种不同现象,就能完成鉴别),如鉴别Na2CO3、HCl、BaCl2、AgNO3四种溶液,即可采用这种方法(出现2次沉淀、1次气体的是Na2CO3溶液,出现1次沉淀、1次气体、1次无明显现象的是盐酸,出现2次沉淀、1次无明显现象的是BaCl2溶液,出现3次沉淀的是AgNO3溶液)。
3.常见物质的鉴别方法
(1)酸:用紫色石蕊溶液(变红色)、pH试纸(pH<7)、活泼金属(产生可燃性气体)或碳酸盐(冒气泡)等。
(2)碱:用无色酚酞溶液(变红色)、pH试纸(pH>7)或硫酸铜溶液(产生蓝色沉淀)等。
(3)碳酸盐:加入稀盐酸或稀硫酸,产生的气体能使澄清石灰水变浑浊。
(4)可溶性硫酸盐:加入Ba(NO3)2溶液,能形成不溶于稀硝酸的白色沉淀。
(5)盐酸盐(氯化物):加入AgNO3溶液,能形成不溶于稀硝酸的白色沉淀。
(6)铵盐:与碱混合研磨,能产生使湿润的红色石蕊试纸变蓝的气体。
(7)氢气:点燃,能产生爆鸣声。
(8)氧气:将带火星的木条伸入其中,能复燃。
(9)二氧化碳:通入澄清的石灰水中,能使石灰水变浑浊。
(10)蛋白质:点燃,能产生烧焦羽毛的气味。
(11)淀粉:滴加碘水,淀粉能变成蓝色。
4.走进中考
例5(天津)下列区分物质的方法不正确的是()
A.用水区分碳酸钙粉末和碳酸钠粉末
B.用水区分硝酸铵固体和氢氧化钠固体
C.用硝酸钡溶液区分稀盐酸和稀硫酸
D.用酚酞溶液区分稀盐酸和食盐水
解析:本题涉及对酸、碱、碳酸盐、铵盐、盐酸盐的鉴别。A项,碳酸钙不溶于水,碳酸钠溶于水,因此能用水区分它们。B项,硝酸铵溶于水使溶液温度降低,氢氧化钠溶于水使溶液温度升高,因此也能用水区分它们。C项,硝酸钡溶液能与稀硫酸反应(产生白色沉淀),不与稀盐酸反应,因此能用硝酸钡溶液区分它们。D项,稀盐酸显酸性、食盐水显中性,它们都不能使酚酞溶液变色,因此用酚酞溶液不能区分它们(正确的区分试剂是紫色石蕊溶液)。
答案:D
例6(达州)下列有关物质的鉴别方法不正确的是()
A.用燃烧的方法鉴别羊毛和塑料
B.用碘液鉴别淀粉和白糖
C.用肥皂水鉴别硬水和软水
D.用观察颜色的方法鉴别一氧化碳和二氧化碳
解析:本题涉及不同类有机物、硬水和软水、碳的两种氧化物的鉴别。用燃烧的方法可以鉴别羊毛和塑料(有烧焦羽毛气味的是羊毛),用碘液可以鉴别淀粉和白糖(变蓝色的是淀粉),用肥皂水可以鉴别硬水和软水(产生较多白色垢状物的是硬水)。由于一氧化碳和二氧化碳都是无色气体,因此无法通过观察法鉴别它们(合理的鉴别试剂是石灰水或点燃看可燃性)。
答案:D
例7(衡阳)能将氢氧化钠、氯化钠和盐酸三种溶液一次性鉴别出来的是()
A.石蕊溶液B.碳酸钠溶液
C.硫酸铜溶液D.酚酞溶液
解析:本题涉及限定一种试剂去鉴别酸、碱、盐三类(种)物质,只有出现三种不同的实验现象才能顺利鉴别。氢氧化钠、氯化钠和盐酸分别呈碱性、中性和酸性,分别滴加石蕊溶液于三种待鉴溶液中,变红色的是盐酸,变蓝色的是氢氧化钠,不变色的是氯化钠。而用B、C、D项中鉴别试剂分别滴入三种待鉴溶液中,都不能出现三种不同的实验现象,所以无法鉴别。
答案:A
例8(镇江)下列各组溶液,不用其他试剂就能鉴别出来的是()
A.CuSO4、NaOH、KNO3、NaCl
B.K2CO3、NaOH、稀HCl、BaCl2
C.FeCl3、KOH、稀HCl、NaCl
D.稀HCl、Na2CO3、稀H2SO4、Na2SO4
解析:本题涉及不另选试剂鉴别几种常见的酸、碱、盐溶液。
A组,只有CuSO4溶液显蓝色,它首先被鉴别出来;再用CuSO4溶液可以鉴别出NaOH溶液(产生蓝色沉淀);用已鉴别出来的CuSO4溶液或NaOH溶液,无法鉴别剩下的KNO3溶液和NaCl溶液。
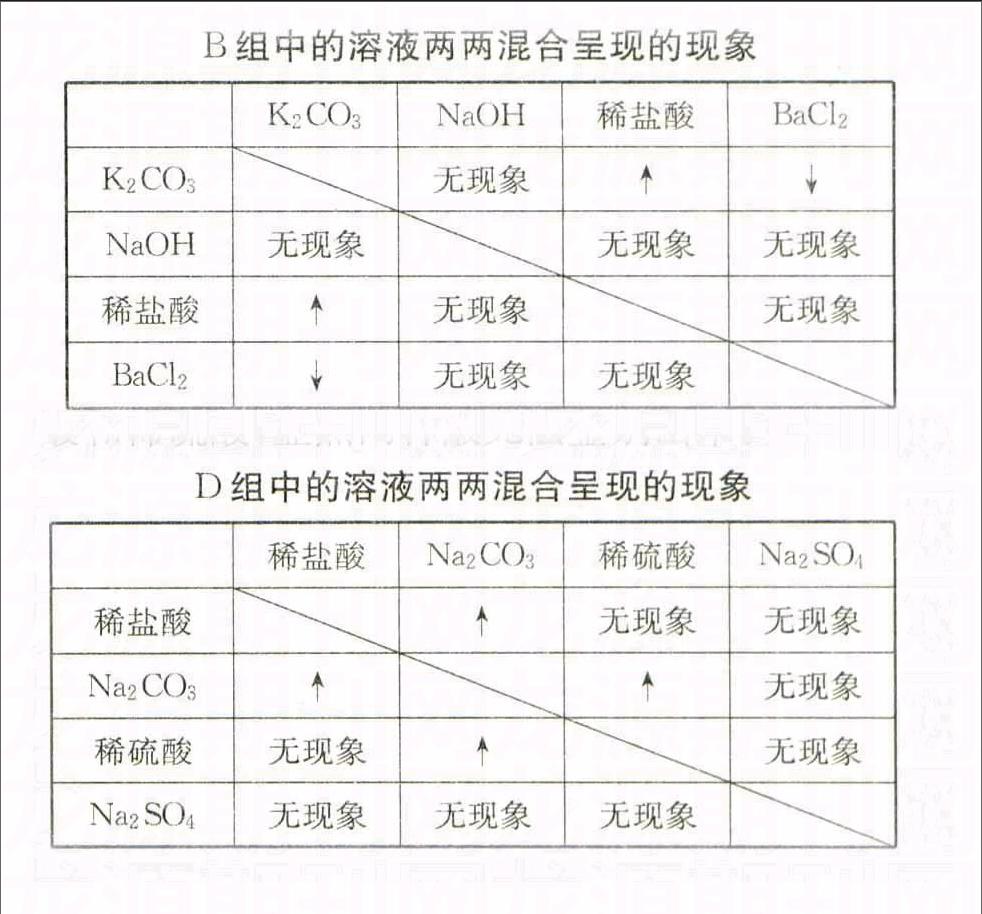
B组,四种待鉴溶液均是无色,可以采用两两混合法,有关的实验现象见下表。从表中可以看出,出现1次沉淀、1次气体、1次无明显现象的是K2CO3溶液,出现3次无明显现象的是NaOH溶液,出现1次气体、2次无明显现象的是稀盐酸,出现1次沉淀、2次无明显现象的是BaCl2溶液。
B组中的溶液两两混合呈现的现象
K2CO3NaOH稀盐酸BaCl2K2CO3无现象↑↓NaOH无现象无现象无现象稀盐酸↑无现象无现象BaCl2↓无现象无现象C组,只有FeCl3溶液呈黄色,它首先被鉴别出来;再用FeCl3溶液可以鉴别出KOH溶液(产生红褐色沉淀);将剩下的两种待鉴溶液分别滴入红褐色沉淀中,能使沉淀溶解的是稀盐酸,不能使沉淀溶解的是NaCl溶液。
D组,四种待鉴溶液均是无色,可以采用取样两两混合法,有关的实验现象见下表。从表中可以看出,出现2次气体、1次无明显现象的是Na2CO3溶液,出现3次无明显现象的是Na2SO4溶液,出现1次气体、2次无明显现象的是稀盐酸和稀硫酸,显然两种酸无法鉴别出来。
D组中的溶液两两混合呈现的现象
稀盐酸Na2CO3稀硫酸Na2SO4稀盐酸↑无现象无现象Na2CO3↑↑无现象稀硫酸无现象↑无现象Na2SO4无现象无现象无现象答案:BC热点聚焦热点聚焦