气体信号分子硫化氢对冠心病的保护作用机制及相关性研究
2015-06-13何松坚李尚海
何松坚,吴 铿,游 琼,李尚海
硫化氢(H2S)被证实具有舒张血管、减轻炎症反应、减少心肌梗死的范围和死亡率,保护神经细胞免于氧化应激的作用。H2S主要是通过L-半胱氨酸或同型半胱氨酸为底物,通过胱硫醚-γ-裂解酶(CSE)或胱硫醚-β-裂解酶,以吡多醛5’-磷酸盐和3-硫基丙酮酸硫转移酶(3-MST)为协同因子参与反应合成。在H2S的产生中涉及CBS、CSE及3-MST,这些酶具有组织的特异性。在硫化氢的代谢通路中,起关键作用的限速酶是胱硫醚β合成酶(CBS)。本研究测定经冠脉造影证实正常对照组和冠心病组空腹血浆中硫化氢的含量,评估患者血浆中硫化氢浓度与冠心病的相关性;评估硫化氢与血小板聚集功能的相关性;探究硫化氢气体浓度的改变是否与代谢通路中代谢酶活性的改变有关。
1 资料与方法
1.1 分组 入选2012年1月—2014年6月在广东医学院附属医院心内科住院的200例患者,分为两组:冠脉正常组(a组,n=99)、冠脉造影提示冠状动脉血管光滑,无明显管腔狭窄(正常)或冠状动脉无明显影响血流动力学的粥样硬化病变(小于50%狭窄);冠心病组(b组,n=101)、冠脉造影证实的管腔直径狭窄>50%狭窄,b组分为稳定型心绞痛组(b1组,n=34)、不稳定型心绞痛组(b2组,n=35)及心肌梗死组(b3组,n=32)。
1.2 入选排除标准 入选标准:拟行冠脉造影;年龄>18岁;签署知情同意书。排除标准:血流动力学不稳定;妊娠;伴有严重感染;肝功能实验室指标超过正常范围上限2倍者;血清肌酐大于4.0mg/dL;严重精神疾患者;出血病史或凝血功能障碍;血小板数小于正常值下限;预期寿命小于1年者。
1.3 研究方法
1.3.1 血标本留取和保存 a组和b组常规抽取临床指标:血小板计数、血小板聚集率检测、三酰甘油、胆固醇、低密度脂蛋白、高密度脂蛋白。另空腹抽取4 mL全血,放置于EDTA 抗凝管中,于3 000转,10 min分离为血浆和血细胞,放置于-80℃低温冰箱保存。
1.3.2 胱硫醚-γ-裂解酶活性检测 用纯化的抗体包被微孔板,制成固相载体,往包被抗CTH抗体的微孔中依次加入标本或标准品、生物素化的抗CTH抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样本中的CTH呈正相关。用酶标仪在450nm波长下测定吸光度(OD值),计算样本浓度。
1.3.3 胱硫醚-β-合成酶活性检测 用纯化的抗体包被微孔板,制成固相载体,往包被抗CBS抗体的微孔中依次加入标本或标准品、生物素化的抗CBS抗体、HRP标记的亲和素,经过彻底洗涤后用底物TMB显色。TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样本中的CBS呈正相关。用酶标仪在450nm波长下测定吸光度(OD值),计算样本浓度。
1.3.4 血浆中H2S含量的测定 采用敏感硫电极法测定。仪器:离子计(PXS-270上海雷磁)、敏感硫电极(Pag/S1上海雷磁)。抗氧化液配制:NaOH 8g,EDTA 7g加去离子水85mL,配制成存储液,临使用前加入抗坏血酸10g,即抗氧化液。测定a组和b组血浆中H2S的浓度:取人空腹血浆加入等体积抗氧化液,其总量应以加入测定容器后能淹没过电极为准(通常需>0.8mL),测定后据标准曲线计算出H2S浓度。
1.4 统计学处理 采用SPSS软件,使用两独立样本的t检验,使用回归分析评估患者血浆中硫化氢的浓度与冠心病的相关性及与血小板聚集功能的相关性。
2 结 果
2.1 基线资料 200例患者中,男性109例;年龄(62±12)岁。详见表1。
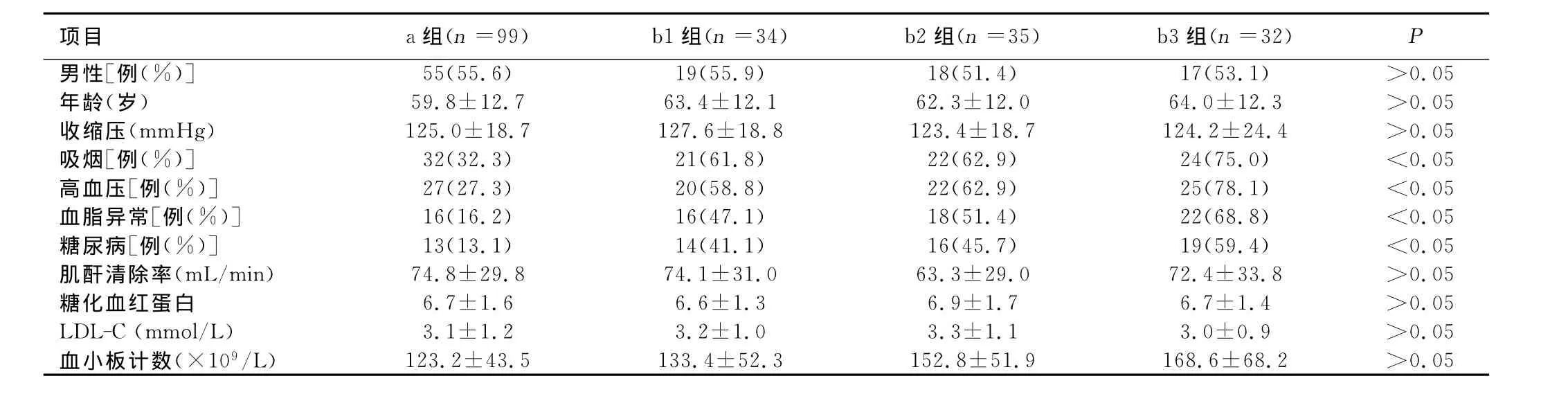
表1 各组间基线资料比较
2.2 血浆CSE活性测定 冠心病患者组血浆CSE活性明显低于冠脉正常组(P<0.01),且稳定型心绞痛组、不稳定型心绞痛组及心肌梗死组血浆CSE活性存在统计学意义(P<0.01)。详见表2。
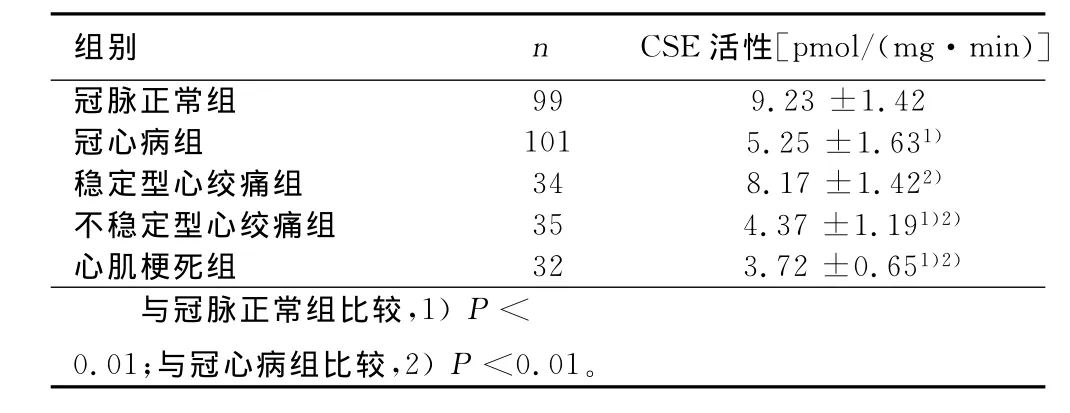
表2 冠心病组血浆CSE活性(x±s)
2.3 胱硫醚-β-合成酶活性检测 冠心病组血浆CBS活性明显低于冠脉正常组(P<0.01),且稳定型心绞痛组、不稳定型心绞痛组及心肌梗死组血浆CBS活性存在统计学意义(P<0.01)。详见表3。

表3 冠心病组与血浆CBS活性(x±s)
2.4 血浆中H2S含量及血小板聚集率PAR的测定冠心病组血浆H2S含量明显低于冠脉正常组(P<0.01),且稳定型心绞痛组、不稳定型心绞痛组及心肌梗死组血浆H2S含量存在统计学意义(P<0.01),血浆H2S浓度与血小板聚集功能的相关性分析:血浆H2S浓度与PAR呈负相关(r=-0.85,P<0.01)。详见表4。
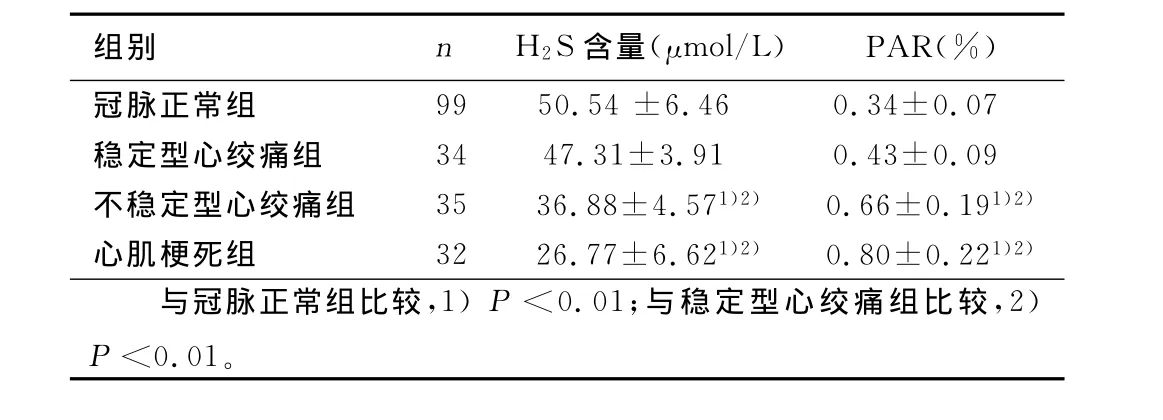
表4 冠心病组血浆H2S含量及血小板聚集率PAR(x±s)
3 讨 论
早期H2S曾被认为是一种无色具有臭鸡蛋气味的毒性气体,然而在20世纪九十年代,H2S被认为是继NO和CO后具有保护心血管系统作用的第三种气体信号分子。在20世纪九十年代中期,H2S被证实具有舒张血管[1,2]、减轻炎症反应[3,4]、减少心肌梗死的范围和死亡率[5,6],具有保护神经细胞免于氧化应激的作用[4,7]。近年的研究也表明,H2S在人体内起着重要的生物学作用,它在血管和神经体液平衡上的重要作用主要表现在:代谢调节、心脏保护、血管舒张、抗血小板聚集、血管氧敏感、内皮保护、血管炎症、通气控制和神经调节等方面[4,8]。在人体中,它主要是通过 L-半胱氨酸或同型半胱氨酸为底物,通过胱硫醚-γ-裂解酶或胱硫醚-β-裂解酶,以吡多醛5’-磷酸盐和3-硫基丙酮酸硫转移酶(3-MST)为协同因子参与反应合成。其代谢过程分为酶催化过程和非酶催化过程[9,10]。非酶催化过程尽管不重要,但是却可以通过非酶催化的方式使人体内主要的含硫化合物或多聚硫化物转化为H2S,该反应是通过葡萄糖支持及硫醇依赖的细胞反应及谷胱甘肽依赖的非细胞反应。酶催化过程是指在H2S的产生中涉及胱硫醚β合成酶、胱硫醚-γ合成酶及3-巯基丙酮酸转硫酶,这些酶具有组织的特异性,不同的组织富含酶的含量有所不同。CBS主要存在于大脑的中枢神经系统及部分血管内皮细胞中[11];CSE主要在心脏、肝脏、肾脏及血管平滑肌细胞中含量丰富,在血管内皮细胞中也存在少量的CSE[12],3-MST 主要存在于大脑中[13,14]。H2S同 NO 和 CO作为人体内重要的生物调节介质,具有快速渗透细胞膜内而不需要依附载体。H2S已经被指出在调节血管张力、心肌收缩力、神经递质传递和胰岛素的释放方面发挥了重要的作用[15-17]。H2S的缺乏会导致各种各样的病理生理改变如高血压、心肌缺血,阿尔茨海默病、胃溃疡、肝硬化,在心血管系统方面,研究最多的是H2S与心肌缺血-再灌注损伤的关系[18,19]。综合多方面的研究,可以看出H2S具有舒张血管、抗炎、抗细胞增殖的作用。
在硫化氢的代谢通路中,起关键作用的限速酶是胱硫醚-β-合成酶,它可以使同型半胱氨酸转变成 H2S和胱氨酸的前体胱硫醚。CBS是体内唯一使 Hcy转为最终代谢产物H2S的酶,代谢途径是不可逆的。由于CBS的基因突变导致CBS的活性缺乏是引起代谢通路中硫化氢含量降低的主要原因[20]。
本研究通过检测各组血浆CBS活性发现,冠心病组血浆CBS活性明显低于冠脉正常组,且稳定型心绞痛组、不稳定型心绞痛组及心肌梗死组血浆CBS活性存在统计学意义,即随着冠脉病变的加重及病情恶化,血浆CBS活性逐渐下降,即血浆CBS活性与冠脉病变的加重呈负相关。
关于H2S的国内研究包括,在2007年,Zhu的团队报道急性心肌缺血的小鼠模型通过H2S介导的信号通路发挥心血管保护作用[21];2008年 Wang的团队有直接的证据表明H2S是生理的血管舒张剂和血管压力的调节者[22];2010年,Wang的团队还提供证据表明,胱硫醚-γ-裂解酶的缺乏与血管平滑肌的异常增殖有关[23]。本研究通过检测各组血浆CSE活性发现,冠心病组血浆CSE活性明显低于冠脉正常组,且稳定型心绞痛组、不稳定型心绞痛组及心肌梗死组血浆CSE活性存在统计学意义,即随着冠脉病变的加重及病情恶化,血浆CSE活性逐渐下降,即血浆CSE活性与冠脉病变的加重呈负相关。
在本研究中,冠心病组H2S浓度明显低于对照组。并且随病变程度的加重逐渐降低,提示血浆H2S水平在冠心病的发病过程中可能起着保护作用,其在血浆浓度高低与冠脉病变程度相关。冠心病患者中的血浆含量在吸烟者较不吸烟者、具高血压者较无高血压者皆显著下降,与血糖呈强负相关性,表明血浆H2S含量的减少可能不仅与冠心病的病情严重程度、冠脉血管病变情况相关,而且与冠心病危险因素吸烟、高血压、高血糖密切相关。H2S作为一种新型的气体信号分子具有心脏保护的作用,在心肌缺血的患者血浆中测定硫化氢的含量,可以评估患者心肌缺血的程度以及对患者预后的指导。
本研究通过血浆H2S浓度与血小板聚集功能的相关性分析发现,血浆H2S浓度与PAR呈负相关,证明了H2S可降低冠心病患者的血小板聚集率,为临床上外源性吸入H2S可降低冠心病患者的血液黏度提供了一定的依据。
本研究检测血浆H2S浓度与胱硫醚-γ-裂解酶及胱硫醚-β-裂解酶的血浆活性,初步推测H2S气体浓度的改变与代谢通路中CSE及CBS活性的改变有关。
本研究的缺点在于为单中心研究,样本量不足,确切的结论需要大样本资料进一步观察研究。
[1] Beard RS,Bearden SE.Vascular complications of cystathionineβsynthase deficiency:Future directions for homocysteine-to-hydrogen sulfide research[J].Am J Physiol Heart Circ Physiol,2011,300(1):H13-26.
[2] Zoccolella S,Dell’aquila C,Specchio LM,etal.Elevated homocysteine levels in Parkinson’s disease:Is there anything besides L-Dopa treatment[J].Curr Med Chem,2010,17(3):213-215.
[3] Kocer B,Engur S,Ak F,etal.Serum vitamin B12,folate,and homocysteine levels and their association with clinical and electrophysiological parameters in multiple sclerosis[J].J Clin Neurosci,2009,16:399-403.
[4] Bearden SE,Beard RS,Pfau JC.Extracellular transsulfuration generates hydrogen sulfide from homocysteine and protects endothelium from redox stress[J].Am J Physiol Heart Circ Physiol,2010,299:H1568-H1576.
[5] Ebbing M,Bleie O,Ueland PM,etal.Mortality and cardiovascular events in patients treated with homocysteine-lowering B vitamins after coronary angiography:A randomized controlled trial[J].JAMA,2008,300:795-804.
[6] Jamison RL,Hartigan P,Kaufman JS,etal.Effect of homocysteine lowering on mortality and vascular disease in advanced chronickidney disease and end-stage renal disease:A randomized controlled trial[J].JAMA,2007,298:1163-1170.
[7] Vandiver M,Snyder SH.Hydrogen sulfide:A gasotransmitter of clinical relevance[J].J Mol Med(Berl),2012,90(3):255-263.
[8] Koenitzer JR,Isbell TS,Patel HD,etal.Hydrogen sulfide mediates vasoactivity in an O2-dependent manner[J].Am J Physiol Heart Circ Physiol,2007,292:H1953-H1960.
[9] Martelli A,Testai L,Breschi MC,etal.Hydrogen sulphide:Novel opportunity for drug discovery[J].Med Res Rev,2012,32(6):1093-1130.
[10] Benavides GA,Squadrito GL,Mills RW,etal.Hydrogen sulfide mediates the vasoactivity of garlic[J].ProcNatl Acad Sci,2007,104:17977-17982.
[11] Paa LL,Liu XH,Gong QH,etal.Role of cystathionineγ-lyase/hydrogen sulfide pathway in cardiovascular disease:A novel therapeutic strategy[J].Antioxid Redox Signal,2012,17(1):106-118.
[12] Shi YX,Chen Y,Zhu YZ,etal.Chronic sodium hydrosulfide treatment decreases medial thickening of intramyocardial coronary arterioles,interstitial fibrosis,and ROS production in spontaneously hypertensive rats[J].Am J Physiol Heart Circ Physiol,2007,293:H2093-2100.
[13] Wang MJ,Cai WJ,Li N,etal.The hydrogen sulfide donor NaHS promotes angiogenesis in a rat model of hind limb ischemia[J].Antioxid Redox Signal,2010,12:1065-1077.
[14] Shibuya N,Tanaka M,Yoshida M,etal.3-Mercaptopyruvate sulfurtransferase produces hydrogen sulfide and bound sulfane sulfur in the brain[J].Antioxid Redox Signal,2009,11:703-714.
[15] Lavu M,Bhushan S,Lefer DJ.Hydrogen sulfidemediated cardioprotection:Mechanisms and therapeutic potential[J].Clin Sci(Lond),2011,120:219-229.
[16] Szabo C.Hydrogen sulphide and its therapeutic potential[J].Nat Rev Drug Discov,2007,6:917-935.
[17] Mok YY,Atan MS,Yoke Ping C,etal.Role of hydrogen sulphide in haemorrhagic shock in the rat:Protective effect of inhibitors of hydrogen sulphide biosynthesis[J].Br J Pharmacol,2004,143:881-889.
[18] Beard RS,Bearden SE.Vascular complications of cystathionine bsynthase deficiency future directions for homocysteine-to-hydrogen sulfide research[J].Am J Physiol Heart Circ Physiol,2011,300(1):H13-26.
[19] Scott Vandiver,Solomon H,Snyder.Hydrogen sulfide:A gasotransmitter of clinical relevance[J].J Mol Med,2012,90:255-263.
[20] Smith AT,Su Y,Stevens DJ,etal.The effect of the disease-causing R266Kmutation on the heme and PLP environments of human cystathionineβ-synthase[J].Biochemistry,2012,27:1-5.
[21] Banerjee R,Evande R,Kabil O,etal.Reaction mechanism and regulation of cystathionine beta-synthase[J].Biochim Biophys Acta,2003,1647:30-35.
[22] Alves JM,da Cunha BC,Regina BD,etal.The 844ins68cystathionine beta-synthase and C677TMTHFR gene polymorphism and the vaso-occlusive event risk in sickle cell disease[J].Ach Med Sci,2011,7(1):97-101.
[23] Moat SJ,Bao L,Fowler B,etal.The molecular basis of cystathionine beta-synthase (CBS)deficiency in UK and US patients with homocystinuria[J].Hum Mutat,2004,23:206.
