缺氧预处理对颅脑损伤大鼠皮层Nrf2及HO-1表达变化的影响
2015-06-13疏龙飞刘家传王金标张永明张星杨艳艳马涛孙文江卓健伟
疏龙飞 刘家传 王金标 张永明 张星 杨艳艳 马涛 孙文江 卓健伟
·基础研究·
缺氧预处理对颅脑损伤大鼠皮层Nrf2及HO-1表达变化的影响
疏龙飞 刘家传 王金标 张永明 张星 杨艳艳 马涛 孙文江 卓健伟
目的研究缺氧预处理对颅脑损伤大鼠皮层核转录因子NF-E2相关因子2(Nrf2)、血红素加氧酶1(HO-1)表达变化的影响。方法216只SD雄性大鼠,随机分为对照组(Con)、缺氧预处理组(HP)、颅脑损伤组(TBI)、缺氧预处理+颅脑损伤组(HP+TBI);Con和HP组各12只,TBI和HP+TBI组根据伤后处死时间再分为1 h、3 h、6 h、12 h、24 h、3 d、7 d、14 d八亚组,每组12只。采用改良的Feeney’s自由落体装置制作颅脑损伤大鼠模型,先在低压氧舱内处理3 d(-50 kPa、3 h/d)制作缺氧预处理模型。四组均用免疫组化和Western blotting测定Nrf2、HO-1的表达变化。结果颅脑损伤后皮层Nrf2和HO-1在伤后1 h开始表达升高,24 h达高峰,3 d后下降,1 h~7 d各时间点,TBI与Con组、HP+TBI与HP组相比,差异有统计学意义(P<0.05)。单纯3 d缺氧预处理后HP组与Con组比较,Nrf2、HO-1的表达差异无统计学意义;伤后1 h~7 d,HP+TBI组Nrf2、HO-1表达较TBI组更高,差异有统计学意义(P<0.05)。结论缺氧预处理进一步增加大鼠颅脑损伤后皮层Nrf2、HO-1表达,提高颅脑损伤后脑组织的抗氧化能力。
颅脑损伤;核转录因子E2相关因子2;血红素加氧酶1;缺氧预处理
【Key words】Traumatic brain injury;Nuclear factor erythroid 2-related factor 2;Heme ox-ygenase-1;Hypoxic preconditioning
氧化应激在颅脑损伤后继发性病理改变中发挥了重要的作用,核转录因子E2相关因子2 (nuclear factor erythroid 2-related factor 2,Nrf2)是脊椎动物体内抗氧化应激的重要转录因子[1],由Nrf2调节的Nrf2-ARE通路能诱导血红素加氧酶1(heme oxygenase-1,HO-1)、醌氧化还原酶(NADPH∶quinone oxidoreductase-1,NQO1)等多种抗氧化酶的表达;研究表明颅脑损伤后Nrf2-ARE通路激活增加[2],参与损伤后的脑保护。通过建立缺氧预处理与自由落体颅脑损伤大鼠模型,探讨缺氧预处理对颅脑损伤大鼠皮层Nrf2和HO-1表达变化的影响,为缺氧训练及颅脑损伤救治提供理论依据。
材料与方法
一、器材和试剂
Feeney’s自由落体颅脑损伤模型(淮北正华生物科技公司),WDZ-2000微型电动手术电钻(上海晶杰医疗器械有限公司),低压氧舱(上海减压器厂),VN-180活塞式无油真空泵(昆山佑诚至信电机设备有限公司),Nrf2兔抗鼠多克隆抗体(美国Santa Cruz公司),HO-1羊抗鼠多克隆抗体(美国Santa Cruz公司),β-actin(美国Santa Cruz公司),RIPA细胞裂解液(碧云天生物技术研究所),SP-9000抗兔二步法免疫组化检测试剂盒(北京中杉金桥生物技术有限公司),PV-9003抗羊二步法免疫组化检测试剂盒(北京中杉金桥生物技术有限公司),辣根过氧化物酶标记二抗(北京中杉金桥生物技术有限公司)。
二、实验动物及分组
216只雄性健康SD大鼠,体质量220~250 g,由安徽医科大学动物实验中心提供,采用随机数字表法分为对照组(Con组,n=12)、缺氧预处理(HP组,n= 12)、颅脑损伤(TBI组,n=96)、缺氧预处理+颅脑损伤组(HP+TBI组,n=96)。TBI组与HP+TBI组根据伤后不同时间点处死分为1 h、3 h、6 h、12 h、24 h、3 d、7 d、14 d 8个亚组,每组12只。
三、模型制作及取材:
1.缺氧预处理模型制作:将大鼠放入低压舱,熟悉环境5 min后,连接真空泵,缓慢减压至﹣50 kPa(模拟5 500 m高度,设定标准大气压为0 kPa),持续恒压维持3 h后再缓慢升至标准大气压出舱。HP与HP+TBI组连续预处理3 d,Con与TBI组不行缺氧预处理。
2.颅脑损伤模型制作:10%水合氯醛经腹腔注射将大鼠麻醉成功后,置于Feeney’s自由落体架,固定,消毒,沿头皮中线矢状切开头皮,剥离左顶部骨膜,暴露颅骨,于前囟后3 mm中线左侧旁开3 mm,紧靠冠状缝后用微型电动手术电钻开一直径5 mm的圆形骨窗,硬膜保持完整,50 g砝码25 cm高度自由落下撞击骨窗,打击后骨蜡封闭骨窗,并行头皮清创缝合术,保持大鼠呼吸道通畅,必要时给予心肺复苏。TBI组只行颅脑打击伤,HP+TBI组在连续3 d缺氧预处理结束1 d后行颅脑打击伤,Con与HP组不行颅脑打击伤。
3.取材:造模成功后,TBI和HP+TBI组再根据不同的分组时间点处死大鼠,每一时间点各取6只大鼠4%多聚甲醛心脏灌注后断头取脑,置于4%多聚甲醛中固定,供大鼠免疫组化检测使用。另各取6只大鼠挫伤区周围新鲜标本置于-80℃液氮罐中留做Western blotting分析用,Con组直接处死大鼠,HP组在连续3 d预处理结束后1 d处死大鼠,取相应部位的皮层组织检查,6只用于免疫组化,6只用于Western blotting检测。
四、免疫组化检测Nrf2和HO-1的表达
切片常规脱蜡至水,0.01 mol/L(pH 6.0)枸橼酸缓冲液抗原修复,3%H2O2室温20 min,10%正常羊血清封闭室温20 min,加兔抗Nrf2(1∶100),羊抗HO-1(1∶100)4℃过夜,PBS漂洗,严格按照免疫组化试剂盒说明书步骤进行,在高倍镜(400倍)下随机取损伤侧皮层范围内5个非重叠视野,利用Iamge-Pro Plus6.0软件分析阳性细胞的光密度。
五、Western blotting检测Nrf2和HO-1的表达
取各组大鼠损伤区周围皮层大约100 mg置于玻璃匀浆器中,加入RIPA细胞裂解液,充分碾磨,12 000×g离心5 min,收集上清液提取总蛋白,并测定蛋白浓度。按蛋白与缓冲液以1∶4比例混匀后煮沸5 min使之变性,冷却后取10 μg上样,β-actin作为内参。β-actin、Nrf2和HO-1的抗体均按1∶1 000稀释,二抗按1∶10 000稀释。用Quantity one4.6.2软件测定各条带积分灰度值,以目的条带与β-actin条带灰度值之比作为蛋白水平的相对表达量。
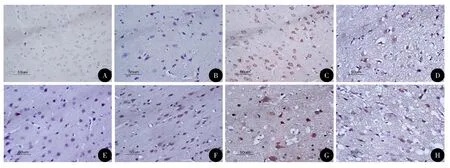
图1 各组大鼠皮层中Nrf2表达的染色(DAB,×400)
六、统计学处理
采用SPSS16.0统计软件包进行统计学处理。Nrf2光密度、HO-1光密度等数据用均数±标准差表示,组间比较采用方差分析,进一步两两比较采用SNK-q检验,不同组间两样本的比较采用独立样本t检验。以P<0.05示差异有统计学意义。
结果
一、免疫组化染色测定Nrf2和HO-1的分布与表达
光镜下可见颅脑损伤1 h后胶质细胞开始肿胀,毛细血管扩张、破裂,血管及细胞周围间隙扩大伴有炎性细胞浸润,随时间推移部分神经元及胶质细胞胞质变少成空泡状,胞核浓缩,伤后7 d可见神经元及胶质细胞中大量空泡形成。在颅脑损伤前Nrf2、HO-1少量分布于大鼠神经元和胶质细胞的细胞质当中,随颅脑损伤时间的推移,Nrf2和HO-1的平均光密度在伤后1 h开始升高,24 h达高峰,3 d后开始下降;伤后1 h~7 d,TBI组与Con组、HP+TBI组与HP组各时间点比较,差异均具有统计学意义(P<0.05);HP+TBI组与TBI组各时间点比较,伤后1 h~7 d Nrf2和HO-1的平均光密度更高,差异有统计学差异(P<0.05),HP组与Con组相比,差异无统计学意义(表1,图1~2)。
二、Western blotting测定皮层中Nrf2和HO-1蛋白的表达
Nrf2各组电泳显示在56~58 kD范围的条带,HO-1各组电泳显示在31~33 kD范围的条带;Nrf2和HO-1在颅脑损伤后1 h开始升高,24 h达高峰,3 d后开始下降;伤后1 h~7 d各时间点,TBI组与Con组、HP+TBI组与HP组比较,差异均具有统计学意义(P<0.05);伤后1 h~7 d各时间点,HP+TBI组将TBI组Nrf2和HO-1的表达进一步升高,差异有统计学差异(P<0.05),Con组与HP组相比,Nrf2和HO-1的表达差异无统计学意义(表2,图3、4)。
表1 各组大鼠皮层中Nrf2、HO-1免疫组化平均光密度比较(
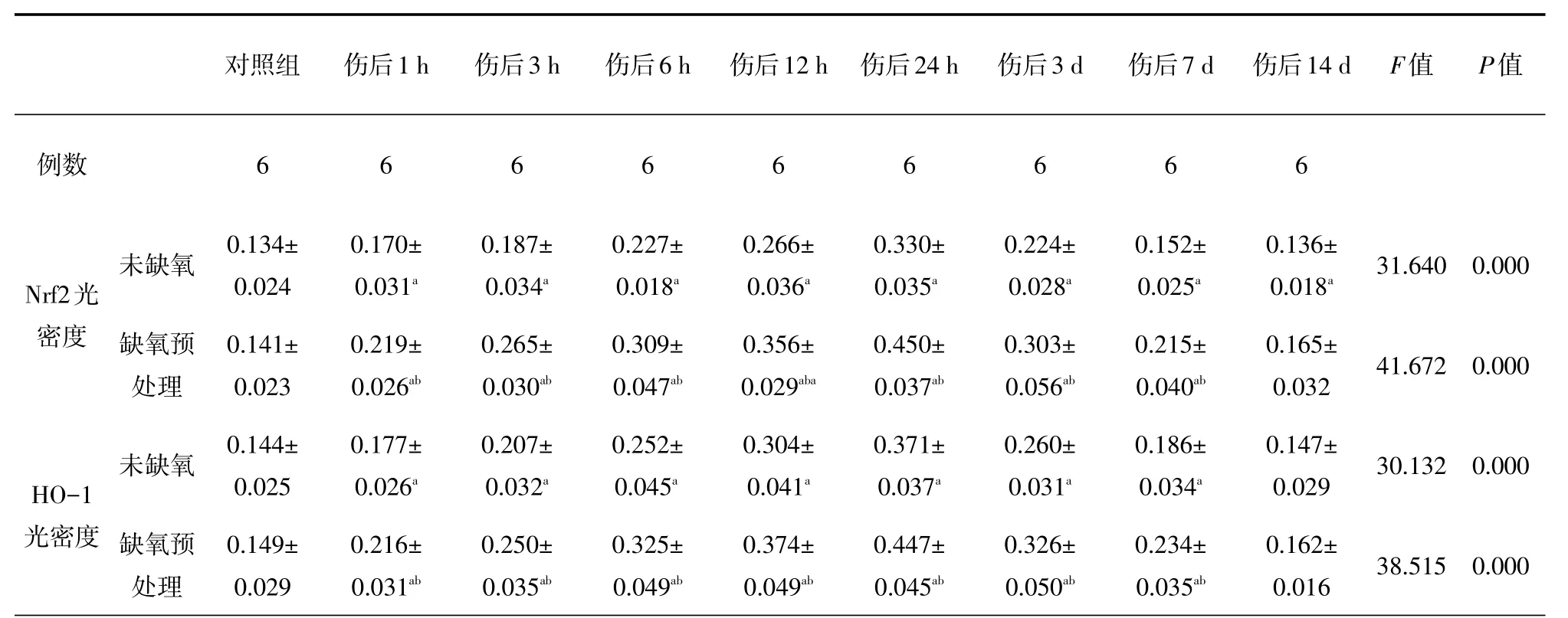
表1 各组大鼠皮层中Nrf2、HO-1免疫组化平均光密度比较(
与对照组比较,aP<0.05;与未缺氧组比较,bP<0.05
对照组伤后1 h 伤后3 h 伤后6 h 伤后12 h 伤后24 h 伤后3 d 伤后7 d 伤后14 d F值P值例数666666666未缺氧31.6400.000 Nrf2光密度缺氧预处理41.6720.000未缺氧30.1320.000 HO-1光密度缺氧预处理0.134± 0.024 0.141± 0.023 0.144± 0.025 0.149± 0.029 0.170± 0.031a0.219± 0.026ab0.177± 0.026a0.216± 0.031ab0.187± 0.034a0.265± 0.030ab0.207± 0.032a0.250± 0.035ab0.227± 0.018a0.309± 0.047ab0.252± 0.045a0.325± 0.049ab0.266± 0.036a0.356± 0.029aba0.304± 0.041a0.374± 0.049ab0.330± 0.035a0.450± 0.037ab0.371± 0.037a0.447± 0.045ab0.224± 0.028a0.303± 0.056ab0.260± 0.031a0.326± 0.050ab0.152± 0.025a0.215± 0.040ab0.186± 0.034a0.234± 0.035ab0.136± 0.018a0.165± 0.032 0.147± 0.029 0.162± 0.01638.5150.000
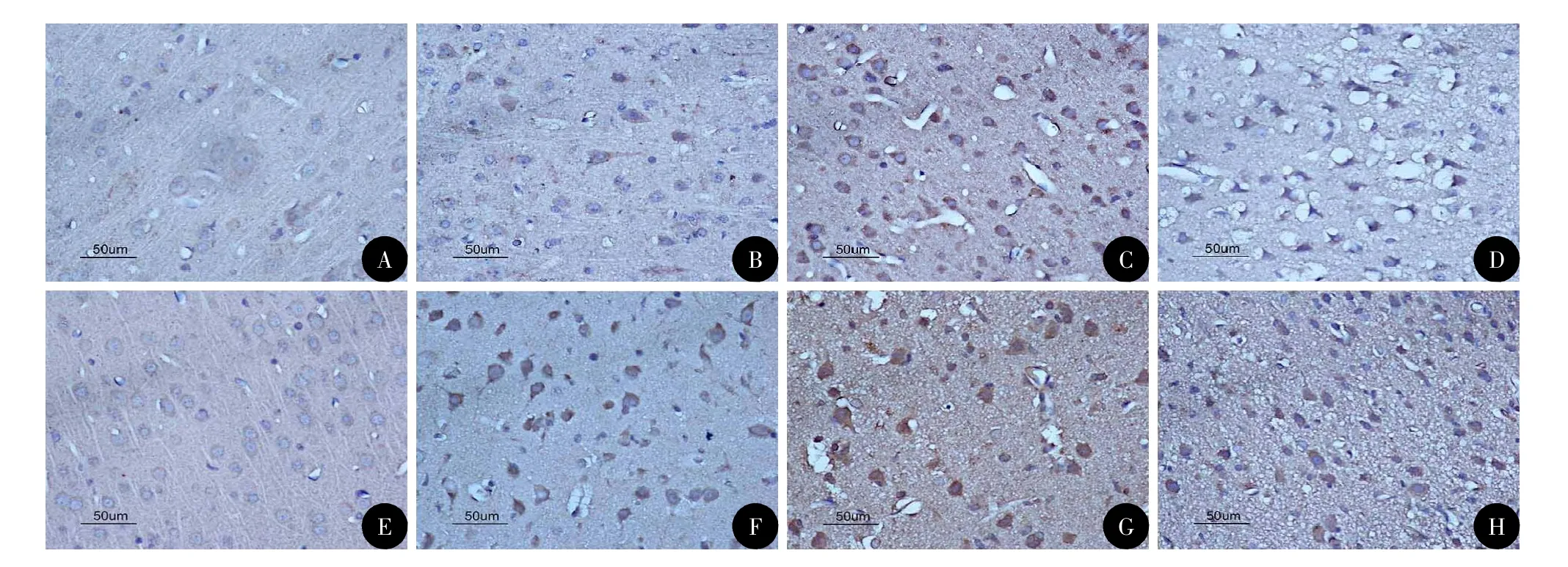
图2 各组皮层中HO-1表达的染色(DAB,×400)
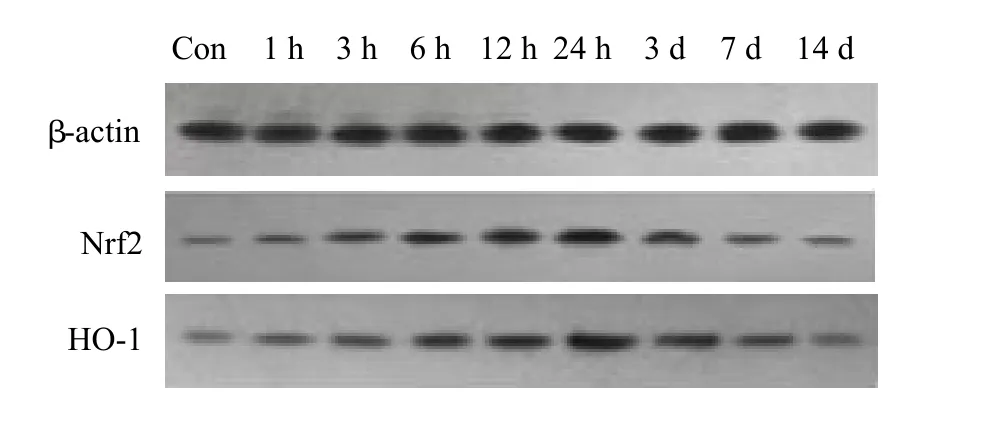
图3 Nrf2、HO-1在Con与TBI组蛋白的表达
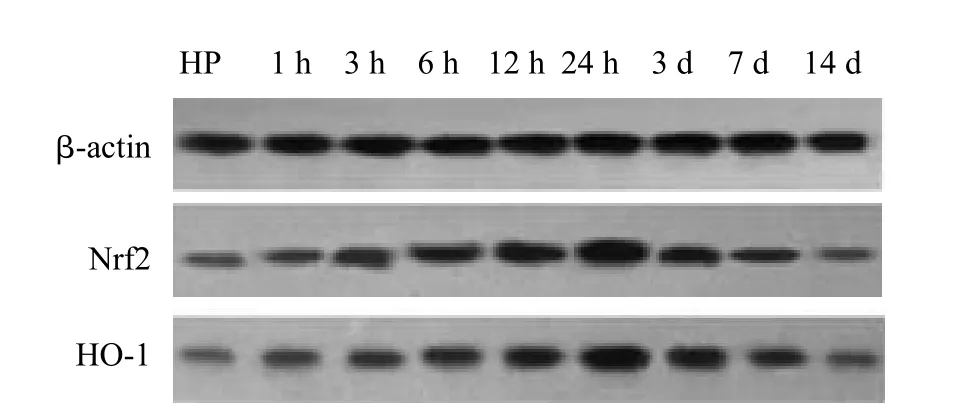
图4 Nrf2、HO-1在HP与HP+TBI组蛋白的表达
讨论
Nrf2-ARE通路是启动内源性抗氧化保护机制的主要通路[1],当机体受到氧化应激时,Nrf2由细胞质进入细胞核中与起始反应元件ARE结合,启动下游抗氧化蛋白HO-1、NOQ1,Grx,TrxR等表达参与抵抗损伤。给予短暂的预处理,能够增加机体对随后严重致死性刺激的耐受[3],缺氧预处理是研究较多的一种预处理方法,体外实验证实缺氧预处理能够对H9c2细胞产生一种延迟的保护作用[4],这种保护作用是通过上调细胞中Nrf2依赖的抗氧化通路来实现的。颅脑损伤后Nrf2-ARE通路表达激活[2],前期我们的研究发现缺氧预处理通过上调抗氧化酶的表达对颅脑损伤后的神经元产生保护作用[5],但缺氧预处理对颅脑损伤后的抗氧化酶动态表达影响尚不清楚。因此研究缺氧预处理对颅脑损伤后Nrf2和HO-1表达变化可进一步观察缺氧预处理对颅脑损伤的作用机制。
表2 各组大鼠皮层中Nrf2、HO-1相对表达量比较
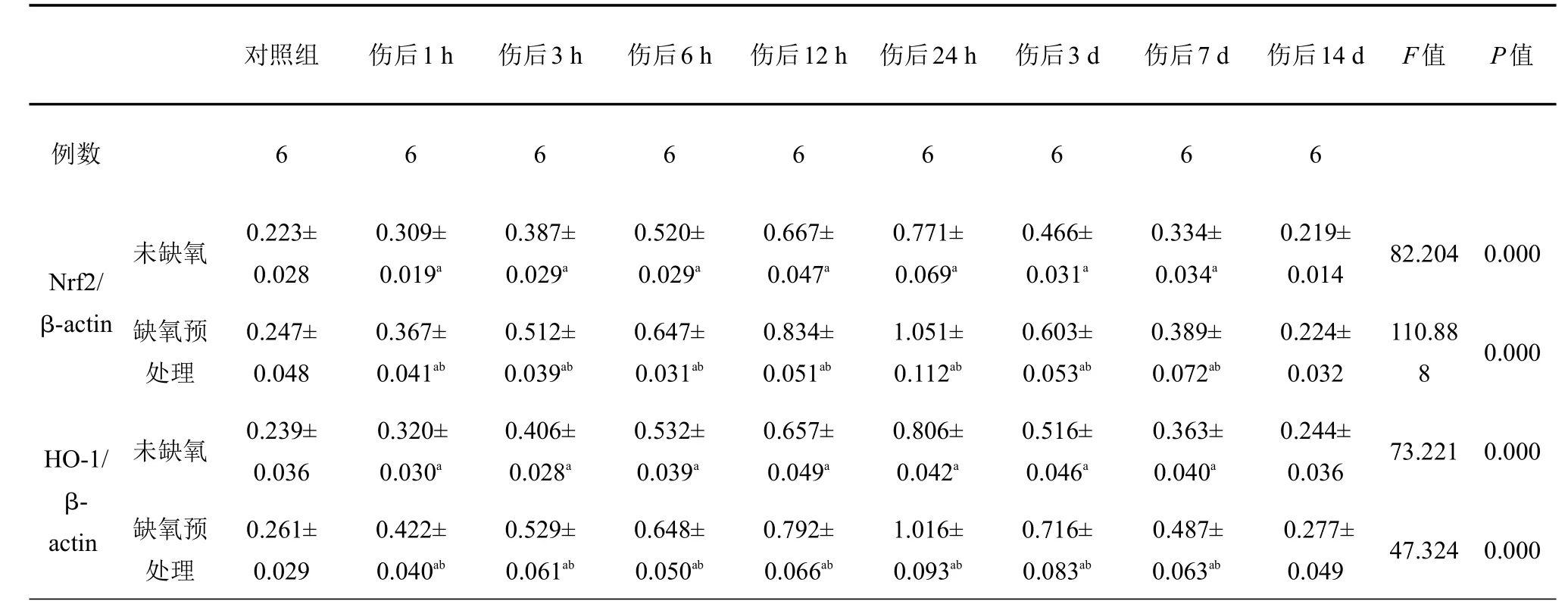
表2 各组大鼠皮层中Nrf2、HO-1相对表达量比较
与对照组比较,aP<0.05;与未缺氧组比较,bP<0.05
对照组伤后1 h 伤后3 h 伤后6 h 伤后12 h 伤后24 h 伤后3 d 伤后7 d 伤后14 d F值P值例数666666666未缺氧82.2040.000 Nrf2/ β-actin 缺氧预处理110.88 80.000 HO-1/ β-actin未缺氧73.2210.000缺氧预处理0.223± 0.028 0.247± 0.048 0.239± 0.036 0.261± 0.029 0.309± 0.019a0.367± 0.041ab0.320± 0.030a0.422± 0.040ab0.387± 0.029a0.512± 0.039ab0.406± 0.028a0.529± 0.061ab0.520± 0.029a0.647± 0.031ab0.532± 0.039a0.648± 0.050ab0.667± 0.047a0.834± 0.051ab0.657± 0.049a0.792± 0.066ab0.771± 0.069a1.051± 0.112ab0.806± 0.042a1.016± 0.093ab0.466± 0.031a0.603± 0.053ab0.516± 0.046a0.716± 0.083ab0.334± 0.034a0.389± 0.072ab0.363± 0.040a0.487± 0.063ab0.219± 0.014 0.224± 0.032 0.244± 0.036 0.277± 0.04947.3240.000
本实验中大鼠进行颅脑打击伤后,挫伤区周围皮层Nrf2和HO-1在伤后1 h开始表达增多,24 h达高峰,3 d后开始下降,直至伤后第7 d,TBI组与Con组相比,Nrf2和HO-1的表达仍有统计学意义,显示出Nrf2和HO-1作为一种急性应激蛋白在颅脑损伤后激活增多,参与继发性颅脑损伤早期的病理改变过程。给予大鼠连续3 d短暂的缺氧预处理,1 d后再行颅脑打击伤,显示缺氧预处理进一步激发了大鼠颅脑损伤后皮层抗氧化酶的表达,这种激发作用在颅脑损伤后1 h就开始显现出来,持续至伤后第7 d,并且与颅脑损伤后Nrf2和HO-1表达差异有统计学意义(1 h~7 d)的时间窗相一致,显示出短暂连续的缺氧预处理通过提高颅脑损伤后抗氧化酶的表达来产生保护作用,且这种保护作用在继发性颅脑损伤相对明显的时间窗内都表现出来。这种短暂的3 d缺氧预处理对正常大鼠的皮层抗氧化酶的表达并无明显的影响,其激活脑组织的保护机制在受到一个更加严重刺激时才会显示出来。对于Nrf2调控抗氧化酶的表达机制,通过免疫组化染色发现,颅脑损伤前Nrf2少量分布在神经元和胶质细胞的细胞质当中,颅脑损伤后随时间的推移,胞质染色逐渐变深,显示出了Nrf2在神经元和胶质细胞受到氧化应激后由细胞质转移到细胞核的过程,这与Nrf2调控的基因表达方式相符[6]。
除了颅脑损伤中证实Nrf2-ARE被激活外,其他中枢神经系统的氧化应激中疾病中也发现了Nrf2-ARE通路能够发挥保护作用[7-9]。Nrf2作为一种重要的抗氧化转录因子,其调控的一系列抗氧化酶在机体内组成一个强大的防御体系。本实验制作了大鼠缺氧预处理模型,来研究激活Nrf2-ARE通路的可行性方案,相对于其他预处理方式,缺氧预处理具有安全,可操作,可重复性,HP组的检测结果也证实了短暂的缺氧处理对皮层Nrf2和HO-1的表达无影响,但缺氧预处理也有一些缺点,本实验中选择在连续3 d缺氧结束后1 d进行颅脑打击伤,显示出缺氧预处理对皮层的保护作用,但预处理结束后超过一定的时间窗其保护保护效果可能就会消失;另外个体间存在一点的差异,同一预处理条件下,机体的耐受性可能也不相同。
本实验从氧化应激的角度研究了缺氧预处理对颅脑损伤后抗氧化酶的表达影响,短暂的缺氧预处理提高了颅脑损伤大鼠皮层脑组织Nrf2、HO-1抗氧化酶的表达,增加了颅脑损伤后脑组织抗氧化应激的能力,因此从事一些高原及重大危险的工作时,事先进行短暂缺氧训练,通过激发机体抵抗外界的不利刺激的潜力,提高自我防范风险的能力。
[1]Hatic H,Kane MJ,Saykally JN,et al.Modulation of transcription factor Nrf2 in an in vitro model of traumatic brain injury[J].J Neurotrauma,2012,29(6)∶1188-1196.
[2]Yan W,Wang HD,Hu ZG,et al.Activation of Nrf2-ARE pathway in brain after traumatic brain injury[J].Neurosci Lett, 2008,431(2)∶150-154.
[3]Obrenovitch TP.Molecular physiology of preconditioning induced brain tolerance to ischemia[J].Physiol Rev,2008,88 (1)∶211-247.
[4]Huang XS,Chen HP,Yu HH,et al.Nrf2-dependent upregulation of antioxidative enzymes∶a novel pathway for hypoxic preconditioning-mediated delayed cardioprotection[J]. Mol Cell Biochem,2013,Sep 19.[Epub ahead of print].
[5]疏龙飞,刘家传,王金标,等.缺氧预处理对颅脑损伤大鼠抗氧化应激和神经功能的影响[J].中华神经医学杂志,2014,13 (6)∶576-580.
[6]Bryan HK,Olayanju A,Goldring CE,et al.The Nrf2 cell defence pathway∶Keap1-dependent and-independent mechanisms of regulation[J].Biochem Pharmacol,2013,85(6)∶705-717.
[7]孟华星,郭军红,严澎.重组人促红细胞生成素对急性脑缺血大鼠Nrf2及HO-1表达的影响[J].中华神经医学杂志,2012, 11(2)∶134-137.
[8]Wang Z,Ma C,Meng CJ,et al.Melatonin activates the Nrf2-ARE pathway when it protects against early brain injury in a subarachnoid hemorrhage model[J].J Pineal Res,2012,53 (2)∶129-137.
[9]Tanji K,Maruyama A,Odagiri S,et al.Keap1 is localized in neuronal and glial cytoplasmic inclusions in various neurodegenerative diseases[J].J Neuropathol Exp Neurol, 2013,72(1)∶18-28.
Expression changes of Nrf2 and HO-1 in rat cortex following traumatic brain injury after hypoxic preconditioning
Shu Lon gfei,L iu Jiachuan,Wang Jinb iao,Zhang Yon gmin g,Zhang Xin g,Yang Yanyan,Ma Tao,Sun Wenjiang,Z huo Jianwei.
Department of Neurosurgery,the No.105 Hospital of PLA,Hefei,Anhui 230031,China
Liu Jiachuan,Email:ljc571017@sina.com
ObjectiveTo investigate the expression changes of nuclear factor erythroid 2-related factor 2(Nrf2)and heme oxygenase-1(HO-1)in rat cortex following traumatic brain injury after hypoxic preconditioning.MethodsTwo hundred and sixteen adult male Sprague Dawley rats were randomly divided into control group(Con),hypoxic preconditioning group(HP),traumatic brain injury group(TBI)and hypoxic preconditioning+traumatic brain injury group(HP+TBI).Con and TBI groups had 12 rats respectively,TBI or HP+TBI group was subdivided into 8 groups according to sacrifice time points,namely group 1 h,3 h,6 h,12 h,24 h,3 d,7 d and 14d(n=12).TBI models were made by the Feeney’s improved equipment and hypoxic preconditioning models were made by Hypobaric chamber for 3 days(-50kPa、3 h/d).The expression of Nrf2 and HO-1 in the brain cortex was detected by immunohistochemistry and western blotting.ResultsThe expression of Nrf2 and HO-1 began to increase at 1 h, reached the peak at 24 h,and decreased slowly at 3 d after TBI.At the time points of 1 h to 7 d,the expression of Nrf2 and HO-1 in the HP+TBI or TBI group was significantly higher than those in the Con or HP group(p<0.05).After consecutive three days hypoxic preconditioning,the expression of Nrf2 and HO-1 had no significant difference between HP and Con groups,but the expression of Nrf2 and HO-1 in the HP+TBI group was higher than those in the TBI group from 1 h to 7 d(p<0.05).ConclusionHypoxic preconditioning up-regulates the expression of Nrf2 and HO-1 in the brain cortex,which enhances the anti-oxidative ability of brain after TBI.
2015-07-07)
(本文编辑:杨艺)
DOI∶10.3877/cma.j.issn.2095-9141.2015.04.009
全军医学科技“十二五”科研项目(面上)(CWS11J262);2009年度南京军区医学科技创新重点课题(09Z009)
23003l合肥,解放军第105医院神经外科
刘家传,Email:ljc571017@sina.com
疏龙飞,刘家传,王金标,等.缺氧预处理对颅脑损伤大鼠皮层Nrf2、HO-1表达变化的影响[J/CD].中华神经创伤外科电子杂志,2015,1(4)∶227-231.
