二苯乙烯苷对低氧肺动脉平滑肌细胞增殖的影响
2015-06-13张志勇杨水珍
张志勇 杨水珍
二苯乙烯苷对低氧肺动脉平滑肌细胞增殖的影响
张志勇 杨水珍
目的 探讨二苯乙烯苷对低氧肺动脉平滑肌细胞(PASMCs)增殖的影响及其机制。 方法 SD大鼠PASMCs经低氧及TSG干预24h后, CCK-8检测细胞增殖及TSG的细胞毒作用,流式细胞仪分析细胞周期,实时定量PCR(RT-PCR)检测HIF-1α mRNA的表达,酶标仪检测活性氧(ROS)的产生。结果 二苯乙烯苷能够抑制低氧PASMCs增殖,阻滞细胞周期于G0/G1~S期,并且实验浓度的二苯乙烯苷无明显细胞毒作用,进一步的研究发现二苯乙烯苷能够抑制HIF-1α mRNA的表达及ROS的产生。结论 二苯乙烯苷可抑制低氧PASMCs增殖,其机制可能与抑制HIF-1α mRNA的表达及ROS产生有关。
低氧 肺动脉平滑肌细胞 二苯乙烯苷 增殖
低氧肺血管结构重构是慢性低氧肺动脉高压的重要病理生理基础,其对低氧肺动脉高压的发生、发展以及预后具有重要意义。低氧肺动脉平滑肌细胞(PASMCs)的异常增殖、迁移以及细胞外基质的异常沉积,可导致肺血管壁变厚、管腔狭窄顺应性降低是导致肺血管重构的基础,低氧肺血管重构的机制目前尚未完全阐明[1,2]。二苯乙烯苷(2,3,5,4-tetrahydroxyl diphenylethylene-2-o-glucoside,TSG)是从中药何首乌分离的一种主要有效活性成分单体,研究表明TSG可通过调节NO、血管内皮生长因子、MMP-2/9等的表达,抑制血管的内膜增厚及脂质沉积[3,4]。研究还发现,TSG通过调节ERK1/2和NO/cGMP/PKG信号通路,抑制血管平滑肌细胞(VSMCs)增殖,起到抑制动脉粥样硬化的作[5,6]。有关TSG在低氧PASMCs增殖中的作用及其机制未见相关研究。本研究通过观察低氧条件下TSG对大鼠PASMCs增殖影响,从细胞水平探讨TSG对低氧肺血管重构的影响及其机制。
材料与方法
1.材料:SD大鼠(150~200g)购自武汉大学实验动物中心;Ⅰ胶原酶、溴化乙锭(PI)、RNA酶、DCFH-DA购自Sigma公司; CCK-8试剂盒购自碧云天生物科技有限公司;DMEM/F12培养基、0.25%胰酶、双抗(青霉素+链霉素)、胎牛血清等购自Hyclone公司; HIF-α抗体以及GAPDH抗体购自Cell Signaling Technology公司。低氧培养箱购自Coylab公司,荧光酶标仪购自Bio-Tek公司。
2.SD大鼠PASMCs原代培养:采用0.2% Ⅰ胶原酶消化分离PASMCs,细胞传至第3代时经SM-α-actin免疫细胞化学染色法进行血管平滑肌细胞鉴定(纯度>95%),使用0.25%的胰酶消化PASMCs并以1∶2的比例传代,4~10代细胞生长稳定用于本研究。
3.实验分组:①空白对照组;②低氧组;③10μmol/L TSG低氧组;④20μmol/L TSG低氧组;⑤50μmol/L TSG低氧组。常氧组采用95%空气+5%CO2培养,低氧培养采用低氧培养采用 3%O2、92%N2和 5%CO2培养,当细胞融合度达到70%左右时,采用不含血清的培养基饥饿细胞24h,完全排除血清的影响后,分别进行常氧或低氧培养,其中TSG干预组给予不同浓度的TSG预处理2 h后进行低氧培养。
4.PCR检测HIF-1α:细胞生长于6孔板,冷PBS洗涤两次,每孔加入1ml TRIzol提取细胞的总RNA,采用紫外分光光度法测定其含量与纯度。 取大约5μl总RNA,使用罗氏反转录试剂盒反转录为cDNA。PCR扩增后采用GAPDH比较得出标准化值。引物序列为:GAPDH:上游引物:5′-GACATGCCGCCTGGAGAAAC-3′,下游引物:5′-AGCCCAGGATGCCCTTTAGT-3′;HIF-1α:上游引物:5′-GTCGGACAGCCTCACCAAACAGAGC-3′,下游引物:5′-GTTAACTTGATCCAAAGCTCTGAG-3′。
5.CCK-8检测细胞增殖及细胞毒作用:将细胞接种至96孔板中,各组低氧或常氧培养24h后,每孔加入10μl CCK-8溶液,继续在培养箱中孵育3h,测定450nm吸光度。
6.细胞周期检测:细胞接种至6孔板中,各组低氧或常氧培养24h后,胰酶消化并收集细胞,70%乙醇(无水乙醇+PBS)于4℃固定过夜。1500r/min离心5min,1ml的PBS洗细胞2次, 加入485μl PBS重悬细胞、Triton X-100 1μl、1mg/ml RNase 5μl、 1mg/ml溴化乙锭(PI)10μl,4℃避光孵育30min后,通过流式细胞仪分析细胞周期。
7.ROS的检测:将细胞以100μl,5×103/孔均匀接种于96孔板中,置于培养箱培养,细胞融合度达到70%时,将培养基更换为无血清的培养基饥饿24h,然后采用不同处理因素干预24h,将96孔板中的培养基换为用无血清培养液稀释终浓度为10μmol/L DCFH-DA,继续孵育20min之后将培养基吸出,使用无血清细胞培养液洗涤细胞3次,以排除未进入细胞内部的DCFH-DA的影响,最后再次加入磷酸盐缓冲液(PBS)100μl,置于酶标仪下检测,激发光波长为485nm,发射光波长为525nm。
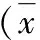
结 果
1.TSG能够抑制低氧PASMCs增殖:低氧刺激24h能够促进PASMCs增殖 (P<0.05),TSG(10、20、50μmol/L)抑制低氧诱导的PASMCs增殖具有浓度依赖性(P<0.05,图1)。
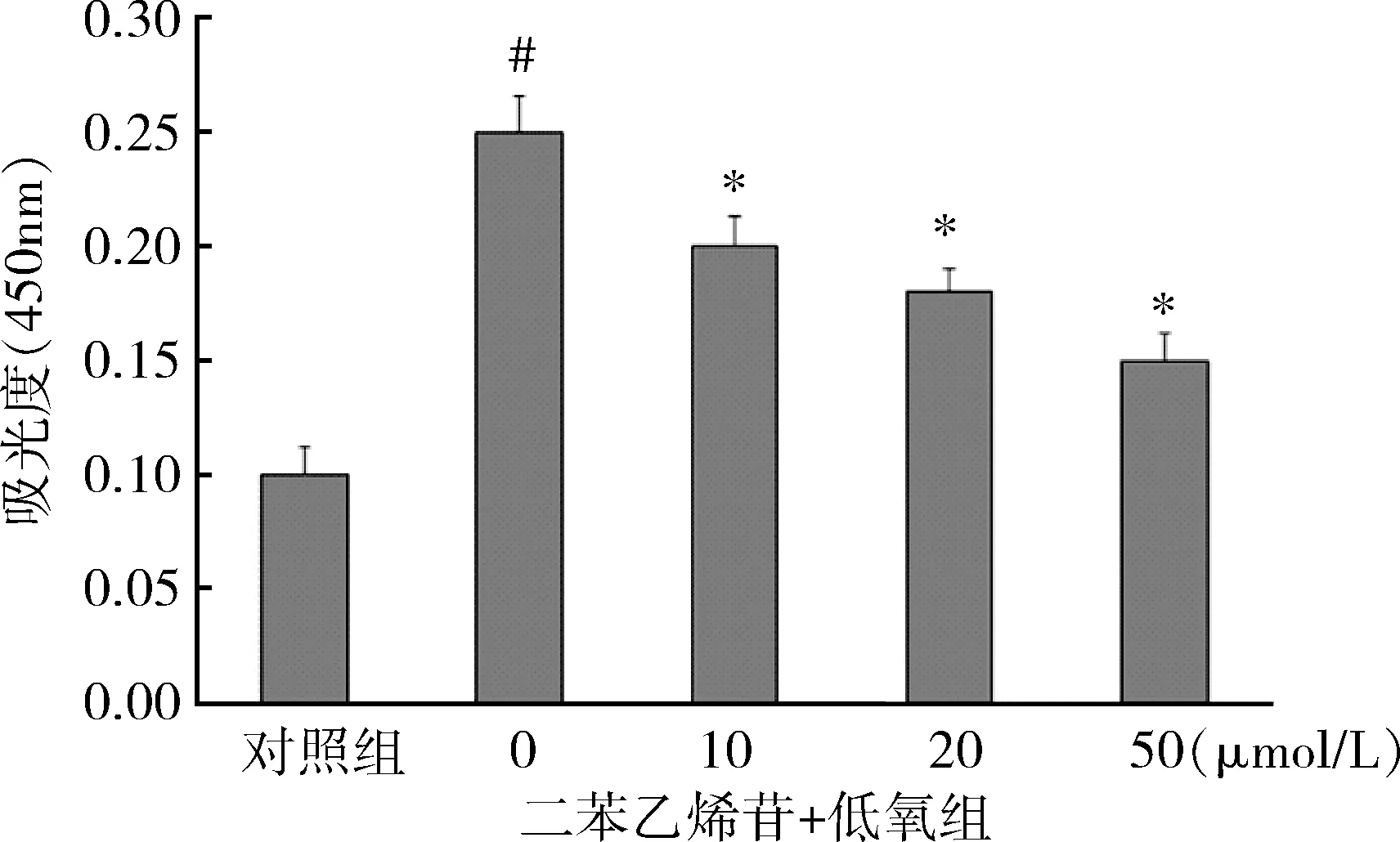
图1 TSG对低氧PASMCs增殖的影响(n=6)与对照组比较,#P<0.05,与0μmol/L二苯乙烯苷+低氧组比较,*P<0.05
2.TSG对PASMCs存活率无影响:结果显示,与对照组相比,3种药物浓度(10、20、50μmol/L)二苯乙烯苷干预24h对PASMCs的存活率差异无统计学意义(P>0.05,图2)。
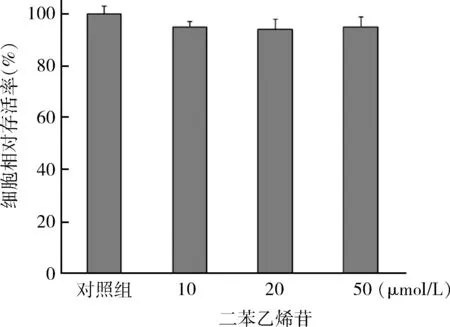
图2 TSG对PASMCs存活率的影响(n=6)
3.TSG可抑制PASMCs细胞周期于G0/G1期:低氧刺激PASMCs 24h后,处于G0/G1细胞比例减少,S期细胞比例增加,G2/M期细胞比例增加。与0μmol/L二苯乙烯苷+低氧组相比TSG(10、20、50μmol/L)可使G0/G1细胞比例增加,S期细胞比例增加(P<0.05),对G2/M期细胞比例无明显影响(P>0.05)。结果表明TSG可阻滞PASMCs细胞周期于G0/G1(图3)。
图3 TSG对PASMCs细胞周期的影响(n=6)
4.TSG可抑制HIF-1α mRNA的表达:与对照组相比,低氧刺激PASMCs 24 h后,PASMCs内HIF-1α mRNA的表达增加(P<0.05)。与0μmol/L二本乙烯苷+低氧组相比,TSG(10、20、50μmol/L)可抑制PASMCs内HIF-1α mRNA的表达,且具有浓度依赖性(P<0.05,图 4)。
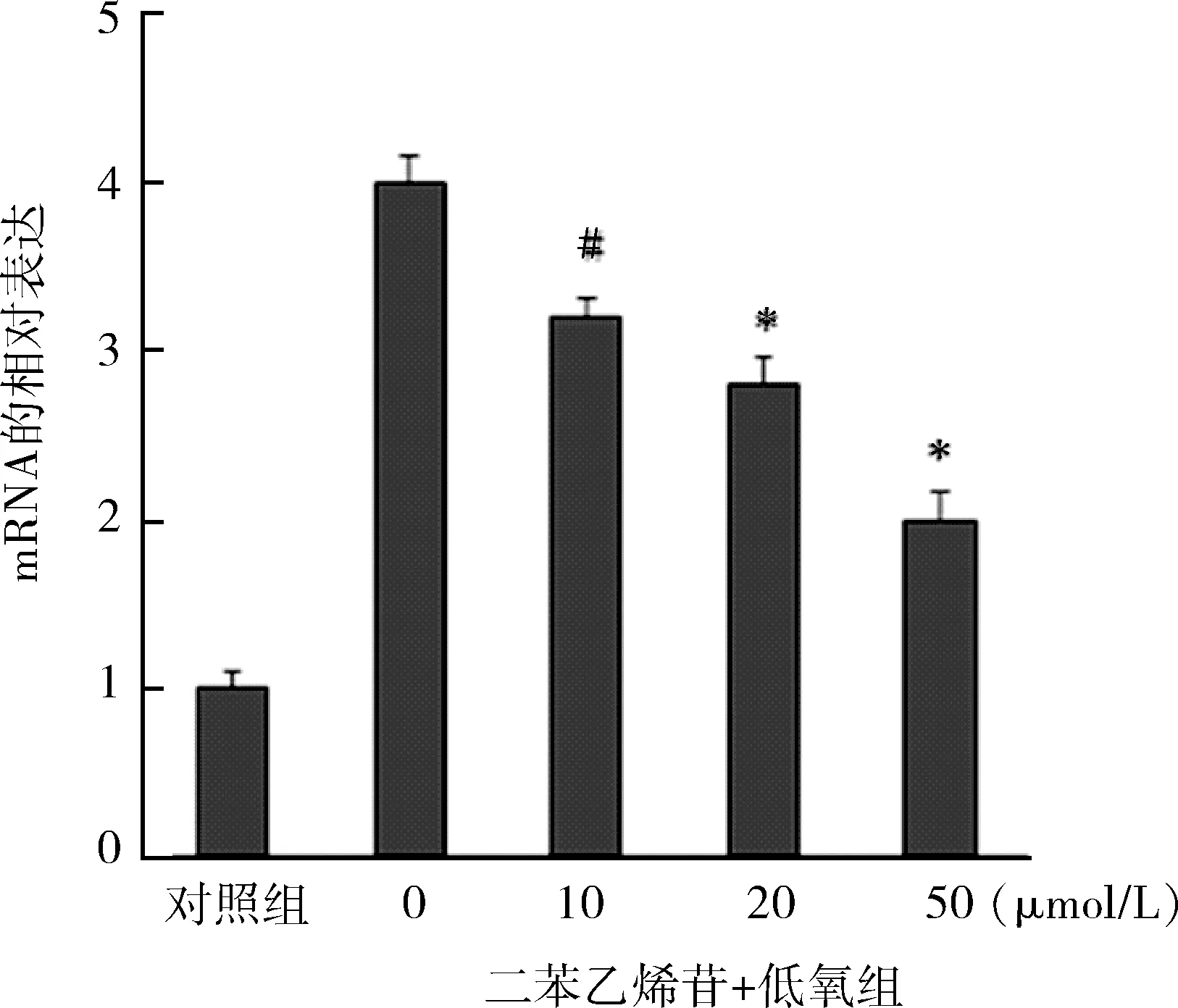
图4 TSG对HIF-1αmRNA的表达的影响(n=6)与对照组比较,#P<0.05;与0μmol/L二苯乙烯苷+低氧组比较,*P<0.05
5.TSG可抑制ROS产生:与对照组相比,低氧刺激PASMCs 24h后,PASMCs内ROS增加(P<0.05),与0μmol/L二苯乙烯苷+低氧组相比,TSG(10、20、50μmol/L)可抑制PASMCs内ROS产生,且具有浓度依赖性(P<0.05,图 5)。
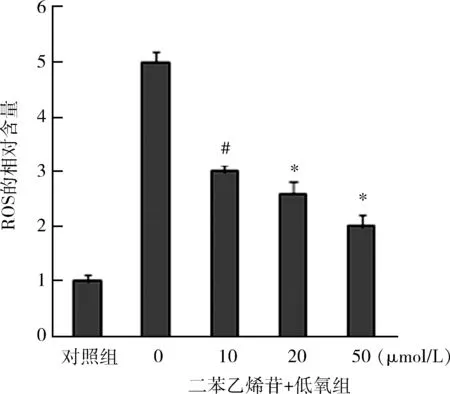
图5 TSG对ROS产生的影响(n=6)与对照组比较,#P<0.05;与0μmol/L二苯乙烯苷+低氧组比较,*P<0.05
讨 论
本研究发现, TSG抑制低氧PASMCs增殖,并且实验浓度的TSG对PASMCs无明显毒性作用。本研究还表明TSG是通过阻滞细胞周期于G0/G1期抑制低氧PASMCs增殖。进一步的研究表明,TSG抑制PASMCs增殖的机制是通过降低细胞内HIF-1α表达及ROS产生来实现的。这些结果提示,TSG可抑制PASMCs增殖,继而低氧肺血管重构。
低氧能够使肺动脉壁各层细胞一系列结构和功能的变化,尤其是中膜层PASMCs的异常增殖在低氧肺血管重构中发挥关键作用[7,8]。细胞增殖受细胞周期的严格调控,正常生理情况下PASMC处于静止G0期,肺血管重构时需要处于静止G0期PASMCs进入和通过细胞周期各阶段[9]。本研究表明TSG可抑制PASMCs细胞周期于G0/G1期,从而抑制低氧PASMCs增殖。
HIF-1是低氧条件下广泛表达于哺乳动物和人体的一种转录因子,由一个由调节性亚基HIF-1α和一个构成性亚基HIF-1β组成,HIF-1α决定HIF-1的活性,HIF-1α常氧条件下会经泛素途径降解而丧失活性,低氧时HIF-1α表达上调,并进入细胞核与HIF-1β结合形成二聚体后调节相关靶基因的转录,是细胞适应低氧的核心调控因子,与低氧性肺动脉高压和肺动脉平滑肌细胞增殖关系密切[10]。HIF-1α可增加细胞内Ca2+浓度的以及调节多种活性介质的表达,进而刺激肺动脉平滑肌细胞增殖[11]。活性氧族(reactive oxygen species, ROS)是起源于线粒体呼吸链和电子传递链的反应分子和自由基,作为细胞内信号分子,参与细胞增殖及凋亡的调控。低氧条件下PASMCs内ROS产生增加,运用抗氧化剂清除ROS,可以抑制低氧PASMCs增殖[12]。研究表明ROS可能是通过调节HIF-1α表达及活性来调控低氧PASMCs增殖[12,13]。另外ROS还可以通过调控ERK1/2信号通路促进低氧PASMCs增殖[14]。本研究发现低氧能够促进PASMCs 内HIF-1α mRNA的表达及ROS产生,而TSG可抑制PASMCs内HIF-1α mRNA的表达及ROS产生。因此,推测TSG抑制低氧PASMCs增殖机制可能与抑制HIF-1α mRNA的表达及ROS产生有关。TSG有可能对低氧肺血管重构起到抑制作用。
1 Luo C, Yi B, Bai L,etal. Suppression of Akt1 phosphorylation by adenoviral transfer of the PTEN gene inhibits hypoxia-induced proliferation of rat pulmonary arterial mooth muscle cells [J]. Biochem Biophys Res Commun, 2010, 397(3): 486-492
2 Leggett K, Maylor J, Undem C,etal. Hypoxia-induced migration in pulmonary arterial smooth muscle cells requires calcium-dependent upregulation of aquaporin 1 [J]. Am J Physiol Lung Cell Mol Physiol, 2012, 303(4): L343-L353
3 Zhang W, Xu XL, Wang YQ,etal. Effects of 2,3,4′,5-tetrahydroxystilbene 2-O-beta-D-glucoside on vascular endothelial dysfunction in atherogenic-diet rats [J]. Planta Med, 2009, 75(11): 1209-1214
4 Zhang W, Wang CH, Li F,etal. 2,3,4′,5-Tetrahydroxystilbene-2-O-beta-D-glucoside suppresses matrix metalloproteinase expression and inflammation in atherosclerotic rats [J]. Clin Exp Pharmacol Physiol, 2008, 35(3): 310-316
5 Xu XL, Huang YJ, Chen XF,etal. 2,3,4′,5-tetrahydroxystilbene-2-O-β-D-glucoside inhibits proliferation of vascular smooth muscle cells: involvement of NO/cGMP/PKG pathway [J]. Phytother Res, 2012, 26(7): 1068-1074
6 Xu XL, Huang YJ, Wang YQ,etal. 2,3,4′,5-Tetrahydroxystilbene-2-O-β-d-glucoside inhibits platelet-derived growth factor-induced proliferation of vascular smooth muscle cells by regulating the cell cycle [J]. Clin Exp Pharmacol Physiol, 2011, 38(5): 307-313
7 Yi B, Cui J, Ning J,etal. Over-expression of PKGIα inhibits hypoxia-induced proliferation, Akt activation, and phenotype modulation of human PASMCs: the role of phenotype modulation of PASMCs in pulmonary vascular remodeling [J]. Gene, 2012, 492(2): 354-360
8 易斌,陆俊羽,白莉,等. 野生型蛋白激酶GIα腺病毒抑制低氧肺动脉平滑肌细胞表型转换及细胞增殖 [J]. 中华内科杂志, 2010, 49(5): 385-388
9 Fouty BW, Grimison B, Fagan KA,etal. p27(Kip1) is important in modulating pulmonary artery smooth muscle cell proliferation [J]. Am J Respir Cell Mol Biol, 2001, 25(5): 652-658
10 李炽观,戴爱国,严鹏科.低氧诱导因子l在低氧致肺动脉平滑肌细胞增殖中的作用[J].中国病理生理杂志, 2007,23(7):1301-1305
11 Aaronson PI. TRPC Channel upregulation in chronically hypoxic pulmonary arteries: the HIF-1 bandwagon gathers steam[J]. Circ Res, 2006, 98(12): 1465-1467
12 Zhao J,Zhou Z,Hu H,etal. The relationships among reative oxtgen species,hypoxic factor lαand cell proliferation in rat pulmonary arterial smooth muscle cells Unner hypoxic [J]. Physiologica Sinica, 2007, 59(3): 319-324
13 Sanders KA, Hoidal JR. The NOX on pulmonary hypertension [J]. Circ Res, 2007, 101(3): 224-226
14 汤娜娜, 刘先胜,徐永健, 等. 活性氧和ERKl/2信号通路在缺氧大鼠肺动脉平滑肌细胞增殖和凋亡中的作用[J]. 中国病理生理杂志, 2009, 25(1):36-41
(修回日期:2015-02-26)
Effect of 2,3,4′,5-Tetrahydroxystilbene-2-O-beta-D-glucoside on the Proliferation of Pulmonary Artery Smooth Muscle Cells Induced by Hypoxia.
ZhangZhiyong,YangShuizhen.
ZhongxiangPeople′sHospital,Hubei431900,China
Objective To investigate the effects of the 2,3,4′,5-Tetrahydroxystilbene-2-O-beta-D-glucoside on the proliferation of PASMCs induced by hypoxia, in orde to search new drugs for the treatment and prevention of hypoxic pulmonary vascular remodeling. Methods 3% O2hypoxia was used to induced the proliferation of PASMCs. After hypoxic and TSG treatment for 24h, cell growth was determined by cell counting kit-8 (CCK-8), cell cycle was analysed by flow cytometry, the mRNA expression of HIF-1α was measured by quantitative real-time PCR, and the reactive oxygen species (ROS) production was determined by the fluorescence microplate reader. Results TSG can block the proliferation of PASMCs through G0/G1to S phase of the cell cycle arrest without cell cytotoxicity. Further experiments showed that TSG blocking the proliferation of PASMCs was associated suppression the mRNA expression of HIF-1α and the production of intracellular ROS in hypoxia- stimulated-PASMCs. Conclusion TSG can inhibit the proliferation of pulmonary artery smooth muscle cells induced by hypoxia through suppression the mRNA expression of HIF-1α and the production of intracellular ROS.
Hypoxia; Pulmonary artery smooth muscle cells; 2,3,4′,5-Tetrahydroxystilbene-2-O-beta-D-glucoside; Proliferation
431900 钟祥市人民医院耳鼻喉科(张志勇),呼吸科(杨水珍)
张志勇,电子信箱:zhangzhiyong2014@163.com
R3
A DOI 10.11969/j.issn.1673-548X.2015.10.043
2015-02-05)
