慢性丙型肝炎病毒感染治疗进展及展望
2015-06-13陈国凤
陈国凤 李 冰
慢性丙型肝炎病毒感染治疗进展及展望
陈国凤 李 冰
丙型肝炎病毒(hepatiti C virus,HCV)为单股正链RNA病毒,黄病毒属,人群普遍易感。主要传然源是丙型肝炎患者,主要传播途径有血液传播、性传播、母婴传播等。目前尚无针对HCV特异性预防疫苗,80%HCV感染者会转变为慢性感染。慢性HCV感染具有隐匿性、进展性等特点,30~50年后可能进展为肝硬化或者肝癌。在发生率或流行率持续维持高水平的国家中,由于HCV导致的相关性肝硬化及肝细胞癌患者人数逐年增加,给患者家庭乃至整个社会带来非常沉重的负担。
据2013年全球数据调查显示,全球慢性HCV感染者大约为(1.3~1.8)亿,患者数量排名前31位的国家及地区的患者总数合计占全球总数的80%,中国与其他5个国家的患者人数总和占全球患者的50%[1]。2014年最新调查表明中国慢性HCV患者人数大约为1000万[2]。在中国患者癌症病因调查中发现,HCV已经继乙肝病毒之后成为导致中国肝细胞癌的另一个重要因素[3]。有效的抗病毒治疗既可以降低慢性丙肝患者作为传染源发生HCV传染的风险,又是阻止病情进展、减少肝硬化及肝癌发生的有效手段。所以,对于慢性丙型肝炎来讲,无论是治疗还是预防,清除病毒都是核心。
一、干扰素为基础的抗病毒治疗进展
1. 治疗方案:HCV是1989年由美国科学家Houghton等利用分子生物学技术克隆测序并正式命名,此后便开始应用干扰素(IFN)治疗慢性丙型肝炎的探索之路。起初应用普通干扰素300万IU每周3次皮下注射24~78周,持续病毒学应答率(SVR)仅有20%[4,5]。1998年McHutchison等开始应用干扰素联合利巴韦林(RBV)抗病毒治疗,SVR上升至40%~80%以上[6,7]。自2000年以后聚乙二醇干扰素(PEG-IFN)联合利巴韦林抗病毒治疗方案(P-R方案),SVR得以进一步提升。抗病毒疗效与HCV基因分型密切相关。HCV基因分型可分为1~6型。中国大陆患者以基因1b型为主,约占70%,其次为2a型,占10%~30%[8]。香港地区基因1b型为主,但基因6a型占第2位,约14%。由于人口流动性大,献血、吸毒等不同传播因素影响病毒流行病学,导致某些边境地区病毒基因型分布复杂。总体来说,基因2型、3型HCV对干扰素治疗效果好于其他基因型。抗病毒药物应用方案,见表1。PEG-IFN-α或普通IFN与RBV联合疗法,均优于单用IFN。因此,如无RBV的禁忌证,均应采用联合疗法。干扰素和利巴韦林的用药禁忌证见表2。

表1 抗病毒药物应用方案
*体重≤75kg者 1000mg/d,体重>75kg者1200mg/d;**体重≤65kg者800mg/d;体重66~85kg者1000mg/d;体重86~105kg者1200mg/d;体重>105kg者1400mg/d。#没有条件使用聚乙二醇干扰素(PEG-IFN)者,也可使用普通IFN-α (300~500)万IU,肌内注射3次/周
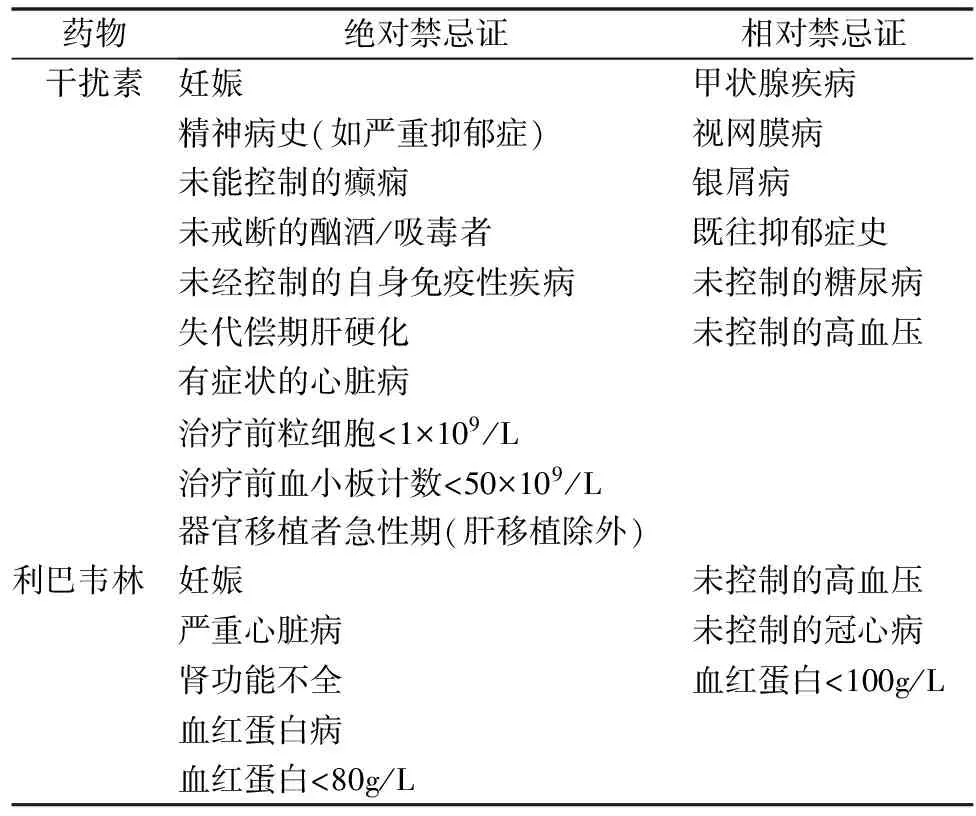
表2 干扰素、利巴韦林应用禁忌证
2. 抗病毒治疗应答:(1)生化学应答:肝功能指标如ALT和AST恢复正常。(2)病毒学应答:HCVRNA作为检测抗病毒治疗应答效果的指标,不同试剂检测敏感度有差异,国际上公认的敏感度较高的HCV RNA检测试剂最低检测值可达到<15IU/ml。①快速病毒学应答(RVR):指治疗4周时检测血清HCV RNA低于最低检测值;②早期病毒学应答(EVR):指治疗12周时检测血清HCV RNA低于最低检测值;③治疗结束时病毒学应答(ETVR):治疗结束时检测血清HCV RNA低于最低检测限;④部分应答(PR):治疗12周时定量检测HCV RNA虽未低于最低检测值,但较基线降低2个对数级(log)以上,为部分EVR(pEVR);⑤持续病毒学应答(SVR):治疗结束至少随访24周时,检测HCV RNA低于最低检测限。获得RVR或EVR者SVR较高,因此取得RVR或EVR可作为预测SVR的指标;⑥无应答(NR):指从未获得EVR(pEVR)、ETVR及SVR者;⑦复发(relapse):指治疗结束时检测HCV RNA低于最低检测值,但停药后HCV RNA变为阳性;⑧病毒突破(breakthrough):治疗期间曾有HCV RNA载量降低或低于最低检测值,但尚未停药即出现HCV RNA上升或阳转。(3)组织学应答:指肝组织病理学指标,如肝脏炎症坏死和纤维化的改善情况,可采用国内外通用的肝组织分级(炎症坏死程度)、分期(纤维化程度)或半定量计分系统来评价。(4)其他检测指标:肝纤维化改善可通过无创肝纤维化检测工具如肝脏瞬时弹性检测值(fibroscan)定期检测肝脏硬度值(liver stiffness measurement, LSM)。

4.治疗过程中安全性监测及停药标准:因干扰素和利巴韦林都有一些不良反应,故用药期间除定期检测HCV RNA外,还应该定期检测血常规、肝肾功能、甲状腺功能等。发现异常应根据具体情况进行相应处理。(1)中性粒细胞绝对值降至0.75×106/ml或血小板计数降至50×106/ml时,PEG-IFN-α应减量;中性粒细胞绝对值降至0.5×106/ml或血小板计数降至25×106/ml时,以及发生重度抑郁症时PEG-IFN-α应停用; 一旦粒细胞计数或血小板计数回升,可继续应用PEG-IFN-α治疗,但应减量,并密切监测。(2)如果血红蛋白降至100g/L以下,RBV剂量应减量600mg/d;如血红蛋白降至85g/L以下,应停用RBV治疗。(3)重型肝炎及严重败血症患者应停止治疗。(4)有过抑郁病史或有明显抑郁症状的患者,在治疗前应请精神科医生会诊,根据情况采取抗抑郁治疗;严重抑郁症及有自杀倾向者须及时停药并采取相应治疗措施。(5)任何HCV基因型,在治疗12周时HCV RNA下降水平低于2lgIU/ml,或在治疗24周时仍可检测到HCV RNA(检测敏感度为<15IU/ml),预测获得SVR概率极低,应停止治疗。
5.获得SVR后随访:(1)获得SVR的慢性丙肝患者,应在治疗结束后48周和96周复查ALT和HCV RNA,如ALT复常,HCV RNA持续低于最低检测值可解除医学随访。(2)获得SVR的肝硬化患者,除上述监测外还应每1~2年监测食管胃底静脉,每6个月超声检查和检测AFP监测肝癌。
6.难治性丙肝患者治疗:广义的难治性丙肝患者既包括P-R治疗应答不佳,干扰素、利巴韦林不能耐受等情况,也涵盖丙肝肝硬化患者以及合并糖尿病、自身免疫性肝病以及失代偿期肝硬化等干扰素使用禁忌证等情况。由于我国仍存在人口基数庞大、各地区卫生、经济发展水平参差不齐、民众对HCV认识不足等实际情况,故导致部分患者就诊时已进展为肝硬化,累计难治性丙肝患者绝对数量增多。故临床医生需要针对各种难治性丙肝的不同情况,制定个体化治疗方案。
经正规治疗未获得SVR的患者,包括无应答、复发、病毒突破,复发患者可考虑重复以上抗病毒治疗方案,并适当延长疗程。已经发展为肝硬化、严重肝纤维化,白细胞、血小板降低,或其他原因导致干扰素、利巴韦林耐受不佳患者,较为常见的做法包括:降低干扰素剂量、降低利巴韦林剂量、增加每次应用干扰素间隔时间、适当延长疗程;或者对血小板减少、贫血、白细胞计数减少等不利因素进行预先干预或治疗过程中干预等方法。但上述情况应用P-R治疗获得SVR的可能性很低,可以考虑应用最新的全口服直接抗病毒药物(directed antivirus agents,DAAs)治疗。
二、直接抗病毒药物研究及应用
低分子抗病毒药物,亦称直接抗病毒药物(DAAs)。2011年美国食品药品监督管理局批准蛋白酶抑制剂Boceprevir(BOC), Telaprevir(TEL)上市,分别与P-R联合治疗,使基因1型初治慢性丙型肝炎患者SVR明显提高的报告,拉开了DAAs治疗丙型肝炎的帷幕[9,10]。
DAAs更新换代速度非常快,多种药物组合应用使得抗HCV治疗的SVR上升至90%~95%,而且从一种DAA联合P-R治疗发展为2~3种DAAs口服药物联合使用,可以不用干扰素,也不用利巴韦林,即可取得极高的SVR。2014年在欧美国家第1代蛋白酶抑制剂已经被更多的DAAs取代,其中就包括NS5B核苷酸聚合酶抑制剂Sofosbuvir(SOF)以及NS5A 复合型核苷酸聚合酶抑制剂Daclatasvir(DCV)。目前DAAs药物的研发主要针对HCV的非结构蛋白结构(图1)进行的。如针对NS3/NS4A的蛋白酶抑制剂,针对NS5A的抑制剂(DCV等);针对NS5B聚合酶抑制剂,包括核苷类(SOF等)和非核苷类。已经上市的各种药物组合方案也是基于不同的DAAs药物针对HCV不同的非结构蛋白合成酶的抑制剂组成的。
美国AASLD和欧洲的EASL、WHO均更新了慢性HCV感染的治疗指南,干扰素和利巴韦林均已经不作为常规、首选药物进行推荐。但在欧美发达国家也存在医保报销的问题,故综合患者收益与花费,P-R治疗仍可以作为一线治疗组合[11~15]。由于DAAs的研发进展非常快速、高效,所以,2015年的AASLD关于HCV的指南更新中特别强调由于丙肝治疗的不断进展,需要随时关注治疗建议更新。(1)基因1型,应考虑使用全口服DAAs治疗的患者范围如下:干扰素联合利巴韦林治疗不能取得SVR患者、干扰素不耐受、有干扰素应用禁忌证的HCV感染患者,失代偿肝病患者等。具体治疗方案如下:①吉利德Harvoni(sofosbuvir+lediprevir, SOF+LDV),疗程12周,SVR12 90%~95%;②艾博维3D(ABT-450,ABT-267,ABT-333)疗程12周,SVR12 90%~95%;③欧盟方案sofosbuvir+daclatasvir(SOF+DCV)。(2)基因1型,无条件采用全口服DAAs治疗的患者,可应用DAA联合P-R,但失代偿期肝硬化仍为禁忌。具体方案如下:①Telaprevir或Boceprevir联合P-R治疗,效果优于P-R治疗。但其疗程仍需要40周,SVR率仅60%左右;②Simeprevir联合P-R治疗,推荐用于HCV基因型1b者及无Q80K多形性(without the Q80K polymorphism)的1a者,效果优于PEG-IFN-α联合RBV治疗;③SOF联合P-R:初治患者SVR达90%。(3)基因2型患者,可使用Sofosbuvir联合RBV治疗12周,效果优于P-R治疗24周。也可以使用SOF+LDV或SOF+DCV治疗,效果更佳。
三、中国患者使用DAAs治疗的经验
虽然国外DAAs治疗进行的如火如荼,文献报道各种基因型的慢性HCV感染患者,应用DAAs治疗12~24周,均取得良好效果。但在国内DAAs治疗慢性HCV感染的大幕还没有正式拉开。由于相应法规限制,DAAs药物在中国大陆还没有被批准上市,考虑到价格等问题,预估正式上市时间不会早于2017年。国外报道的数据及经验中,不论是BOC或是SOF及其他的DAAs,大多以初治患者为主。所以对于已经发展至肝硬化的基因1b型、P-R治疗失败的经治患者,应用DAAs药物治疗有效率及安全性仍有待进一步验证,而这部分患者却最有可能因为失代偿肝硬化及肝癌发生率明显偏高而成为DAAs国内上市后第1批使用的患者,所以我们应该在DAAs国内上市之前就为他们优选出最适合的方案。这个适合方案,既包括疗效,也包括安全性指标,同时还要关注到患者实际花费。基于这个目的,我们利用国际合作机会也开展了小规模的real-life(真实世界)临床观察。
32名中国的基因1b型既往P-R治疗失败的慢性丙肝经SOF联合P-R治疗12周,停药观察12周,总SVR12率50%(48周疗程P-R治疗组SVR率15%),SOF联合P-R治疗SVR明显高于P-R再次治疗组,SVR的预测因素与P-R治疗一致。45例中国的基因1b型既往P-R治疗失败的慢性丙肝患者,经SOF+DCV治疗,疗程12周,抗病毒治疗7天71%(32/45)患者HCV RNA低于检测值(<15IU/ml),治疗28天100%(45/45)HCV RNA检测不到,SVR12为100%(27/27)。13名中国的基因2a型既往P-R治疗失败的慢性丙肝患者经SOF联合利巴韦林治疗12周,SVR12为85%(再次P-R治疗总SVR仅为24%)。上述临床观察中均未发生DAAs相关性严重不良事件。以上研究证明DAA类低分子抗病毒药物SOF、DCV应用于中国P-R经治患者疗效及安全性均较好。
虽然我们对难治性丙肝患者应用DAAs药物治疗的观察样本量不大,也不是严格的随机对照研究,但仍然可以看出DAAs药物抗病毒疗效好,而且安全性好、不良反应小,可用于各种原因导致的不能应用P-R治疗的患者。所以,在未来的几年,对慢性丙型肝炎来说,医务人员要做的不仅仅是治疗,而是必须治愈。
理论上讲所有慢性HCV感染人群都可以使用DAA药物进行抗病毒治疗。但在中国食品与药品监督管理局尚未批准DAA进入中国市场的前提下,P-R治疗仍是绝大多数中国患者的抗病毒方案。
四、展 望
当前,慢性丙型肝炎的治疗已经进入了病毒被彻底清除的时代。国外临床研究已证明,对于基因1型无肝硬化慢性丙肝患者,SOF/LDV治疗8周与12周疗程SVR相似(94% vs 95%)。随着研究病例及研究方案的不断增多和完善,将来可能还有更好的治疗方案,更多的治疗疗程彻底治愈慢性丙肝。尽管中国慢性丙型肝炎患者目前还不能在国内直接购买DAA类抗HCV药物,但随着我国医药卫生事业技术进步、国家医疗政策支持、患者、家属及医护人员的迫切需求等诸多因素的强有力推动,预计在不远的将来,中国丙肝患者一定会用上DAA类抗病毒药物,免于承受干扰素、利巴韦林的不良反应痛苦,实现丙肝的彻底根治。
HCV在血清及肝内清除可以使大多数慢性丙肝患者完全摆脱HCV的阴影。但是对于已经发展为严重肝纤维化甚至肝硬化的患者,尤其是年龄较大、患病时间较长的患者,尽管HCV的清除可以延缓或者阻止疾病进展,但仍有可能病情进展为肝癌。已经为肝硬化失代偿期的患者仍然会发生某些致命的并发症如消化道出血、昏迷等,所以,对于这类患者,在清除HCV后,未来治疗的重点将转为抗肝纤维化、预防肝癌及其他晚期并发症。
1 Hajarizadeh B, Grebely J, Dore GJ. Epidemiology and natural history of HCV infection[J]. Nat Rev Gastroenterol Hepatol, 2013, 10(9): 553-562
2 Wang FS, Fan JG, Zhang Z,etal. The global burden of liver disease: the major impact of China[J]. Hepatology, 2014, 60(6): 2099-2108
3 Chen JG, Zhang SW. Liver cancer epidemic in China: past, present and future[J]. Semin Cancer Biol, 2011, 21(1): 59-69
4 Davis GL, Balart LA, Schiff ER,etal. Treatment of chronic hepatitis C with recombinant interferon alfa. A multicenter randomized, controlled trial. Hepatitis Interventional Therapy Group[J]. N Engl J Med, 1989, 321(22):1501-1506
5 Poynard T, Bedossa P, Chevallier M,etal. A comparison of three interferon alfa-2b regimens for the long-term treatment of chronic non-A, non-B hepatitis. Multicenter Study Group[J]. N Engl J Med,1995, 332(22):1457-14626 McHutchison JG, Gordon SC, Schiff ER,etal. Interferon alfa-2b alone or in combination with ribavirin as initial treatment for chronic hepatitis C. Hepatitis Interventional Therapy Group[J]. N Engl J Med, 1998, 339(21) :1485-1492
7 Poynard T, Marcellin P, Lee SS,etal. Randomised trial of interferon alpha 2b plus ribavirin for 48 weeks or for 24 weeks versus interferon alpha2b plus placebo for 48 weeks for treatment of chronic infection with hepatitis C virus. International Hepatitis Interventional Therapy Group (IHIT)[J]. Lancet, 1998, 352(9138): 1426-1432
8 Lu L, Nakano T, He Y,etal. Hepatitis C virus genotype distribution in China: predominance of closely related subtype 1b isolates and existence of new genotype 6 variants[J]. J Med Virol, 2005, 75(4): 538-549
9 Poordad F, Mccone J Jr, Bacon BR,etal. Boceprevir for untreated chronic HCV genotype 1 infection[J].N Engl J Med, 2011, 364(13):1195-1206
10 Jacobson IM, McHutchison JG, Dushieiko G,etal. Telaprevir for previously untreated chronic hepatitis C virus infection[J]. N Engl J Med, 2011, 364(25):2405-2416
11 Im GY, Dieterich DT. Direct-acting antiviral agents in patients with hepatitis C cirrhosis[J]. Gastroenterol Hepatol, 2012, 8(11): 727-765
12 Lawitz E, Mangia D, Alessandra M. Sofosbuvir for Previously Untreated Chronic Hepatitis C Infection[J]. N Engl J Med, 2013, 368(20):1878-1887
13 Stefan Z, Geoffrey MD, Riina S, et al. Sofosbuvir and ribavirin in HCV genotypes 2 and 3[J]. N Engl J Med, 2014, 370(21):1993-2001
14 Pawlotsky JM. New hepatitis C therapies: the toolbox, strategies and challenges[J]. Gastroenterology, 2014, 146(5):1176-1192
15 Sulkowski MS, Gardiner DF, Rodriguez-Torres M,etal. Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection[J].N Engl J Med, 2014, 370(3):211-221
(修回日期:2015-06-05)
中华医学会临床专项基金资助项目(13071110496)
100039 北京,解放军第302医院肝纤维化诊疗中心
陈国凤,电子信箱:guofengchen302@163.com
陈国凤,主任医师,博士研究生导师。中国人民解放军第302医院肝纤维化诊疗中心主任。现任军队保健医学委员会委员、中央首长保健会诊专家、中华医学会肝病学分会肝纤维化学组委员。国家自然科学基金、浙江省自然科学基金项目评审专家。从事传染病临床工作30年,对各型慢性肝病、肝纤维化、肝硬化的诊断、鉴别诊断和治疗积累了丰富的经验。发表论文40余篇,其中SCI论文6篇。主编专业书籍2部,参编10部。获全军医疗成果三等奖4项。
R552
A DOI 10.11969/j.issn.1673-548X.2015.10.001
2015-05-27)
