镍在H2SO4溶液中钝化行为线性电位扫描法描述
2015-06-12巴晓微杨国程
巴晓微, 柳 翱, 李 默, 刘 颖, 杨国程
(长春工业大学 化学与生命科学学院,吉林 长春 130012)
0 引 言
金属及其制品与周围介质接触发生化学及电化学等作用而使其遭受破坏的现象称为金属的腐蚀[1]。金属发生腐蚀后显著影响了它的使用性能,其危害不仅是金属本身受损失,更严重的是金属结构遭破坏,所以,研究金属的腐蚀与防护以减缓和防止金属的腐蚀是一项非常有意义的工作[2]。研究金属腐蚀的方法因腐蚀机理的不同而不同。目前,金属的电化学防腐蚀方法主要有非金属保护层法、金属保护层法、阴极电保护法、阳极电保护法、缓蚀剂保护法等[3]。其中,阳极保护法在化工生产中被广泛应用,它是用阳极极化使金属钝化,防止金属腐蚀的方法。测定阳极极化曲线可以获得金属在介质中溶解腐蚀和钝化过程的信息,从而为金属的防护提供理论依据。
镍及其合金是广泛使用的耐腐蚀金属材料,同时也是不锈钢的主要组成成分,金属镍具有耐腐蚀性好、机械强度高等特点,广泛应用于电镀和制作合金等领域。因此研究镍的钝化具有十分重要的理论和实际意义。
线性电位扫描技术(Linear Sweep Voltammetry,LSV)[4]用于研究电极的电位随时间线性连续地变化,同时记录随电位改变而变化的瞬时电流,得到完整的极化曲线图。利用这种技术测定镍在硫酸溶液中的钝化行为,LSV图可以提供整个金属的阳极钝化曲线,分为4个区域:金属的正常溶解区、过渡钝化区、金属的钝化区以及超(过)钝化区。钝化曲线给出钝化电势E钝、钝化电流I钝,为评价镍在硫酸溶液中的钝化行为提供了重要的实验参数。文中利用CHI852D电化学工作站,采用线性电位扫描法测定镍在硫酸溶液中的钝化行为,研究氯离子浓度、扫描速率、溶液酸度、温度以及缓蚀剂等因素对镍钝化的影响。
1 实验部分
1.1 仪器与试剂
LSV实验均在CHI852D电化学工作站(上海辰华仪器公司)进行。电化学测试采用三电极系统,Ni电极为工作电极,Hg/Hg2SO4电极为参比电极,铂电极为辅助电极。H2SO4(北京化工厂)、丙酮(北京化工厂)及其它试剂均为分析纯。
1.2 实验方法
首先打开仪器和计算机的电源开关,预热10min。在测试之前,将Ni电极用金相砂纸打磨后,用丙酮洗涤除油,再用超纯水冲洗干净,吹干后放入装有H2SO4溶液的电解池中。放入铂电极和硫酸亚汞电极,接好测量线路。打开CHI电化学分析仪软件,设定参数后,系统自动进行测定Ni的阳极极化曲线。LSV测定条件:初始电位设定为比先前所测得的开路电位负0.1V,终止电位1.6V,扫 描 速 率0.01V·s-1,采 样 间 隔0.001V,初始电位下的极化时间300s,电流灵敏度0.01A。
2 结果与讨论
2.1 镍的阳极极化曲线图
Ni在0.1mol·L-1H2SO4溶液的阳极极化曲线如图1所示。
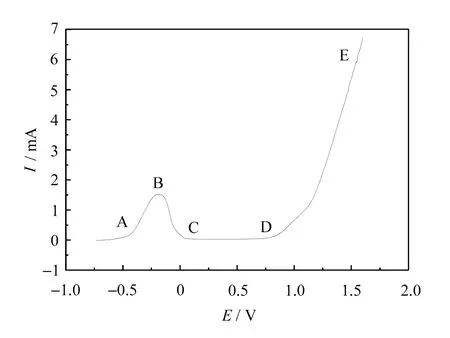
图1 Ni在0.1mol·L-1硫酸溶液中的钝化曲线
在曲线的AB段,电流随电势的增加而增大,这是金属的正常溶解区域,Ni处于活化状态,进行阳极溶解过程。当电势增至B点时,Ni表面开始钝化,由于金属表面开始形成钝化膜(氧化膜或氧的吸附层),金属的溶解速率很快减小,B点所对应的电势称为钝化电势(E钝),与此相应的电流叫钝化电流(I钝)。当电势到达C点时,Ni处于稳定钝态,CD段称为金属的钝化区。只要维持金属的电势在CD之间,金属就处于稳定的钝化状态,金属得到有效防护。D点以后,随着电势升高电流又继续增加,表示阳极又发生新的溶解反应。
2.2 Cl-的浓度对Ni钝化的影响
不同氯离子浓度对Ni在0.1mol·L-1硫酸溶液中钝化的影响如图2所示。

图2 不同氯离子浓度对Ni在0.1mol·L-1硫酸溶液中钝化的影响
从图2可以看出,随着氯离子浓度增加,I钝和E钝都增加,稳定钝化区间减小。这说明氯离子的存在阻碍镍表面钝化膜的生成,在一定电位下已形成的钝化膜将被破坏并出现活性金属区,这些活性金属区的优先溶解会形成部分小孔,即金属发生孔蚀。Cl-破坏钝化膜的途径有如下几种:Cl-与H2O和OH-在金属表面的竞争吸附阻碍了钝化膜的形成;Cl-通过氧化膜的裂缝或蚀孔进入金属表面;吸附的氯离子与膜中的金属离子形成氯化物并快速溶解;Cl-吸附在氧化膜表面并使氧化物胶化进而溶解[5]。
2.3 扫描速率对Ni钝化的影响
不同扫描速率下Ni在0.1mol·L-1硫酸溶液中极化曲线如图3所示。
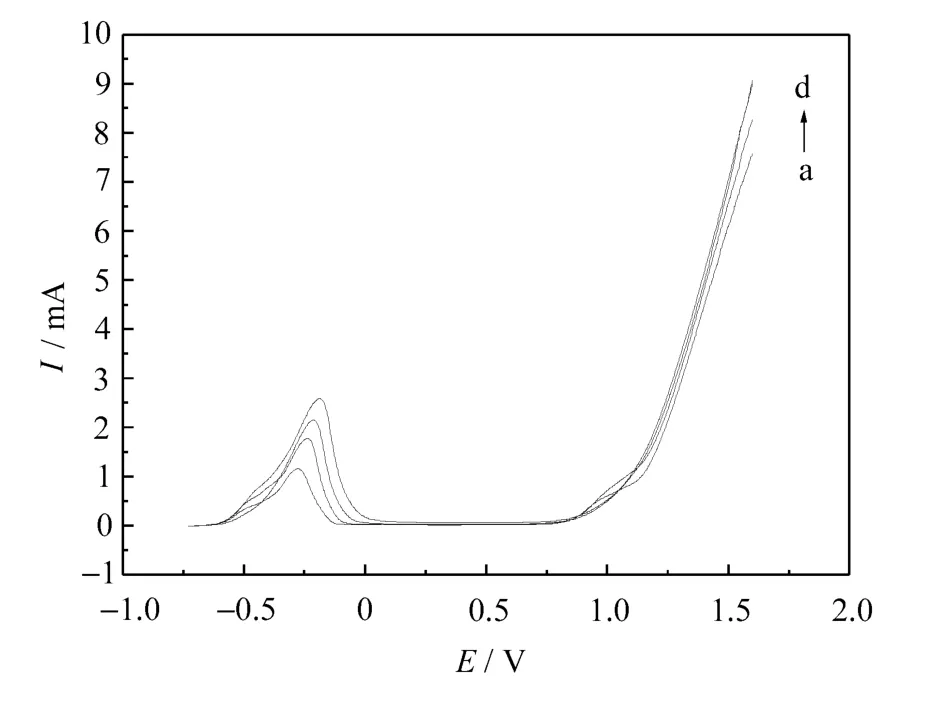
图3 不同扫描速率对Ni在0.1mol·L-1硫酸溶液中钝化的影响
从图3可以看出,随着扫描速率的增大,钝化电流逐渐增大,钝化电位逐渐正移,稳定钝化区间逐渐减小。扫描速率是影响测定阳极化曲线的重要因素。扫描速率越慢,极化越接近于静态,图线越完整清晰,但速率若太慢,一次实验时间太长,所以速率不能太慢。本实验选择扫描速率为10mV·s-1。
2.4 溶液酸度对Ni钝化的影响
Ni在不同浓度硫酸溶液中的极化曲线如图4所示。
随着酸度的增大,钝化电流逐渐增大,钝化电位逐渐负移,稳定钝化区间逐渐减小。
2.5 离子强度对Ni钝化的影响
不同电解质对Ni在0.1mol·L-1硫酸溶液中钝化的影响如图5所示。
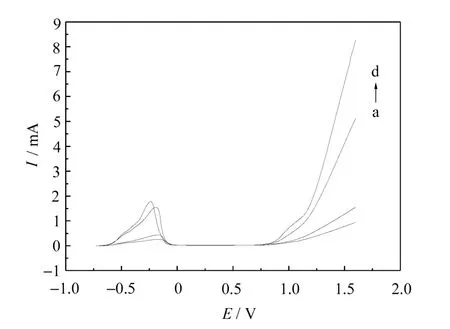
图4 Ni在不同浓度硫酸溶液中的钝化曲线

图5 不同电解质对Ni在0.1mol·L-1硫酸溶液中钝化的影响
随着电解质溶液离子强度的增大,阳极活性溶解电流逐渐增大,这可能是因为离子在镍电极表面的竞争吸附,阻碍了镍的钝化膜的形成,从而加速了金属的溶解。可见溶液离子强度的增大对金属镍的腐蚀有加速作用并可降低其钝化能力[6]。
2.6 温度对Ni钝化的影响
不同温度下Ni在0.1mol·L-1硫酸溶液中的极化曲线如图6所示。
从图6可以看出,温度升高,镍的钝化电位正移,这意味着金属镍在高温下不易进入钝化状态。随着温度升高,镍的稳定钝化区间迅速减小,其钝化电位正移,钝化电流也随温度升高而增加,这表明钝化膜在较高的温度下具有较差的化学稳定性。此外,温度升高也使得钝化膜的击穿电位向负的方向移动,即膜层更易于遭到破坏[7]。
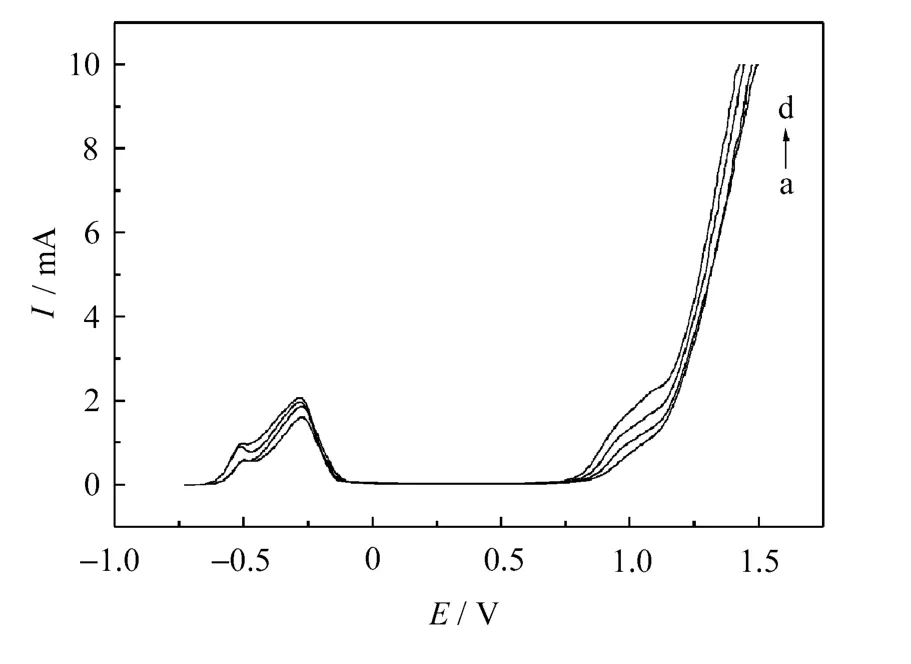
图6 不同温度下Ni在0.1mol·L-1硫酸溶液中的钝化曲线
2.7 缓蚀剂对Ni钝化的影响
不同浓度缓蚀剂Tw-80(吐温-80)对Ni在0.1mol·L-1硫酸溶液中钝化的影响如图7所示。

图7 不同浓度缓蚀剂Tw-8 0对Ni在0.1mol·L-1硫酸溶液中钝化的影响
从图7可以看出,Tw-80的存在导致氧化峰电流大幅度降低,这说明Tw-80对镍在硫酸溶液中腐蚀具有很好的抑制作用,Tw-80能使镍发生钝化。Tw-80对镍的钝化效果随Tw-80浓度的升高而增大。Tw-80对镍在硫酸溶液中的缓蚀作用主要是由于Tw-80吸附在镍表面形成吸附膜抑制镍的腐蚀行为。Tw-80结构中含有的双键可以和镍形成π-d键,杂原子O可与Ni形成配位键,从而可以增强分子的吸附能力,因此能在镍表面形成牢固的膜,阻止腐蚀介质与镍接触[8]。
3 结 语
线性电位扫描法研究镍在硫酸溶液中的钝化行为,具有快速、灵敏、数据处理方便等优点,是发展和筛选新型耐蚀合金及其金属镀层的重要手段。考察了溶液酸度、离子强度、氯离子浓度、温度、扫描速率、缓蚀剂等因素对镍钝化的影响。结果表明,增大酸度,钝化电流增大;增大离子强度,钝化电流增大;氯离子浓度越大,钝化电流越大,稳定钝化区越小,说明氯离子的存在影响镍表面钝化膜的生成,这种影响随着氯离子浓度的增加而增大;温度升高,钝化电流增加,加快腐蚀;扫描速率太慢或太快都不利于测试。Tw-80有助于镍的钝化,随Tw-80浓度的增大,镍亦愈容易进入钝化状态。
[1] 朱文涛,王军民,陈琳.简明物理化学[M].北京:清华大学出版社,2008.
[2] 曹楚南.腐蚀电化学原理[M].3版.北京:化学工业出版社,2008.
[3] 朱传征,褚莹,许海涵.物理化学[M].北京:科学出版社,2006.
[4] 徐家宁,朱万春,张忆华,等.基础物理化学实验(下册):物理化学和仪器分析实验[M].北京:高等教育出版社,2006.
[5] V P Grigorev,V M Kravchenko,I M Gershanova.Apparent activation energy of the anodic dissolution of nickel in sulfuric acid solutions in the presence of Cl-and SCN-ions[J].Protection of Metals,2004,40(3):214-219.
[6] J L Trompette,L Massot,H Vergnes.Influence of the oxyanion nature of the electrolyte on the corrosion passivation behaviour of nickel[J].Corrosion Science,2013,74:187-193.
[7] 程瑾宁,徐仲,胡会利,等.从动电位法研究镍的钝化行为实验改进谈大学化学实验改革[J].大学化学,2007,22(1):50-53.
[8] Gkhan Gece,Semra Bilgic.A theoretical study on the inhibition efficiencies of some amino acids as corrosion inhibitors of nickel[J].Corrosion Science,2010,52(10):3435-3443.
