白介素13受体α2在哮喘小鼠肺组织细胞内表达与气道重塑的关系
2015-06-12王正东姚汉清闵凌峰徐兴祥
王正东 姚汉清 闵凌峰 徐兴祥
·论著·
白介素13受体α2在哮喘小鼠肺组织细胞内表达与气道重塑的关系
王正东 姚汉清 闵凌峰 徐兴祥
目的探讨白介素13受体α2(IL-13Rα2)与气道重塑的的关系。方法用OVA腹腔注射致敏SPF级BALB/c小鼠,雾化吸入激发制作哮喘模型,同时予地塞米松腹腔注射干预,最后一次致敏后24 h处死小鼠,观察并测量肺组织形态学改变,用RT-PCR和免疫组化法分别检测小鼠肺组织中IL-13Rα2 mRNA和蛋白的表达及TGF-β1 mRNA表达。结果哮喘小鼠与对照组、地塞米松组小鼠比较,支气管管壁 (17.58±0.78)vs. (12.61±0.87)vs. (13.89±0.94)、平滑肌面积 (6.71±0.83)vs. (4.61±0.46)vs. (5.62±0.53)均明显增加,P<0.01,RT-PCR发现肺组织中IL-13Rα2 mRNA (0.670±0.183)vs. (0.075±0.058)vs. (0.262±0.138) 和TGF-β1 mRNA (0.704±0.168)vs. (0.317±0.140)vs. (0.358±0.098) 明显增高,P<0.01,免疫组化发现IL-13Rα2蛋白表达 (52.11±6.30)vs. (17.80±4.09)vs. (22.87±3.76) 明显增高,P<0.01。结论IL-13Rα2在哮喘小鼠肺组织表达增加,与气道重塑密切相关。
支气管哮喘; 气道重塑; 白细胞介素13; 受体
气道重塑是支气管哮喘(以下简称哮喘)的重要特征,气道重塑与Th2细胞因子(IL-4、 IL-5、IL-13)的激活密切相关,IL-13可单独诱导小鼠产生哮喘的所有症状。IL-13受体有两个亚型:白介素13受体α2(interleukin-13 receptor α2, IL-13Rα2)和IL-13Rα2。IL-13Rα2在肺上皮细胞、巨噬细胞、成纤维细胞等细胞内表达。本实验就哮喘小鼠中IL-13Rα2和气道重塑关系作一研究,旨在进一步探讨哮喘的发病机制。
材料与方法
一、实验材料
健康BALB/c小鼠(8周龄,雄性,SPF级,体质量18~22 g,30只(斯莱克实验动物公司,上海)。试剂:氢氧化铝佐剂(上海化工总厂),鸡卵蛋白OVA (Ⅱ级,sigma公司,美国),羊抗鼠IL-13Rα2抗体(R&D公司,美国),生物素标记第二抗体(迈新公司,福州) ,RT-PCR试剂盒(Fermentas公司,美国),Trizol试剂(Invitrogen公司,美国)。
二、实验方法
1. 哮喘动物模型的制备: ①按照随机原则将30只小鼠分为3组,对照组(A组,n=10)、哮喘组 (B组,n=10)、干预组 (C组,n=10);②致敏:将OVA和氢氧化铝制成生理盐水抗原混悬液(浓度OVA 0.01%,氢氧化铝0.01%),第0、7天每只小鼠腹腔内注射0.1 ml;③激发,雾化吸入1%OVA激发小鼠哮喘,开始时间第14天,频率每周第1、3、5天,每次雾化持续时间20 min,共计8周[1]。干预:每日激发前30 min,C组小鼠腹腔注射地塞米松2 mg/kg。A组以生理盐水代替抗原混悬液及1% OVA进行腹腔注射和雾化。
2. 肺组织病理和形态学观察及测量: 末次雾化后24 h断颈椎方法处死小鼠,取左肺常规制备病理切片,HE染色后观察病理改变。选择横断面完整的且长径:短径<1.5的气管, QWin图像系统分析管腔的内周长(Pi)、管壁面积(Wat)、支气管平滑肌的面积(Wam),用Pi对Wat、Wam值进行标准化。
3. IL-13Rα2 mRNA 和TGF-β1 mRNA表达水平的测量: Trizol试剂提取右肺组织总RNA,逆转录为cDNA获得模板行PCR扩增。目的基因引物序列:IL-13 Rα2上游:5′- ACGATAGGTACGCATTTGT
C-3′,下游:5′- GCAAGTGAAGACGTATGCTT-3′,煺火温度58 ℃,PCR 产物908bp。TGF-β1上游:5′-TAATCAGCACTATCACCTACCT-3′,下游:5′-TGGTA
AAGAGCTCACCCGCGTG-3′,煺火温度58 ℃,PCR 产物492bp。1.5%琼脂糖凝胶电泳,用Band Leader 3.0软件半定量分析PCR产物的相对A值。
4. IL-13Rα2蛋白表达的测量: 左肺组织石蜡切片脱水,3%双氧水溶液室温处理10 min后,正常羊血清封闭,依次滴加一抗、二抗、SABC,DAB显色,阳性结果显示棕黄色。用PIPS22020软件进行分析。
三、统计学方法
结 果
一、气道重塑图像分析结果
B组小鼠肺组织Wat/Pi值和Wam/Pi值显著高于A组(P<0.01)和C组(P<0.01),A组Wat/Pi值和Wam/Pi值显著高于C组(P<0.01),见表1。Wat/Pi值结果:A组(12.61±0.87) μm2/μm,B组(17.58±0.78) μm2/μm,C组 (13.89±0.94) μm2/μm,B组Wat/Pi较A组明显增加,比较两者差异有统计学意义(P<0.01)。C组和B组比较有显著差异(P<0.01),C组和A组比较也有显著差异(P<0.01)。Wam/Pi值结果:A组(4.61±0.46)μm2/μm,B组(6.71±0.83)μm2/μm,C组(5.62±0.53) μm2/μm,B组较A组明显增加,两者差异有统计学意义(P<0.01)。C组和B组比较有显著差异(P<0.01),C组和A组比较亦存在显著差异(P<0.01),见表1。

表1 三组小鼠肺组织Wat/Pi值和Wam/Pi值测量结果的比较
二、IL-13Rα2 mRNA、TGF-β1 mRNA的表达结果
B组小鼠肺组织IL-13Rα2 mRNA的表达和TGF-β1 mRNA的表达显著高于A组(P<0.01)和C组(P<0.01),C组IL-13Rα2 mRNA的表达显著高于A组(P<0.01),C组与A组间TGF-β1 mRNA的表达无显著差异(P>0.05),见表2。IL-13Rα2 mRNA的表达:A组(0.075±0.058),B组(0.670±0.183),C组(0.262±0.138),B组显著高于A组(P<0.01)和C组(P<0.01),C组显著高于A组(P<0.05),低于B组(P<0.01)。TGF-β1 mRNA的表达:A组(0.317±0.140),B组(0.704±0.168),C组(0.358±0.098),B组显著高于A组(P<0.01)和C组(P<0.01),C组与A组之间无显著差异(P>0.05),见表2。
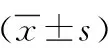
表2 三组小鼠肺组织IL-13Rα2 mRNA、TGF-β1 mRNA表达水平的比较
三、IL-13Rα2蛋白表达结果
免疫组化染色IL-13Rα2蛋白阳性,显微镜下显示有棕黄色颗粒沉着。气道炎性细胞(淋巴细胞、巨噬细胞等)及支气管上皮细胞内均可见到棕黄色颗粒沉着。小鼠气道阳性细胞灰度值:A组(17.80±4.09),B组(52.11±6.30),C组(22.87±3.76)。B组显著高于A组(P<0.01)和C组(P<0.01),C组显著高于A组(P<0.01),见表2及图1~3。

图1 A组肺组织IL-13Rα2蛋白表达(免疫组化,×400)
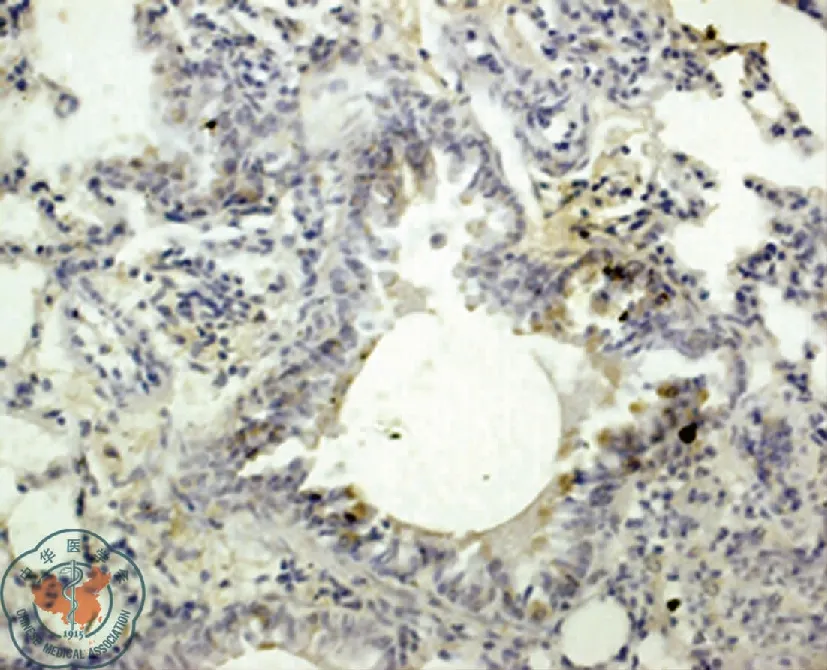
图2 B组肺组织IL-13Rα2蛋白表达(免疫组化,×400)

图3 C组肺组织IL-13Rα2蛋白表达(免疫组化,×400)
讨 论
气道重塑是导致哮喘患者肺功能恶化、致残和死亡的重要原因[2]。多种细胞和细胞因子共同参与的气道慢性炎症过程中,持续的气道损伤和修复最终导致气道重塑。哮喘支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中转移生长因子-β(transforming growth factor-β, TGF-β)和IL-13的水平是显著升高[3]。研究证实TGF-β改变气道上皮细胞之间的黏附性能,诱导气道上皮细胞的凋亡,是气道上皮细胞层的损伤重要因素。同时TGF-β促进黏液腺和杯状细胞的增生、促进成纤维细胞的增殖、分化及分泌细胞外基质(extracellular cell matrix, ECM)蛋白[4],促进气道平滑肌的增殖和细胞肥大,促进气道血管的增殖和重塑。TGF-β的一系列生物学功能决定TGF-β在气道重塑中的重要作用。IL-13是Th2细胞分泌的多效应细胞因子,能促进B细胞增殖和抗体分泌,在IgE介导的I型变态反应中发挥重要作用,同时也参与气道的重塑[5-6]。研究提示IL-13和TGF-β1的共同作用在慢性炎症导致组织纤维化过程中至关重要。
IL-13的受体有两类:IL-13Rα1和IL-13Rα2。IL-13Rα1作为重要的效应受体已经得到多项研究证实。IL-13Rα2在正常肺组织中表达很低,但IL-13Rα2和IL-13的亲和力(KD=250 pm)约是IL-13Rα1和IL-13亲和力(KD=2~10 nm)的100倍,其与IL-13的功能密切相关。本研究发现哮喘组小鼠肺组织IL-13Rα2 mRNA和蛋白表达均明显升高,并且与TGF-β1 mRNA、气道壁的厚度和气道壁平滑肌厚度变化密切相关。地塞米松治疗组小鼠肺组织中TGF-β1 mRNA表达下降,气道壁的厚度和气道壁平滑肌厚度改善,并且与IL-13Rα2 mRNA和蛋白表达变化一致。提示IL-13Rα2参与IL-13介导的气道重塑过程,但其作用尚有待进一步研究[7]。
IL-13Rα2在细胞浆、细胞膜(mIL-13Rα2)和细胞间隙中(sIL-13Rα2)均有存在。IL-13Rα2的三个形式存在联系,体外试验发现IL-13Rα2被自发地从细胞内释放到培养基中,在细胞间隙和血浆中以可溶性形式存在。Wang等[8]报告感染血吸虫的IL-13Rα2基因缺陷小鼠,肺部和肝脏出现组织纤维化,且较正常小鼠严重。史广海等[9]使用重组sIL-13Rα2治疗支气管哮喘小鼠,发现嗜酸性粒细胞凋亡加速,气道炎症减轻。因此sIL-13Rα2可能是IL-13诱饵受体,具有中和IL-13的效应。但国外有学者研究发现IL-13通过IL-13Rα2诱发同种异体肝移植小鼠发生TGF-β1相关的慢性移植排斥反应,造成移植肝发生纤维化改变。IL-13Rα2 siRNA可以阻断IL-13/TGF-β1作用防止移植物发生纤维化[10]。IFN-γ是组织纤维化的抑制因子,在体外IFN-γ通过动员细胞内的IL-13Rα2增加mIL-13Rα2表达[11],但IL-13和IL-4也能上调气道上皮细胞IL-13Rα2 mRNA表达。mIL-13Rα2和sIL-13Rα2可能在机体内发挥不同的生物学效应。
现有研究证实sIL-13Rα2可能是诱饵受体。mIL-13Rα2能否通过激活STAT6信号通路发挥生物学效应尚不清楚[12]。研究发现mIL-13Rα2细胞浆很短不能结合JAKs或STATs,因此不能激活STAT6信号通路。但有研究发现IL-13Rα2细胞内结构域存在一个包含磷酸化位点Y369PKM的氨基酸残基,这个磷酸化位点具有潜在的结合含SH2信号分子的能力[13]。mIL-13Rα2有可能通过SH2信号分子激活转录因子AP-1 (activating protein 1)而发挥生理效应[7]。
综上所述,IL-13Rα2是哮喘气道重塑过程的重要参与者。但由于IL-13Rα2在体内以三种形态存在,这三种形态可以密切联系。进一步研究这三种形态在转化过程中的影响因素,以及mIL-13Rα2和sIL-13Rα2各自的功能,对进一步阐明哮喘的发病机制有重要的意义。
1 Kips JC, Anderson GP, Fredberg JJ, et al. Murine models of asthma [J]. Eur Respir J, 2003, 22(2): 374-382.
2 Burney P, Jarvis D, Perez-Padilla R. The global burden of chronic respiratory disease in adults[J]. Int J Tuberc Lung Dis, 2015, 19(1): 10-20.
3 李 蓓, 王 敏. 转化因子-β与结缔组织生长因子在哮喘气道重构中的作用[J]. 临床肺科杂志, 2009, 14(10): 1346-1348.
4 Fattouh R, Jordana M. TGF-beta, eosinophils and IL-13 in allergic airway remodeling: a critical appraisal with therapeutic considerations[J]. Inflamm Allergy Drug Targets, 2008, 7(4): 224-236.
5 杨 华, 黄桂红. Th1/Th2细胞因子失衡在哮喘发病机制中的作用[J]. 临床肺科杂志, 2013, 18(12): 2271-2272.
6 Tabata Y, Khurana Hershey GK. IL-13 receptor isoforms: breaking through the complexity[J]. Curr Allergy Asthma Rep, 2007, 7(5): 338-345.
7 Chen W, Sivaprasad U, Gibson AM, et al. IL-13 receptor α2 contributes to development of experimental allergic asthma[J]. J Allergy Clin Immunol, 2013, 132(4): 951-958.
8 Wang W, Shen YX, Li J, Enhanced expression of the decoy receptor IL-13Ralpha2 in macrophages of Schistosoma japonicum-infected mice[J]. Chin Med J, 2009, 122(14): 1650-1654.
9 史广海, 杨学敏, 成家军, 等. 白介素13可溶性受体对支气管哮喘小鼠嗜酸性粒细胞凋亡的影响[J]. 中华结核和呼吸杂志, 2012, 35(1): 66-68.
10 Brunner SM, Schiechl G, Kesselring R, et al. IL-13 signaling via IL-13Rα2 triggers TGF-β1-dependent allograft fibrosis[J]. Transplant Res, 2013, 2(1): 16.
11 Campbell-Harding G, Sawkins H, Bedke N, et al. The innate antiviral response upregulates IL-13 receptor α2 in bronchial fibroblasts[J]. J Allergy Clin Immunol, 2013, 131(3): 849-855.
12 Goenka S, Kaplan MH. Transcriptional regulation by STAT6[J]. Immunol Res, 2011, 50(1): 87-96.
13 Fujisawa T, Joshi BH, Puri RK. IL-13 regulates cancer invasion and metastasis through IL-13Rα2 via ERK/AP-1 pathway in mouse model of human ovarian cancer[J]. Int J Cancer, 2012, 131(2): 344-356.
(本文编辑:黄红稷)
王正东,姚汉清,闵凌峰,等. 白介素13受体α2在哮喘小鼠肺组织细胞内表达与气道重塑的关系[J/CD]. 中华肺部疾病杂志: 电子版, 2015, 8(1): 35-38.
·医学动态·
抑制EZH2治疗肺癌新发现
近日,来自美国波士顿儿童医院的科学家们发现,抑制甲基转移酶EZH2对应用化疗药物治疗EGFR和BRG1突变与非突变非小细胞肺癌具有不同影响。
非小细胞肺癌是世界范围内导致癌症致死的主要杀手,应用拓扑异构酶Ⅱ抑制剂依托泊苷只对一小部分患有非小细胞肺癌的病人具有良好疗效,因此,改变药物作用靶点正成为药物治疗该疾病的主要问题。研究证明EZH2能与PRC2共同作用对H3K27进行三甲基化,起到基因沉默的作用,因此甲基转移酶EZH2成为一个非常具有应用前景的潜在作用靶点。
Christine等发现抑制EZH2对应用拓扑异构酶Ⅱ抑制剂治疗EGFR和BRG1突变与非突变非小细胞肺癌具有不同影响。在BRG1失活的肿瘤细胞中,抑制EZH2会影响细胞周期导致肿瘤细胞的凋亡以及对拓扑异构酶Ⅱ抑制剂的敏感性增加,同时EGFR功能获得型突变的肿瘤细胞对抑制EZH2以及拓扑异构酶Ⅱ抑制剂的敏感性都增加。而在野生型EGFR和BRG1肿瘤细胞中,抑制EZH2会上调BRG1表达导致对拓扑异构酶Ⅱ抑制剂的抵抗。
Relationship between interleukin-13 receptor α2 expression and airway remodeling in asthmatic mice
WangZhengdong,YaoHanqing,MinLingfeng,XuXingxiang(DepartmentofRespiratoryMedicine,NorthernJiangsuPeople′sHospital,Yangzhou225001,China)
XuXingxiang,Email:xuxx63@sina.com
Objective To investigate the relationship between interleukin-13 receptor α2(IL-13Rα2) and airway remodeling. Methods SPF level BALB/c mice were injected with OVA intraperitoneal by sensitization, and inhalation stimulation, and dexamethasone intervention by intraperitoneal injection. Mice were sacrificed 24 h after the last sensitization. It was observed that morphological changes in mice lung tissue. IL-13 Rα2 mRNA , TGF-β1 mRNA and IL-13 Rα2 protein expression in mice lung tissues were detected by reverse transcription-polymerase chain reaction(RT-PCR) and immunohistochemisty respectively. Results Compared with the control group, dexamethasone group, the bronchial wall of asthmatic mice became thicker (17.58±0.78)vs. (12.61±0.87)vs. (13.89±0.94),P<0.01, and their smooth muscle area was much thicker too (6.71±0.83)vs. (4.61±0.46)vs. (5.62±0.53),P<0.01. RT-PCR found that IL-13R α 2 mRNA (0.670±0.183)vs. (0.075±0.058)vs. (0.262±0.138) and TGF-β1 mRNA (0.704±0.168)vs. (0.317±0.140)vs. (0.358±0.098) significantly increased in lung tissue,P<0.01, and immunohistochemistry showed that IL-13Rα 2 protein expression (52.11±6.30)vs. (17.80±4.09)vs. (22.87±3.76) was evidently higher,P<0.01. Conclusion The expression of IL-13 Rα2 in asthmatic mice lung tissue is increased, which has close relationship with airway remodeling.
Bronchial asthma; Airway remodeling; Interleukin-13; Receptor
10.3877/cma.j.issn.1674-6902.2015.01.008
国家自然科学基金青年科学基金项目(81302016)
225001 扬州,江苏省苏北人民医院呼吸内科
徐兴祥,Email: xuxx63@sina.com
R563
A
2014-12-19)
