油菜素内酯及其在种子萌发过程中的生理效应研究进展
2015-06-12朱早兵等
朱早兵等


摘 要 简述油菜素内酯的化学结构、合成、信号传导机制,种子萌发生理,正常环境下油菜素内酯促进种子萌发的生理作用和逆境条件下油菜素内酯对种子萌发的促进效应等,提出油菜素内酯促进种子萌发机理的研究方向。
关键词 油菜素内酯 ;种子萌发 ;进展
分类号 Q945
Abstract Based on the introduction of brassinolide sources, methods of synthesis and signal transduction pathway, the paper mainly expounded the physiological effects of brassinolide on seeds during germination stage and part of the molecular mechanism that brassinolide promoted seed germination when the seeds were in the normal and stress conditions, further put forward the research direction of the mechanism that brassinolide promoted seed germination.
Keywords brassinolide ; seed germination ; research progress
油菜素内酯(brassinolide, BL)又名芸苔素内酯或芸苔素,是植物中的甾醇类生长促进激素,它的作用贯穿植物萌发到开花结果的整个生活史,它能促进细胞伸长,影响细胞分裂分化,促进植物进入生殖生长,影响花诱导及分化,同时在提高植物对逆境条件抵御能力,增强植物净光合作用、增加作物产量等方面都具有十分重要的意义。由于油菜素内酯在提高作物耐旱、耐寒和耐盐等方面的能力,以及提高作物抗病性的作用已超过现有的5种激素,被国际上誉为第六激素[1]。自发现以来,科研人员对油菜素内酯各方面的研究不断取得突破性进展,尤其是近几年在促进种子萌发、提高作物对外界不良环境的抗性机理和促进作物幼苗细胞伸长分裂,减少水果和蔬菜中农药残留等研究取得了很大进步,同时在果蔬、农林方面的应用情况也有报道[2],这为今后油菜素内酯应用于生产实际提供了理论基础。近年来,油菜素内酯在种子萌发阶段的的生理效应研究逐步展开,包括种子萌发阶段的信号传导机制、下胚轴的伸长作用原理等。笔者简述近年油菜素内酯在种子萌发阶段的生理作用和促进萌发分子机理的研究成果,阐述了油菜素内酯促进种子萌发的生理效应,以期为深入研究油菜素内酯在种子萌发生理方面的作用机理提供参考。
1 油菜素内酯的化学结构、合成及信号传导机制
1.1 油菜素内酯的化学结构
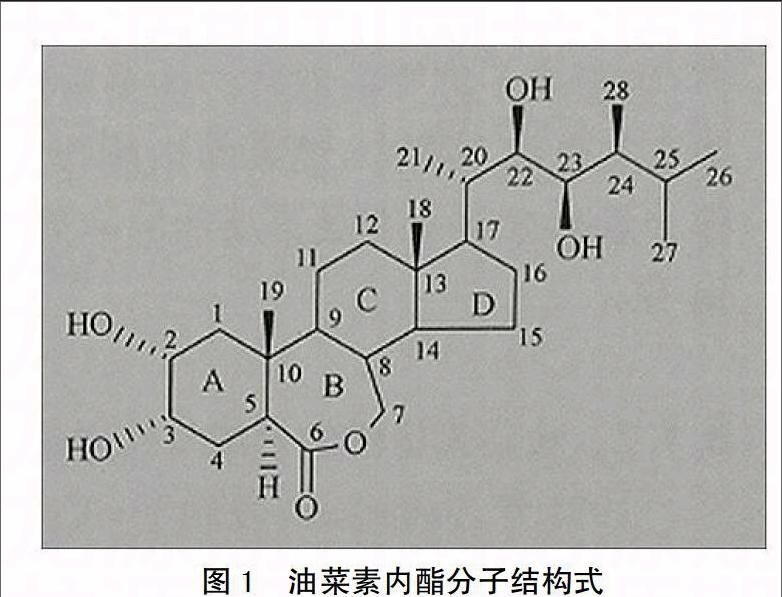
20世纪70年代,科学家对甘蓝型油菜(Brassica napus)进行研究,从花粉中发现了一种物质,后对其进行大量的采集、分离、纯化和结构分析,最终证明它具有与动物固醇类激素(雌性激素,睾酮等)相似的结构,并且多携带一定活性基团侧链的一种化合物(如图1),命名为油菜素内酯(brassinolide, BL)[3-4],迄今发现约70种BL的类似物,它们合称油菜素甾醇类物质(brassinosteroid, BR),BR与BL结构上的区别主要在A,B环的修饰基团不同,油菜素甾醇类激素根据B环官能团的不同分成3类,再根据甾醇延伸出的基团不同又可将其分为7类,BL是BR中活性最强的分子,其它油菜甾醇类物质的活性只有BL的1/10[5-6]。科学家推测BR活性强主要原因是与BR母体甾醇中A和B环的反式结构、B环的6-O和6-O-7-氧杂环集团及A环的顺式α向的羟基集团等结构因素有关[7]。
BR在植物体中广泛存在,无论单子植物、双子叶植物、裸子植物、被子植物或是低等植物、高等植物都含有BR,其中栗甾醇(CS)分布最为广泛。不同组织、不同器官、甚至不同生长时期BR含量有很大差别,一般幼嫩的组织器官含量高于成熟的组织器官,幼年时期高于成熟期,生长旺盛部位合成也越多[8-9]。
1.2 BR的合成
20世纪70年代国外已有油菜素内酯合成研究。美国、日本等国研究人员分别以麦角甾醇和油菜甾醇作为原料合成油菜素内酯,但都由于反应步骤长、总收率低等因素无法实现工业化生产,中国从1988年开始有合成的研究[10],主要是合成BRll、BR12、BR,合成途径:
植物甾醇酯磺酸→甾酮→二羟基甾酮 →四羟基甾醇→油菜素甾醇类物质(最终产物),该反应具有原料易获得、反应路线短、产物容易控制和反应收率高等优点。
随着GC-MS和GC-MS-SIM技术发展,通过饲喂标记的方法,发现另一合成路径:
甲基戊酸(类萜途径起始分子)→鲨烯→油菜甾醇(campesterol, CR,反应的起始物质)→油菜甾烷醇(CN)→C-6早期氧化途径或C-6晚期氧化途径→油菜甾酮→油菜素内酯[11],该过程中油菜甾醇经一系列加氧、羟化、脱羟等途径最终合成油菜素内酯(图2)。该合成途径主要分为2条:前期C6氧化途径和后期C6氧化途径[12]。这2条途径的划分与甾醇体侧链反应时C6酮基与C22、C23、C2及C3进行位置修饰的先后有关[13]。
1.3 BR的信号传导机理
目前,对双子叶植物拟南芥和单子叶植物水稻中BR信号传导研究较为深入[14-15]。研究证明,植物甾醇类激素与动物甾醇有所不同,其信号传递主要通过结合细胞膜外层上的BR不敏感蛋白(brassinosteroid insensitive 1,BRI1)受体激酶后被感知,然后将信号传递到细胞质,在细胞质中BRI1与共受体BAK1(BRI1-associated receptor kinase,BAK)结合成二聚体,然后通过一系列的蛋白磷酸化和去磷酸化以及蛋白定位的改变,将信号传递给核中,通过转录因子直接调控下游基因的表达来实现对不同生理效应的调控[16]。在这一途径中:若BR信号没有被感知时,BRI1与自身共受体BAK1结合后将被负调控蛋白BRI1抑制[17],同时类GSK3蛋白激酶BIN2磷酸化转录因子BZR1/BES1使之失活,无法进入细胞核识别DNA实现相应的生理调控[18];当BR存在时,BR被信号受体BRI1感知后,与BRI1抑制子(BRI1 Kinase inhibitor 1, BKI1)发生解离[19],被磷酸化解离的BRI1将很快与细胞质中BAK结合,BAK1-BRI1被激活后继续磷酸化,BR信号激酶(brassinosteroid-signalling kinase, BSKs)和组成型差异生长蛋白1(constitutive differential growth1,CDG1)的下游激酶,继而对下游的激酶BSU1去磷酸化作用,同时增强了BSU1的去磷酸化能力,对BIN2的活性产生抑制作用[20],使之不能进一步磷酸化下游转录基因BESI或BZRI,最后转录因子在PP2A磷酸酶作用下去磷酸化,进入细胞核中实现基因调控[21](图3)。
2 BR在种子萌发过程中的生理效应
2.1 种子萌发生理
种子的萌发是植物生命开始,萌发的好坏直接影响植物后期的生长、发育及成熟。通常意义上的种子萌发是胚根和胚轴突破组织,在种子发芽的过程中主要有3个步骤:干燥的种子吸水后发生的吸胀作用;种子吸水之后的生理代谢被激活;胚轴、胚根突破组织完成萌发[22]。吸胀作用主要由植物种子的衬质势引起,干种子的衬质势大,死或活的干种子都存在着吸胀作用[23],水透过种子细胞壁,进入细胞膜,干种子中原来以凝胶状态的衬质物在水合作用下形成液晶状,同时种子体积发生膨胀,将原有的膜质结构破坏,衬质溢出。种子在发生吸胀之后,细胞迅速分裂,各种代谢酶被激活,多种内源激素也快速合成,赤霉素含量迅速上升,种子吸水后ABA浓度降低,对种子萌发抑制作用减弱[24],种子活性增强,胚根突破组织,胚轴不断伸长完成萌发。
2.2 在适宜条件下,BR促进种子萌发的生理作用
2.2.1 BR对细胞伸长和分裂的调控
BR能够促进细胞伸长,BR处理可以促进香蕉不定芽的发生,在玉米根系试验中发现,BR能增强ATPase活性,导致H+-ATPase释放H+酸化非质体从而改变细胞的可塑性,细胞壁松弛,促进生长[25]。BR对水稻细胞的伸长和分裂的调控研究方面,张海丽等[26]通过对水稻愈伤组织体积和细胞分布、悬浮系细胞形状大小以及细胞骨架蛋白的分析研究发现,BR处理后,水稻细胞中有丝分裂基因CDC48(cell division cycle protein 48)及缩短细胞分裂周期基因CYCD2(cyclin D2)的代谢增强,且BR对水稻细胞伸长的调控作用中存在剂量效应,低浓度的BR能够促进水稻细胞的伸长,高浓度抑制;利用蛋白质组学技术对F-actin细胞骨架进行水平分析,发现BR能够促进细胞微丝骨架F-actin的积累,在F-actin的表达分析中发现,BR对F-actin微丝骨架形成存在诱导作用,这表明BR是通过调控细胞分裂相关基因表达和诱导细胞骨架形成来调控细胞分裂及伸长。
2.2.2 BR对种子α-淀粉酶活性的影响
种子吸水后,生理代谢增强,同时需要大量的能量,这些能量来源于糖的分解代谢,淀粉作为种子中重要的能量储存物质,在种子萌发时的分解转化至关重要,一些谷物的干种子中不含有α-淀粉酶,α-淀粉酶在种子萌发时合成,纪秀娥等[27]研究发现BR处理能明显增强α-淀粉酶的活性,随浓度上升促进作用下降。
2.2.3 BR与其他激素协同作用提高种子的发芽势及发芽率
种子萌发过程受多种激素调节,激素通过作用于相应的靶细胞受体,对细胞生长发育起到调控作用,种子萌发过程中脱落酸(ABA)主要诱导种子进入休眠;赤霉素(GA)主要是解除休眠;GA在萌发的种子胚内合成、释放及转运等途径到达糊粉层,促进糊粉层中不溶性糖及蛋白质转化为可溶性糖和氨基酸,为胚的发育提供营养物质,促进种子萌发[28];BRs与其他植物激素诱导种子萌发的机制有所不同。近年研究发现,BR存在一条蛋白质磷酸化调控途径,该途径通过调节BR受体感知与BR受体抑制子的激活,转录因子的激活以及BR受体激酶和蛋白质激酶活性的一系列反应途径,通过转录因子BESI等进入细胞核来实现基因的表达[29]。拟南芥种子的萌发实验发现MFT家族基因(Mother of FT and TELl,MFT)功能和BR信号传导途经有关,MFT家族基因存在负反馈调节ABA机制[30],表明BR促进种子萌发可能是作为一种基础的代谢信号或信号途径参与家族基因的负反馈调节,从而解除ABA在种子萌发过程中的抑制作用。纪秀娥等[27]进行种子萌发试验发现,较低浓度BR处理以后,小麦、玉米种子的发芽效果明显,发芽率和发芽势等也大大提高。在水稻细胞的伸长研究中,BR促进细胞伸长具有双重效应,其伸长量随着浓度的增加减小,呈负相关[26]。对2种不同温度下黄豆的萌发及下胚轴、轴根伸长的研究发现,0.05 mg/L的油菜素内酯处理后黄豆种子的萌发率高达93%[31]。在对羊草种子萌发的实验中发现,在同等条件下表油菜素内酯对野生羊草种子发芽率值提高幅度低于GA3,但更多的表现出明显的正互作效应,在2,4-表油菜素内酯0.1 μg/g+GA3 200 μg/g组合比单独使用单一激素提高20%~35%,同时也显著的提高了发芽势[32]。说明BR促进种子萌发时与GA有协同作用,二者配合使用能更好的促进种子萌发。
2.2.4 BR对植物萌发时下胚轴伸长的生理效应
种子萌发以后长出根、茎、叶,形成幼苗。根据种子的下胚轴伸长和子叶是否留在土中可将幼苗形态建成分为子叶留土幼苗(如豌豆、蚕豆等)和子叶出土型幼苗(如棉花、油菜等)。从种子萌发到形成幼苗过程中,BR对种子萌发后下胚轴及胚根的伸长具有重要调控作用。黄豆萌芽研究发现,任何浓度BR对胚根伸长量都有一定的抑制作用,且抑制作用随浓度升高而增强[33],李凯荣等[34]用BR处理5种牧草种子,观察其对种子萌发时胚根和下胚轴的影响,发现在适宜浓度时BR能够有效促进下胚轴伸长,同时也证明BR能有效地提高轴根比例及发芽率,说明BR对植物的胚轴及胚根的伸长存在一定生理效应。从微观角度研究发现,植物的生长和植物细胞形态建成等生理过程与微管骨架机械调节蛋白也存在一定关系。张谨[35]研究发现,BR信号调控植物下胚轴伸长需要微管骨架的参与,并在拟南芥中鉴定得到BRs信号通路中的重要转录因子BZR2的一个靶基因MDP40(编码微管的去稳蛋白),通过体内外生化分析发现MDP40可以被BRs受体激酶磷酸化,磷酸化修饰的MDP40对于参与BRs调控植物下胚轴伸长具有重要意义。水稻BR不敏感突变体d61(Osbril)和BR合成缺失突变体brd1,在细胞中微管排列紊乱[26],外源施用BR后能够促进细胞微管的排列正常。这就证明了BR通过调控植物细胞的微管骨架的建成来促进植物下胚轴伸长。张海丽等[26]研究证明,油菜素内酯通过调节细胞有丝分裂过程中CDC48基因(cell division cycle protein 48)和缩短细胞周期的CYCD2(cyclin D2)基因的表达来促进细胞分裂伸长。以上研究结果表明,BRs促进种子萌发和胚轴伸长至少存在2种作用途径:BR通过调控细胞分裂基因,调控细胞分裂促进下胚轴伸长;BRs信号传递过程中,转录因子BRI1通过磷酸化的MDP40调控微管动态、组织排列和稳定性,进而介导下胚轴伸长生长。
2.3 在逆境条件下BR对种子萌发的促进效应
主流植物逆境伤害学说认为,当植物处于逆境条件下体内的活性氧的代谢失调,体内活性氧的积累会破坏原生质膜,攻击蛋白酶、DNA、RNA以及叶绿素等生物大分子,导致细胞膜破裂,细胞死亡。种子在温度高和低、水分多和少以及盐渍等逆境条件下萌发时体内的活性氧、自由基的含量增加,研究发现BRs能提高种子、幼苗在抗逆特性,其作用原理是BRs能提高种子贮藏和种子萌发时体内超氧化物歧化酶(SOD)、过氧化物酶(POD)以及过氧化氢酶(CAT)等酶的活性,并及时清除细胞内活性氧和自由基[36]。
2.3.1 BR在低温逆境条件下对种子萌发的作用
植物在逆境条件下体内的自由基含量会增加,而作为消除自由基的相关酶活性在油菜素内酯处理后大大提高,辣椒低温胁迫萌发试验发现,用一定浓度的2,4-表油菜素内酯处理能够解决15℃低温下辣椒种子萌发困难,生长发育迟缓等问题[37],这为保证早春和晚秋低温条件下的育苗质量提供了新的解决方法。植物抗寒性与细胞膜上的不饱和脂肪酸多少以及膜质流动性等因素有关,膜上不饱和脂肪酸越多,达到相变的温度越低。膜的流动性取决于膜磷脂上脂肪酸的组成,高比例的磷脂合成能提高膜的耐寒性[38]。而低温条件下,细胞中自由基、活性氧的含量升高,直接攻击细胞膜,导致细胞膜的结构受到不同程度地破坏,影响膜的整体抗寒能力;且低温条件下,植物体内的丙二醛含量升高,增加了植物细胞膜的通透性,膜内离子外渗提高相变温度。陈善娜等[39]研究发现,低温胁迫下BR-120 处理后的水稻体内SOD和POX活性提高。这些酶在自由基的清除中起着重要作用。王炳奎等[40]研究发现,用BR处理后对保持SOD活性和降低丙二醛含量方面的效果都有很大的提升,说明油菜素内酯可提高种子在低温条件下的萌发作用,一定条件下与它能提高植物体内各种保护酶的活性以及降低丙二醛含量有关。
2.3.2 BR在盐胁迫及干旱胁迫条件下对种子萌发的作用
在盐胁迫下,植物细胞的亚显微结构遭到破坏,导致细胞失水,甚至死亡。研究发现BL处理后能明显降低高盐胁迫对细胞核和叶绿体的伤害[41],提高植物核酸和可溶性蛋白含量[42]。在茄子盐渍抗性试验中,BR处理显著提高茄子种子的发芽率、发芽势、发芽指数及活力指数等发芽指标[43],由此可知BR提高种子在盐胁迫下种子萌发率与细胞可溶物的增加以及降低盐胁迫对植物的伤害有关。玉米干旱胁迫下也有同样效果,但对根的数量提高上基本没有影响,主要是促进平均根长、根干重、平均芽长、芽干重等萌芽期的指标[44],这也与早期BR提高植物抗逆性研究相一致。
3 结语
植物种子研究中,促进种子萌发、提高种子萌发率的植物内在机理研究一直都是研究的热点。BR作为植物内源激素的分子机理及生理效应研究只有短短几十年,但由于科研人员的不懈努力,现已成为作用机制较为清楚的植物激素之一。目前,对BR的来源、生理效应、提高植物对外界抗逆性以及在果蔬、农林方面的应用等都有了相关研究,但对油菜素内酯在植物种子萌发、幼苗细胞伸长与分裂阶段的作用机理的研究还是初步阶段,与IAA、ABA等内源激素在种子萌发阶段的分子作用机理研究有待深入挖掘;调控细胞伸长生长中是否存在双重效应的BR信号传导途径的分子机理研究以及提高逆境条件下种子萌发的作用原理研究也将作为理论结合实际应用的重要桥梁不断深入。
参考文献
[1] SASSE J M. Recent progress in brassinos-teroid research[J]. Physiol Plant,1997,100:696-701.
[2] 吕习栋,袁留斌. 油菜素内酯研究进展[J]. 农业灾害研究,2013,03(1):56-57,60.
[3] Mitchell J W, Mandava N, Worley J F, et al. Brassins-a new family of plant hormones from rape pollen[J]. Nature, 1970, 225(5 237): 1 065-1 066.
[4] Grove M D, Spencer G F, Rohwedder W K. Brassinolide, a plant growth-promoting steroid isolated from Brassica napus pollen[J]. Nature,1979,281(9): 216-217.
[5] Wang Z Y, Seto H, Fujioka S, et al. BRI1 is a critical component of a plasma-membrane receptor for plant steroids[J]. Nature, 2001, 410(3): 380-383.
[6] Kinoshita T, Ccno-Delgado A, Seto H , et al. Binding of brassinosteroids to the extracelluar domain of plant receptor kinase BRI1[J]. Natual, 2005, 433(1): 167-171.
[7] 许智宏,薛红卫. 植物激素作用的分子机理(第5版)[M]. 上海:上海科学技术出版社,2012:165.
[8] Shimada Yukihisa, Goda Hideki, Nakamura Ayako, et al. Organ-specific expression of brassinosteroid biosynthetic genes and distribution of endogenous brassinosteroids in Arabidopsis[J]. Plant Physiology, 2003,131(1): 287-297.
[9] Teresa Montoya, Takahito Nomura, Takao Yokota, et al. Patterns of Dwarf expression and brassinosteroid accumulation in tomato reveal the importance of brassinosteroid synthesis during fruit development[J]. The Plant Journal, 2005, 42(2): 262-269.
[10] 李 良,张洪彬,戴晓畅,等. 油菜素内酯类物质的合成及应用研究[J]. 农药,1993,32(1):10-11.
[11] Fujioka S, Inoue T, Takatsuto S, et al. Identification of a new brassinosteroid, cathasterone, in cultured cells of Catharanthus roseus as a biosynthetic precursor of teasterone[J]. Biosci Biotech Biochem,1995,59 (8): 1 543-1 547.
[12] Clouse S D, Sasse J M. Brassinosteroids: essential regulators of plant growth and development[J]. Annual review of plant physiology and plant molecular biology,1998,49(6): 427-451.
[13] 储昭庆,李 李,宋 丽,等. 油菜素内酯生物合成与功能的研究进展[J]. 植物学通报,2006, 23(5):543-555.
[14] Kim T W, Wang Z Y. Brassinosteroid signal transduction from receptor kinases to transcription factors[J]. Annual Review of Plant Biology, 2010, 61: 681-704.
[15] Wang Z Y, Bai M Y, Oh E, et al. Brassinosteroid signaling network and regulation of photomorphogenesis[J]. Annual Review of Genetics, 2012, 46: 701-724.
[16] Clouse S D. Brassinosteroid signal transduction:from receptor kinase activation to transcriptional networks regulating plant development[J].The Plant Cell Online, 2011, 23(4): 1 219-1 230.
[17] He J X, Gendron J M, Yang Y, et al. The GSK3-like kinase BIN2 phosphorylates and destabilizes BZR1,a positive regu-lator of the brassinosteroid signaling pathway in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(15): 10 185-10 190.
[18] Gampala S S, Kim T W, He J X, et al. An essential role for 14-3-3 proteins in brassinosteroid signal transduction in Arabidopsis[J]. Developmental Cell,2007,13(2):177-189.
[19] Wang X, Chory J. Brassinosteroids regulate dissociation of BKI1,a negative regulator of BRI1 signaling, from the plasma membrane[J]. Science,2006,313 (5 790 ): 1 118-1 122.
[20] Kim T W, Guan S, Sun Y, et al. Brassinosteroid signal trans-duction from cellsurface receptor kinases to nuclear transcription factors[J]. Nature Cell Biology, 2009,11(10):1 254 -1 260.
[21] RYU H, KIM K, CHO H, et al. Nucleocytoplasmic shuttling of BZR1 mediated by phosphorylation is essential in Arabidopsis brassinosteroid signaling[J]. Plant Cell, 2007, 19(9): 2 749-27 62.
[22] Bewley J D, Bradford K J, Hilhorst H W M. Physiology of development, germination and dormancy[J]. Seed Science Research, 2013, 23(4):289.
[23] Krishnan T Joshi D K, Nagarajan S, Moharir A V. Characterization of germinating and nonviable soybean seeds by nuclear magnetic resonance (NMR) spectroscopy[J]. Seed Sci Res, 2004, 14: 355-362.
[24] 徐恒恒,黎 妮,刘树君,等. 种子萌发及其调控的研究进展[J]. 作物学报,2014,40(7):1 141-1 156.
[25] Romani G, Marrie M T, Bonetti A, et al. Effectsofa brassinosteroid on growth and electrogenic proton extrusion in maize root segments[J]. Physiologia Plantarum, 1983, 59(1): 828-532.
[26] 张海丽,高 静,张 昊,等. 油菜素内酯对水稻细胞伸长和分裂的调控[J]. 农业生物技术学报,2015,23(1):71-79.
[27] 纪秀娥,史留功,胡春红,等. 油菜素内酯对小麦、玉米种子萌发的影响[J]. 江苏农业科学,2014,42(9):88-89.
[28] 方志荣,苏智先,胡进耀. 脱落酸、赤霉素和乙烯对种子休眠的萌发和调控[J]. 西华师范大学学报(自然科学版),2007,28(2):127-132.
[29] 晋育丹,戴绍军. 蛋白质磷酸化在油菜素内酯信号通路中的作用[J]. 现代农业科学,2014(6):222-223.
[30] Xi Wanyan, Yu Hao. Mother of FT and TFL1 regulates seed germination and fertility relevant to the brassinosteroid signaling pathway[J]. Plant Signalling & Behavior, 2010, 5 (10): 1 315-1 317.
[31] 程彦伟,柳家婷,韩建明,等. 油菜素内酯对黄豆种子萌发及下胚轴和胚根生长的影响[J]. 洛阳师范学院学报,2013,32(11):57-59.
[32] 郭慧琴,任卫波,李 平,等. 2,4-表油菜素内酯和赤霉素互作对羊草种子萌发及幼苗生长的影响[J]. 草业科学,2014,31(6):1 097-1 103.
[33] 程彦伟,丁 贺,韩建明,等. 天然油菜素内酯对豆
(下转第32页)
