豆梨叶片应对干旱胁迫生理响应机制研究
2015-06-09蒋学莉史锋厚李新芝刘海一卢克成沈永宝
蒋学莉,史锋厚*,李新芝,刘海一,仲 磊,卢克成,沈永宝
(1.南京林业大学林学院,江苏 南京 210037;2.江苏省林木种苗管理站,江苏 南京 210036)
豆梨叶片应对干旱胁迫生理响应机制研究
蒋学莉1,史锋厚1*,李新芝2,刘海一2,仲 磊2,卢克成2,沈永宝1
(1.南京林业大学林学院,江苏 南京 210037;2.江苏省林木种苗管理站,江苏 南京 210036)
以豆梨1(2)-0嫁接品种苗木为实验材料,进行盆栽水分递减模拟干旱胁迫处理,对处于不同干旱状态下的苗木叶片生理指标进行测定,探究豆梨叶片应对干旱胁迫生理响应机制。结果表明:干旱胁迫导致豆梨叶片细胞膜系统受损伤,使得膜脂过氧化,叶片细胞将启动渗透调节系统和氧自由基清除酶促系统。随着干旱胁迫的加剧,各品种叶片质膜透性逐渐增大;脯氨酸含量持续升高,升高值可达十几倍;膜脂过氧化程度逐渐增强,丙二醛大量累积;氧自由基清除系统SOD和POD活性变化呈先升高后降低的趋势,前期活性升高由于植物细胞自身保护应激机制,后期的活性降低则源于干旱胁迫已伤及酶供体,导致酶活性下降。
豆梨;干旱胁迫;生理响应
干旱对于植物分布与进化以及植物利用等发挥着制约性影响作用,植物应对干旱逐渐形成保护性应激机制。叶片细胞中分布大量功能性细胞器及酶供体,可以根据环境信号调控生理代谢功能,积累渗透调节物质,促进酶促自由基清除系统等,产生保护性机制,减少外界环境因素的伤害。
豆梨(Pyrus calleryana)为蔷薇科梨属落叶乔木,为我国原生梨属树种,常用作栽培梨树的嫁接砧木,也是极具发展潜力的园林绿化树种。豆梨具有生长适应性强、耐干旱贫瘠的特点,但国内外关于干旱胁迫对豆梨树木影响的研究报道并不多见,该文以不同豆梨品种苗木为研究材料,实施干旱胁迫处理,测定苗木叶片生理指标,探讨豆梨叶片应对干旱胁迫的生理响应机制。
1 材料与方法
1.1 供试材料
供试材料为盐城林场提供的豆梨1(2)-0嫁接品种苗,为由美国引进的‘Autumn Blaze’、‘Glen’s Form’、‘Redspire’、‘Fauriei’、‘Bradford’、‘Jaczam’等6个豆梨品种。每个品种苗木规格基本一致,苗木生长健壮,根系发达。
2013年3月初,在江苏乾景天园苗木有限公司基地(江苏省句容市天王镇竹园村),将苗木分别进行盆栽,盆栽容器规格高径为25 cm×30 cm,盆栽基质为基地就地所取大田土,每盆容器装填基质2.5 kg,每盆种植苗木1株,每个品种种植20盆,各品种苗木按照常规方法进行管理,于6月中旬选取生长相对一致的8株苗木进行干旱处理。基质中含有机质(重镉酸钾容量法)5%,水解氮(碱解扩散法)121 mg/kg,有效磷(P2O5)(NaHCO3法)27 mg/kg,速效钾(K2O)(NH4Ac浸提法)11.7 mg/kg。田间持水量21%,pH6.7。
1.2 干旱胁迫处理
干旱胁迫试验采用盆栽水分递减法进行。根据Hsiao TC[1]方法,将土壤干旱情况分为适宜水分、轻度干旱、中度干旱和重度干旱4个梯度,土壤相对含水量(RWC)分别为田间持水量的75%~80%,55%~60%,40%~45%和30%~35%,分别表示为W1,W2,W3和W4。根据称重法和土壤相对含水量测定法相结合将土壤水分调至W1后,停止水分供应,由于植物蒸腾和土壤水分散失,土壤含水量降低,逐渐到达W2,W3,W4状态。2013年6月15日,将所有盆栽苗木移入通风遮雨的塑料棚内,土壤含水量调至W1(对照),进行干旱胁迫处理;以后每隔3 d测定土壤含水量,监测土壤相对含水量分别至W2(6月27日)、W3(7月6日)、W4(7月15日)状态后,每个品种均选择顶端第4,5片功能叶混合取样,-70℃冰箱保存后测定各相关指标。
1.3 生理指标测定
叶片质膜透性指标测定参照张志良[2]的方法;丙二醛(MDA)含量测定参照张宪政等[3]的方法;脯氨酸含量测定参照邹琦[4]的方法;超氧化物歧化酶(SOD)测定参照邹琦[4]的方法;过氧化物酶(POD)测定采用张志良[2]的方法。各指标测定设重复3次。
1.4 数据分析处理
各指标测定结果采用EXCEL和SPSS软件进行统计分析。
2 结果与分析
根据试验设计,将各测定指标进行相应的方差分析,结果见表1。

表1 各测定指标方差分析结果
2.1 干旱胁迫对叶片质膜透性的影响
结果见图1,在对照情况下,各品种叶片质膜透性即存在差异;随着干旱胁迫的加剧,各品种质膜透性逐渐增大,叶片质膜的伤害程度逐渐增强。Autumn Blaze品种叶片质膜受伤害程度最大,质膜透性增大4.71倍,其他品种依次为Glen’s Form(4.29倍)>Redspire(3.87倍)>Jaczam(3.31倍)>Fauriei(3.17倍)>Bradford(3.00倍)。方差分析(见表1)表明:不同豆梨品种细胞质膜透性差异达极显著水平,各品种在不同干旱胁迫条件下的差异达极显著水平,品种和干旱胁迫程度间存在极显著的交互作用。各品种在不同干旱胁迫条件下,叶片质膜透性增幅存在差异,不同豆梨品种叶片质膜完整程度应对轻度、中度和重度等不同干旱胁迫所表现出的响应存在差异。
2.2 干旱胁迫对叶片脯氨酸含量的影响
结果见图2,干旱胁迫导致豆梨叶片脯氨酸大量积累,各品种在不同干旱胁迫条件下所积累的脯氨酸并不相同。轻度干旱时,叶片脯氨酸含量增大幅度分别为Jaczam(2.27倍)>Redspire(1.98倍)>Fauriei(1.84倍)>Glen’s Form(1.67倍)>Autumn Blaze(1.56倍)>Bradford(1.50倍);干旱胁迫加剧,脯氨酸积累速度增大,至重度干旱时,相比对照,各品种脯氨酸累积增幅依次为Autumn Blaze(18.70倍)>Glen’s Form(17.27倍)>Redspire(9.69倍)>Fauriei(7.35倍)>Bradford(6.92倍)>Jaczam(5.54倍)。方差分析(见表1)表明,不同豆梨品种脯氨酸含量差异达极显著水平,各品种在不同干旱胁迫条件下的差异达极显著水平,品种和干旱胁迫程度间存在极显著的交互作用。脯氨酸具有渗透调节作用,对于平衡细胞内外电解质具有重要作用,不同豆梨品种在不同干旱胁迫阶段表现出不同的适应性。

图1 不同干旱胁迫下豆梨叶片质膜透性
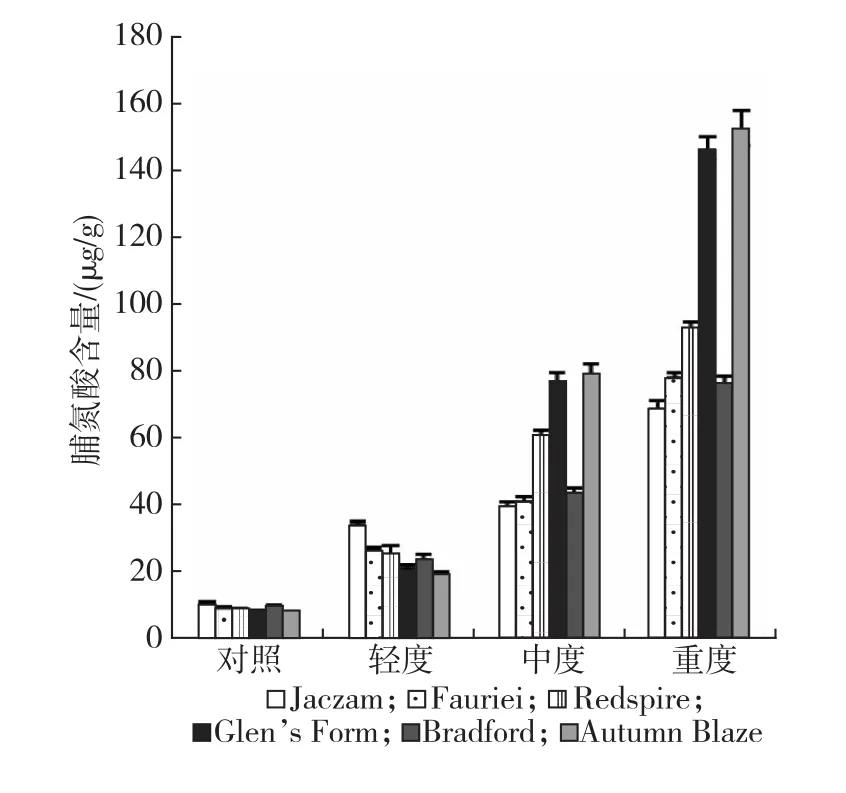
图2 不同干旱胁迫下豆梨叶片脯氨酸含量
2.3 干旱胁迫对叶片丙二醛含量的影响
结果见图3,干旱胁迫导致豆梨叶片细胞内自由基大量积累,膜质过氧化形成大量MDA,各豆梨品种均随干旱胁迫的加剧而产生大量MDA,致使对植物体的伤害程度逐渐增强;至重度干旱时,各品种叶片MDA产生量相比对照依次增加,即Autumn Blaze(2.07倍)>Glen’s Form(1.59倍)>Bradford(1.54倍)>Fauriei(1.52倍)>Jaczam(1.47倍)>Redspire(1.30倍)。方差分析(见表1)表明,不同豆梨品种MDA含量差异达极显著水平,各品种在不同干旱胁迫条件下的差异达极显著水平,品种和干旱胁迫程度间存在极显著的交互作用。干旱胁迫加剧,导致叶片细胞膜质过程化程度增强,MDA含量不断增大。

图3 不同干旱胁迫下豆梨叶片丙二醛含量
2.4 干旱胁迫对叶片超氧化物歧化酶和过氧化物酶活性的影响
干旱胁迫对切片SOD的影响结果见图4。干旱处理开始至轻度干旱阶段,豆梨各品种叶片SOD活性呈上升趋势,各品种叶片SOD活性升高趋势依次为Bradford(20%)>Jaczam(18%)>Fauriei(14%)=Redspire(14%)>Glen’s Form(9%)>Autumn Blaze(5%);随着干旱胁迫加剧,各品种叶片SOD活性不断降低,相比轻度干旱时降幅依次为Autumn Blaze(61%)>Redspire(60%)=Bradford(60%)>Jaczam(59%)=Glen’s Form(59%)>Fauriei(58%),各品种叶片SOD活性降幅差异并不大。方差分析(见表1)表明,不同豆梨品种叶片SOD活性差异达极显著水平,各品种在不同干旱胁迫条件下的差异达极显著水平,品种和干旱胁迫程度间存在极显著的交互作用。
干旱胁迫对叶片POD影响的结果见图5。干旱处理开始至轻度干旱阶段,豆梨各品种叶片POD活性呈上升趋势,各品种叶片POD活性增幅依次为Fauriei(20%)>Bradford(16%)>Jaczam(14%)>Redspire(5%)>Glen’s Form(3%)>Autumn Blaze(1%);随着干旱胁迫程度加剧,各品种叶片POD活性不断降低,相比轻度干旱时降幅依次为Jaczam(87%)>Fauriei(86%)>Bradford(85%)>Redspire(77%)>Glen’s Form(75%)>Autumn Blaze(71%)。方差分析(见表1)结果表明,不同豆梨品种叶片POD活性差异达极显著水平,各品种在不同干旱胁迫条件下的差异达极显著水平,品种和干旱胁迫程度间存在极显著的交互作用。

图4 不同干旱胁迫下豆梨叶片SOD活性
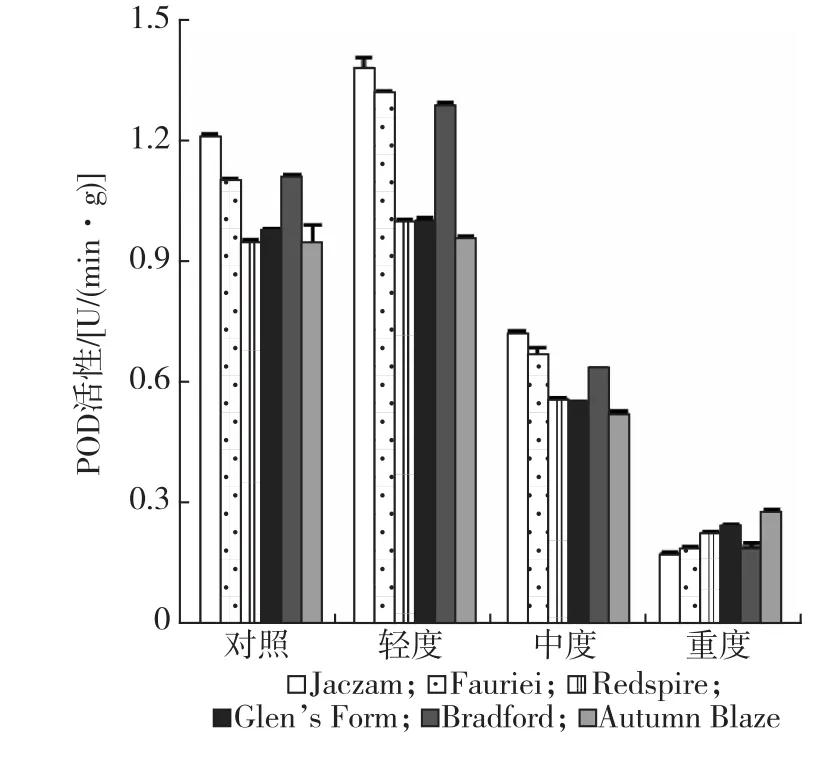
图5 不同干旱胁迫下豆梨叶片POD活性
3 讨论与结论
目前,季节性干旱成为影响植物生存的制约性因素。水分是植物生存和生长的重要条件,缺水会导致植物停止生长甚至死亡,然而植物应对干旱缺水已经逐渐演化出了相应的对策,包括植物本身的生理响应机制。
在干旱胁迫条件下,细胞膜系统通常被认为是受到干旱伤害的最初和关键部位[5]。干旱胁迫使得叶片膜系统透性增大,引起物质外漏,且在一定范围内,细胞质膜透性随着干旱胁迫的加剧而增大[6-7]。本试验中,豆梨各品种叶片质膜透性均随干旱胁迫的加剧而增强,但在轻度干旱状态下,各品种质膜透性增加幅度相对小于中度和重度干旱胁迫。分析原因,认为与颜淑云等的研究结论相似[7],叶片细胞膜相对透性在一定土壤含水量范围内比较稳定,植物通过自身的生理代谢反应来应对干旱的不利影响,当含水量下降到一定程度时,膜系统将受损。陈少瑜等提出抗性较强树种细胞膜较为稳定[8],因此,根据不同豆梨品种质膜受伤害程度,可以推断各品种抗旱性的强弱。
植物叶片受干旱胁迫时,细胞为维持膨压以及正常的生理功能,会启动渗透调节机制,以增强自身保水及主动吸水能力[7]。干旱胁迫可导致脯氨酸含量增加,且随着干旱胁迫的加剧,其含量将急速增加,这是植物对干旱环境的适应[9]。叶片脯氨酸含量增加作为抗旱性评价的绝对指标已经应用于多种植物抗旱性的研究[5,10],但Demiral等提出相左的意见,认为脯氨酸积累是胁迫造成的代谢紊乱的伴随结果[11]。在本试验中,各豆梨品种叶片中脯氨酸含量均随着干旱胁迫加剧而升高,轻度干旱时已导致其含量呈倍数升高,至重度干旱时,升高值甚至可达十几倍,这与紫穗槐幼苗干旱胁迫研究中的结果相似[7]。
干旱胁迫诱发植物体内产生更多活性氧,导致膜脂过氧化和膜脂脱氧化,产物MDA积累,蛋白和核酸的降解,造成伤害[12]。当植物体内MDA含量大量增加时,植物细胞受到较严重的破坏[13]。在本试验中,各品种叶片MDA含量随着干旱胁迫程度加剧持续升高,这与霍红等[5]的研究结论一致。轻度干旱对于植物已经有所伤害,但对于膜脂氧化伤害程度并不严重;随着干旱加剧,膜系统受伤害程度逐渐加强,这与王国富的研究结论一致,其指出重度干旱使MDA含量增加较为显著,具有持续、快速累加的效应,持续重度干旱将导致较重的伤害[14]。
植物抗旱性一般与酶促防御系统的各类酶的活性呈正相关,植物的抗旱能力和受到的伤害程度与这些保护酶的活性变化密切相关[15-16]。在本试验中,轻度干旱均使豆梨叶片中的SOD活性增强和产生量增大,这对于消除因干旱所产生的超氧自由基具有促进作用,是植物细胞正常的应激反应[17]。干旱胁迫增强导致过氧化物酶体受到伤害,致使SOD产生量减少,同时因歧化反应消耗,表现为SOD活性降低。豆梨叶片POD活性随着干旱胁迫的加剧,呈现先升高后降低的变化趋势,与沙枣、栓皮栎干旱胁迫研究所获结论一致[18-19]。当豆梨苗木受到干旱胁迫时,细胞内的酶促系统对于逆境所导致的超量过氧化氢进行清除,叶片内的POD活性增强,但不同品种间表现出差异性;随着干旱胁迫程度增强,豆梨叶片细胞器和质膜受到伤害,过氧化物酶体遭到破坏,POD产生逐渐被抑制,表现为POD活性逐渐降低。根据季孔庶等[20]关于抗旱性强的基因型在干旱胁迫下SOD、POD活性较高的论述,依据豆梨叶片SOD和POD活性的变化分别推断各品种的抗旱性,但排序并不一致,分析原因清除自由基的各种保护酶作为1个链式保护酶体系,活性氧的清除需要整个酶促防御系统协同进行,单个酶活性的增减并非意味着活性氧清除能力的同步提高[21]。
植物对水分亏缺的反应是各器官之间通过代谢和信号传递进行复杂的交流互动的结果[22],植物应对干旱所做出的响应也是复杂的系统过程。豆梨苗木在受到干旱胁迫时,叶片细胞接受信号,启动渗透调节系统和氧自由基酶促保护体系,细胞以自身生理代谢调整适应初期干旱胁迫,同时,干旱胁迫促使叶片细胞膜脂过氧化,质膜透性增大,丙二醛积累;随着干旱的加剧,豆梨体内所产生的氧由基及代谢中间产物逐渐积累,对于细胞器和质膜产生伤害,导致细胞功能性伤害,膜质过氧化程度急速增强,膜系统受伤害程度加剧,丙二醛加速积累,酶保护系统难以抵抗干旱胁迫而受到损伤,细胞器、质膜等结构损伤和功能丧失、毒性物质积累使得细胞逐渐死亡,表现为叶片受伤害程度加强,以致植物体受损严重。
[1] HsiaoT.Plant response to water stress[J].Annual Review of Plant Physiology,1973(24):519-570.
[2] 张志良.植物生理学实验指导[M].北京:高等教育出版社,2003:25-44.
[3] 张宪政,陈凤玉,王荣富.植物生理学实验技术[M].沈阳:辽宁科技出版社,1994:164-165.
[4] 邹 琦.植物生理生化实验指导[M].北京:中国农业出版社,1995:4-99.
[5] 霍 红,张 勇,陈年来,等.干旱胁迫下五种荒漠灌木苗期的生理响应和抗旱评价[J].干旱区资源与环境,2011,2(1):185-189.
[6] 王宇超,王得祥,彭少兵,等.干旱胁迫对木本滨藜生理特性的影响[J].林业科学,2010,46(1):61-67.
[7] 颜淑云,周志宇,邹丽娜,等.干旱胁迫对紫穗槐幼苗生理生化特性的影响[J].干旱区研究,2011,28(1):139-144.
[8] 陈少瑜,郎南军,贾利强,等.干旱胁迫对坡柳等抗旱树种幼苗膜脂过氧化及保护酶活性的影响[J].植物研究,2006,26(1):88-92.
[9] 石 喜,王密侠,姚雅琴,等.水分亏缺对玉米植株干物质累积、水分利用效率及生理指标的影响[J].干旱区研究,2009,26(3):396-400.
[10]张有福,陈 拓,张满效,等.锦鸡儿属植物抗旱性与叶片显微结构稳定性碳同位素和脯氨酸质量分数的关系研究[J].兰州大学学报,2006,42(5):140-141.
[11]Demiral T,Türkan I.Comparative lipid peroxidation,antioxidant defense systems and proline content in roots of two rice cultivars differing in salt tolerance[J].Environmental and Experimental Botany,2005(53):247-257.
[12]Montanaro G,Dichio B,Xiloyannis C.Shademitigates photo-inhibition and enhances water use efficiency in kiwifruit under drought[J].Photosynthetica,2009(47):363-371.
[13]刘裕强,江 玲,孙立宏,等.褐飞虱刺吸诱导的水稻一些防御性酶活性的变化[J].植物生理与分子生物学学报,2005,31(6):643-650.
[14]王国富.沙棘的形态解剖特性及生理指标与抗旱性关系研究[D].内蒙古:内蒙古农业大学,2006.
[15]孙国荣,彭永臻,阎秀峰,等.干旱胁迫对白桦实生苗保护酶活性及脂质过氧化作用的影响[J].林业科学,2003,39(1):165-167.
[16]Lee BR,Li LS,JungW J,etal.Water deficit-induced oxidative stress and the activation of antioxidant enzymes in white clover leaves[J].Biologia Plantarum,2009(53):505-510.
[17]郭文琦,陈兵林,刘瑞显,等.施氮量对花铃期短期渍水棉花叶片抗氧化酶活性和内源激素含量的影响[J].应用生态学报,2010,21(1):53-60.
[18]孙景宽,夏江宝,田家怡,等.干旱胁迫对沙枣幼苗根茎叶保护酶系统的影响[J].江西农业大学学报,2009,31(5):879-885.
[19]张文辉,段宝利,周建云,等.不同种源栓皮栎幼苗叶片水分关系和保护酶活性对干旱胁迫的响应[J].植物生态学报,2004,28(4):483-490.
[20]季孔庶,孙志勇,方 彦.林木抗旱性研究进展[J].南京林业大学学报,2006,30(6):123-128.
[21]陈立松,刘星辉.水分胁迫对荔枝叶片活性氧代谢的影响[J].园艺学报,1998,25(3):241-246.
[22]WangW B,Kim Y H,Lee H S,etal.Analysisof antioxidantenzyme activity during germination of alfalfa under salt and drought stresses[J].Plant Physiology and Biochemistry,2009(47):570-577.
S661.9
A
10.3969/j.issn.1001-7380.2015.01.005
1001-7380(2015)01-0023-05
2015-01-03;
2015-01-11
国家林业局948项目“豆梨优良品种及选育技术引进”(2011-4-42);江苏高校优势学科建设工程资助项目(PAPD)
蒋学莉(1989-),女,江苏泗阳人,在读研究生,研究方向:林木种苗学。
*通信作者:史锋厚(1981-),男,山东兖州人,副教授,博士,研究方向:林木种苗学、林木新品种选育。
