干旱胁迫对小叶红叶石楠光合及其他生理作用的影响
2015-06-09吕春华王伟伟
吕春华,陈 芬,王伟伟,王 昊
(1.江苏省农业科学院宿迁农业科学研究所,江苏 宿迁 223800;2.江苏省林业科学研究院,江苏 南京 211153)
干旱胁迫对小叶红叶石楠光合及其他生理作用的影响
吕春华1,陈 芬1,王伟伟2,王 昊1
(1.江苏省农业科学院宿迁农业科学研究所,江苏 宿迁 223800;2.江苏省林业科学研究院,江苏 南京 211153)
以2年生小叶红叶石楠扦插苗为研究对象,通过盆栽控水试验,测定在不同程度的干旱胁迫下叶片相对含水量、丙二醛(MDA)含量、脯氨酸含量、可溶性糖、可溶性蛋白及光响应等生理指标,以分析其生理响应。结果表明:(1)在轻度和中度干旱胁迫下,叶片相对含水量、MDA、脯氨酸和可溶性糖含量与对照之间无显著(P>0.05)差异,而可溶性蛋白含量显著低于对照(P<0.05);在重度干旱胁迫下,叶片相对含水量显著下降,仅为对照的47.16%;MDA含量快速升高且显著高于对照;脯氨酸含量则急剧上升,极显著高于对照;而可溶性糖含量显著下降;可溶性蛋白含量与对照之间没有显著性差异;(2)随着干旱胁迫强度的加剧,小叶红叶石楠光合速率、光饱和点以及表观量子效应均呈下降趋势;(3)综合分析各生理指标,认为小叶红叶石楠在干旱胁迫下,通过减少叶片相对含水量,增加渗透调节物质,降低光合速率等生理响应,来抵御干旱胁迫对其的影响。
小叶红叶石楠;干旱胁迫;生理特性;光响应曲线
小叶红叶石楠(Photinia lochengensis)为蔷薇科常绿灌木或小乔木。其株型紧凑矮化,叶形短小,新叶鲜红亮丽。9月下旬秋梢生长新叶再次呈鲜红色。红叶期长,观赏效果好,并且由于生长较慢可以降低修剪成本,适合于地被景观的营建,在园林绿化中有较高的推广应用潜力。干旱是影响植物生长发育的重要因子之一,目前对红叶石楠干旱胁迫的生理特性的变化已经有了一些研究[1-4],但有关干旱胁迫对小叶红叶石楠研究尚未见报道。本文以2年生小叶红叶石楠扦插苗为研究材料,利用土培的方法,通过测定干旱胁迫对生理及光合的影响,进一步了解小叶红叶石楠对干旱胁迫的适应性,为小叶红叶石楠的推广应用提供理论依据。
1 材料与方法
1.1 试验材料
2年生小叶红叶石楠扦插苗,选择生长健壮,长势一致,无病虫害的植株进行干旱胁迫处理,平均苗高37.87 cm,平均地径0.67 cm。
1.2 试验设计
控水试验区设置在温室中,四周通风而且透光性良好,控制室内温度25~35℃[4]。基质的配比为园土:泥炭土:蛭石=7∶7∶6(体积比),采用烘干称重法测得试验用土壤最大持水量为63.52%。通过水分亏缺的方法实现其干旱胁迫,随机区组设计重复4次,每个重复3株。干旱胁迫参考Hasio[5]和陈卫元[3]的方法划分为4个梯度:对照(CK),土壤相对含水量(RWC,土壤含水量占最大持水量的百分比,下同)为70%~80%;轻度胁迫(T1),RWC为55%~65%;中度胁迫(T2),RWC为40%~50%;重度胁迫(T3),RWC为15%~25%。采用称重法对土壤含水量进行控制,每天18:00对所有试验植株用电子秤进行称重,根据已设置好的含水量和每盆植物的重量,计算出补水量,用量杯按计算的补水量补充水分,使每盆试验植株的土壤含水量均控制在上述试验设计的范围内。
1.3 测定方法
在处理6 d后,于10月22日10:00进行各项指标的取样与测定。
1.3.1 丙二醛、叶片相对含水量与渗透调节物质的测定 丙二醛(MDA)含量测定采用硫代巴比妥酸比色法[6];叶片相对含水量采用饱和含水量测定法[7];脯氨酸参照茚三酮显色法[8];可溶性糖含量测定采用蒽酮法[9];可溶性蛋白采用考马氏亮蓝G-250显色法[8]。
1.3.2 光响应曲线的测定 在植株从顶端向下第5~10片中选取完整的活体叶片,利用Li-6400光合系统测定仪进行测定。测定时外界温度为25~28℃,CO2浓度为380μmol/mol,采用自动测量模式,设定光合有效辐射(PAR)分别为1 200,1 000,800,600,400,200,150,100,75,50,0μmol/(m2·s)。
1.4 数据处理
数据用Excel2007和SPSS17.0进行方差分析和多重对比,并进行图表的绘制,用DPS进行光合模型参数的拟合。采用叶子飘模型来拟合光合曲线,模型的数学表达式为
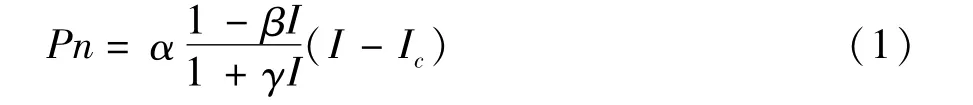
其中α,β,γ为3个系数;I为光合有效辐射;Ic为植物光补偿点;Pn为净光合速率。
2 结果与分析
2.1 干旱胁迫对叶片相对含水量的影响
结果如图1所示,随着土壤相对含水量的减少,植物叶片相对含水量呈下降趋势,从CK到T2逐渐减小,T2到T3下降幅度较大。CK时最大为75.49%,T3时最小为35.60%。对不同处理进行多重比较,CK、T1和T2之间没有显著性差异(P>0.05),T3与各处理间均有极显著性差异(P<0.01)。以上结果表明小叶红叶石楠叶片在轻度和中度干旱胁迫(T1和T2)时叶片失水较少,叶片相对含水量变化不大;重度胁迫(T3)时出现严重失水,相对含水量仅为对照的47.16%。
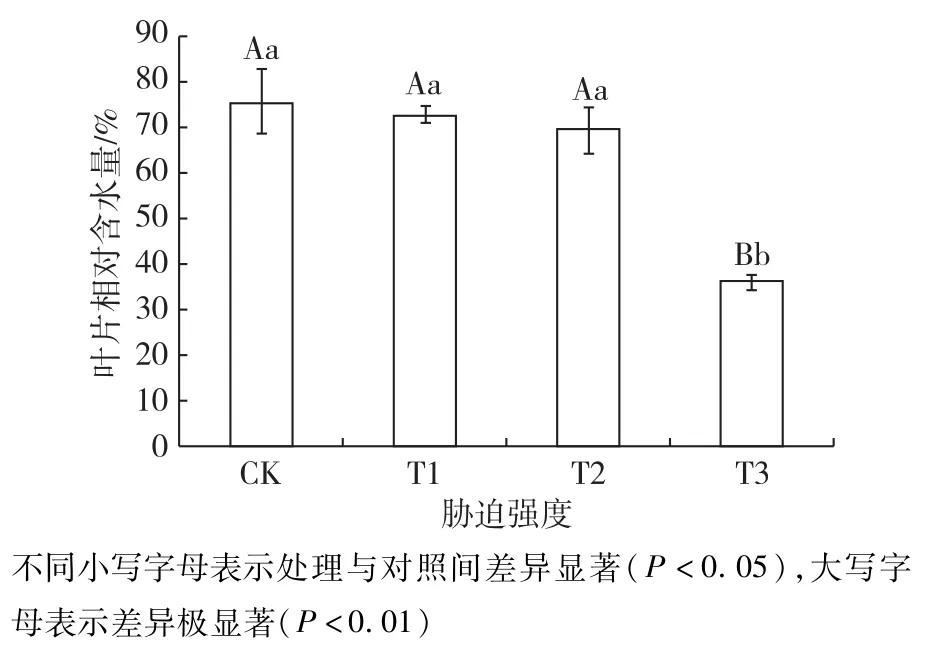
图1 土壤相对含水量对叶片相对含水量的影响
2.2 干旱胁迫对叶片丙二醛(MDA)含量的影响
结果如图2所示,随着土壤相对含水量的减少,MDA含量在CK,T1和T2时基本不变,在T3时急剧升高,是CK的119.29%。对不同处理进行多重比较,CK,T1和T2之间没有显著性差异(P>0.05),T3与各处理间均有显著性差异(P<0.05)。以上结果表明,在轻度和中度干旱胁迫(T1和T2)下,叶片中MDA含量没有明显变化,膜脂的氧化不明显;在重度胁迫(T3)下,MDA含量急剧上升,膜脂出现明显的氧化现象。

图2 土壤相对含水量对叶片丙二醛含量的影响
2.3 干旱胁迫对叶片渗透调节物质含量的影响
2.3.1 脯氨酸含量的影响 结果如图3所示,随着土壤相对含水量的减少,脯氨酸含量在CK和T1时基本相当,T3时急剧增加至最大值,含量最高,是CK的24.80倍。对不同处理进行多重比较,CK、T1和T2之间没有显著性差异(P>0.05),T3与各处理间均达到极显著性差异(P<0.01)。以上结果表明,小叶红叶石楠在轻度和中度干旱胁迫(T1和T2)下脯氨酸含量逐渐上升,重度干旱胁迫(T3)下上升至峰值,开展最大限度的渗透调节。
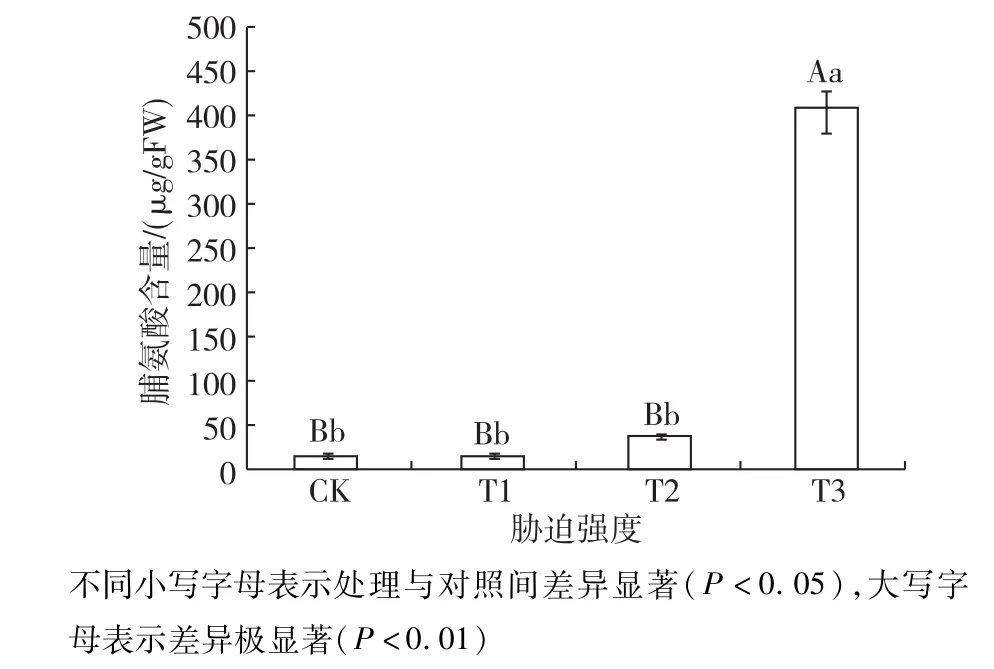
图3 土壤相对含水量对叶片脯氨酸含量的影响
2.3.2 可溶性糖含量的影响 结果如图4所示,随着土壤相对含水量的减少,可溶性糖含量从CK到T2变化平稳,略有升高,从T2到T3急剧下降。T2时含量最高,是含量最少T3时的1.44倍。对不同的处理进行多重比较,T1与T2之间没有显著性差异(P>0.05),CK与T1之间没有显著性差异(P>0.05),CK与T2之间有显著性差异(P<0.05),T3与各处理间均有极显著性差异(P<0.01)。以上结果表明,小叶红叶石楠在轻度和中度干旱胁迫(T1和T2)下,叶片的可溶性糖含量逐渐上升至峰值,开展最大限度的渗透调节,在重度胁迫(T3)下,调节能力降低。
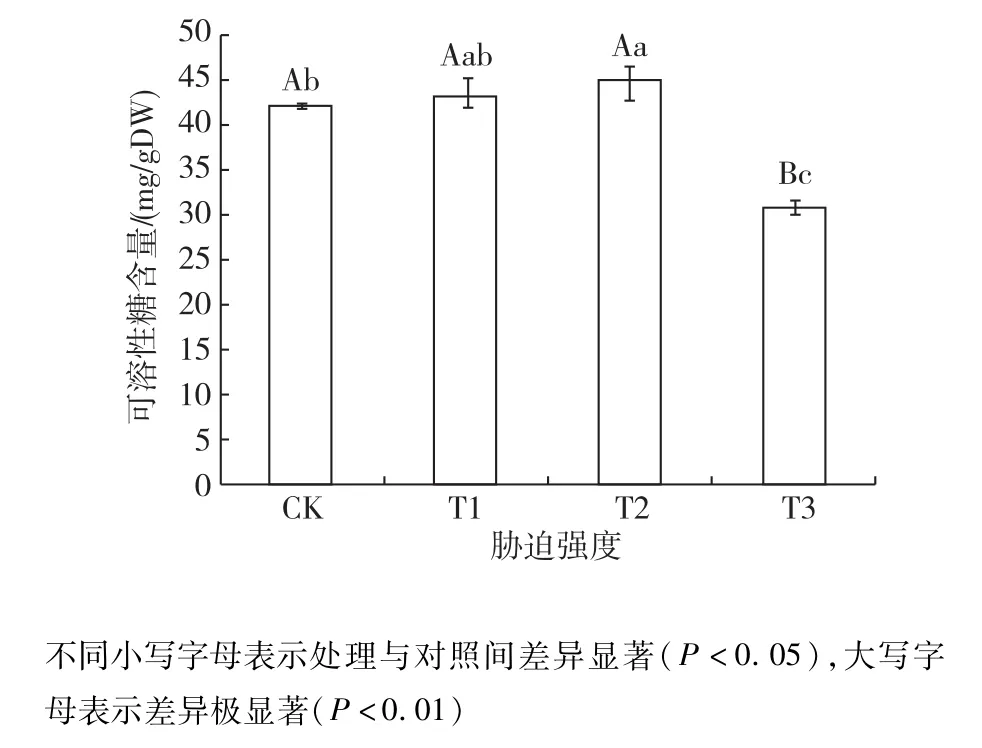
图4 土壤相对含水量对叶片可溶性糖含量的影响
2.3.3 可溶性蛋白含量的影响 结果如图5所示,随着土壤相对含水量的减少,可溶性蛋白含量呈现先减少后增加的趋势。从CK到T1急剧减少,T1和T2含量基本相当,T2到T3含量增加。CK时含量最高,是最低T2时的1.43倍。对不同的处理进行多重比较,CK与T3之间没有显著性差异(P>0.05),T1、T2和T3之间也没有显著性差异(P>0.05),CK与T1,T2之间有显著性差异(P<0.05)。以上结果表明小叶红叶石楠在轻度干旱胁迫(T1)后叶片可溶性蛋白含量迅速减少,并在轻度和中度干旱胁迫(T1和T2)下保持稳定,重度胁迫(T3)时与对照基本持平,可以在一定程度上抵御干旱胁迫造成的伤害。

图5 土壤相对含水量对叶片可溶性蛋白含量的影响
2.4 干旱胁迫对光响应曲线的影响
光合作用是植物生长的生理基础,可以作为判断植物生长势和抗逆性强弱的指标。在不同土壤相对含水量处理下,小叶红叶石楠叶片的净光合速率随着光照度的变化,如图6所示。当光合有效辐射为0~200μmol/(m2·s)时,各处理净光合速率均出现快速上升,光合有效辐射为400μmol/(m2·s)时,净光合速率上升缓慢,随着光强的继续增加,光合速率达到最高点后,光合速率逐渐趋于平稳。各处理下叶片的净光合速率均随光照度的增加而增大,但增大的幅度差异较大。在相同的光照度下,不同土壤含水量下植株净光合速率的大小为CK>T1>T2>T3。
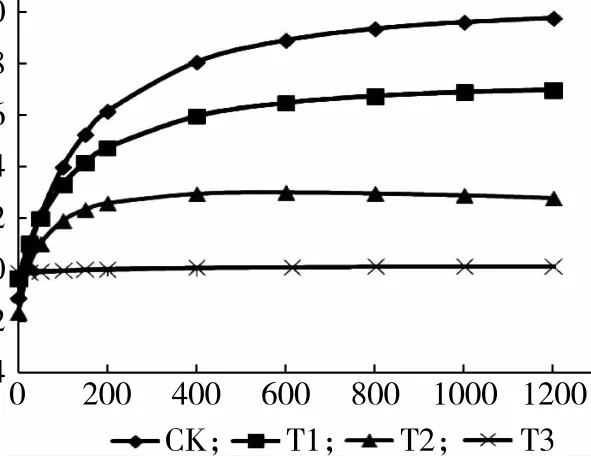
图6 土壤相对含水量对叶片光响应曲线的影响
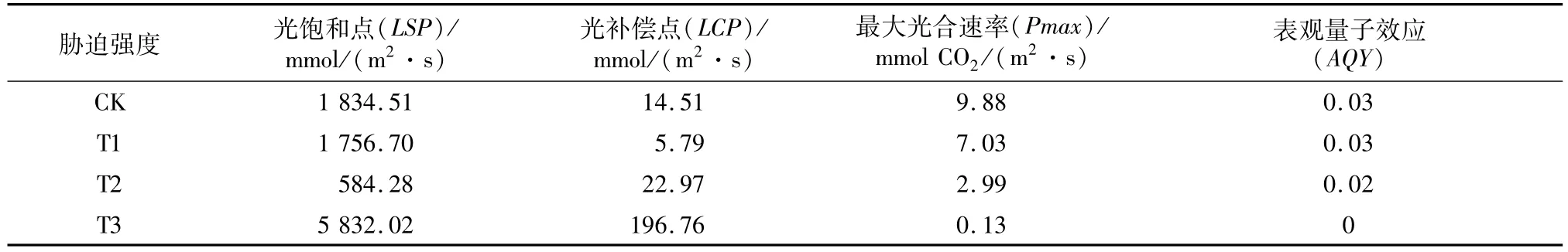
表1 土壤相对含水量对叶片光响应参数的影响
由模型(1)得出不同土壤相对含水量处理下,小叶红叶石楠叶片光响应参数的变化,见表1。干旱胁迫对光饱和点、光补偿点、最大光合速率和表观量子效应都有一定的影响。光饱和点随着胁迫的增加而降低,但重度胁迫下陡然升高;光补偿点在轻度胁迫(T1)时最低,中度和重度胁迫(T2和T3)下增大;最大光合速率随着干旱胁迫的增强而下降,在重度胁迫(T3)下仅为对照的1.30%。表观量子效应随着胁迫浓度的增大而降低,在重度胁迫下基本为0。
3 结论与讨论
干旱胁迫抑制植物的生长,表现出一系列的生理生化反应,如生理活动障碍,光合作用抑制等。通过对植株组织中相对含水量的测定,可以推断植株抗旱性的能力大小。本研究中不同土壤相对含水量对小叶红叶石楠的叶片相对含水量影响较大,重度胁迫(T3)与对照相比,相对含水量有极显著性的降低(P<0.01),仅为对照的47.16%。这与黑加仑及黑心菊的抗旱性中的研究结果相似[10-11]。丙二醛是反映植物膜脂在逆境下遭受伤害的指标,是膜脂过氧化的最终分解产物,其含量高低反映伤害的程度[12]。本研究中,小叶红叶石楠在重度胁迫(T3)时,MDA的含量是对照(CK)的1.19倍,有极显著性提高(P<0.01)。有研究指出,不同品种的常青藤在干旱胁迫下MDA含量均逐渐升高,品种“大飞机”对照与重度胁迫存在显著性提高[13],干旱胁迫对苹果树苗的研究中MDA含量随胁迫程度增大而逐步增加[14],本研究与这些研究结果一致。
渗透调节是植物适应和抵抗干早等逆境的一种重要的调节机制,水分胁迫可以诱使植物细胞内发生溶质积累,渗透势降低的现象,从而保证组织水势下降时细胞膨压得以维持[15],进而保证生理代谢活动的正常进行[16-17],它是植物适应干旱,防止细胞和组织脱水,提高水分利用率最重要的生理机制之一[18]。干旱胁迫下,细胞内积累脯氨酸、可溶性糖、可溶性蛋白质等,以降低细胞的渗透势,增强从环境吸水的能力,维持水分平衡。本研究中,脯氨酸含量随着胁迫强度的增大而增加,在重度胁迫(T3)时,脯氨酸的含量是对照(CK)的1.19倍,有极显著性提高(P<0.01)。研究显示,干旱胁迫导致苹果树苗体内的脯氨酸含量有显著升高[14],在马铃薯的研究中也得到了证实[19]。可溶性糖类参与渗透调节,并可能在维持植物蛋白质稳定方面起到重要作用[20]。本研究中,小叶红叶石楠叶片可溶性糖含量随胁迫强度的增加,表现出先增加后减少的趋势。相比于干旱条件下苹果树幼苗和黄麻幼苗的可溶性糖含量显著增加[14,21],本研究中重度胁迫(T3)时,可溶性糖含量有极显著性的降低(P<0.01),这可能是在重度胁迫(T3)下小叶红叶石楠以脯氨酸为主要的渗透调节物质,以抵抗外界的不良环境。本研究中可溶性蛋白含量随着胁迫强度的增大略有增加,但均低于对照。这与苹果树幼苗和“星白”勋章菊的干旱胁迫试验中的结果有区别[14,22]。这可能与植物对干旱胁迫的适应范围和适应机制有关。在轻度和中度(T1和T2)下,植物受伤害较小,主要通过可溶性糖和脯氨酸来进行渗透调节,可溶性蛋白在小叶红叶石楠中的调节作用较小。小叶红叶石楠在轻度干旱胁迫(T1)后叶片可溶性蛋白含量迅速减少,并在轻度和中度干旱胁迫(T1和T2)下保持稳定,重度胁迫(T3)时与对照基本持平,可以在一定程度上抵御干旱胁迫造成的伤害。
光响应曲线可反映植物净光合速率随光照强度增减的变化规律。植物光补偿点(LCP)越小,其利用弱光的能力越强;在光饱和点(LSP)时光合速率最大,反映了植物利用强光的能力;表观量子效率越高,说明植物光能利用率越高。本研究中,光饱和点随着胁迫的增加而降低,说明干旱胁迫越大,植物越易受到光抑制。在轻度胁迫(T1)时,对弱光的利用能力最强,随着胁迫强度的增强对弱光的利用能力减小。表观量子效应随着胁迫强度的增大而降低,重度胁迫(T3)时对光能的利用率几乎为零。
综上所述,当环境中可利用的水分低到不足以维持植物正常生命活动需要时,植物就会表现出一系列的生理生化反应。小叶红叶石楠通过降低叶片相对含水量、增加渗透调节物质以降低细胞水势。同时,通过减小光合速率,提高对光能的利用率来抵抗干旱胁迫对其造成的影响。
[1] 申亚梅,童再康,张 露.干旱胁迫对红叶石楠等3个观赏品种生理特性的影响[J].江苏农业大学学报,2006,28(3):397-402.
[2] 曹 晶,姜卫兵,翁忙玲,等.夏秋季旱涝胁迫对红叶石楠光合特性的影响[J].园艺学报,2007,34(1):163-172.
[3] 陈卫元,曹 晶,姜卫兵.干旱胁迫对红叶石楠叶片光合生理特性的影响[J].中国农学通报,2007,23(8):217-220.
[4] 王伟伟,吕春华,窦全琴.小叶红叶石楠和红叶石楠对干旱胁迫的生理响应[J].江苏林业科技,2014,41(5):19-22.
[5] Hsiao T C.Plant response to water stress[J].Plant Physiology,1973(24):519-570.
[6] 赵世杰,史国安,董新纯.植物生理学实验指导[M].北京:中国农业科学技术出版社,2002.
[7] 张志良.植物生理学实验指导:2版[M].北京:高等教育出版社,1991.
[8] 李合生,孙 群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[9] 郝再彬,苍 晶,徐 肿.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004.
[10]热依扎·朱木斯别克,王燕凌,文 旭.干旱胁迫对黑加仑品种渗透调节物质和质膜相对透性的影响[J].新疆农业大学学报,2013,36(1):46-50.
[11]杜国平,邹 青,连芳青,等.黑心菊抗旱性生理生化指标的研究[J].江西农业学报,2012,24(12):42-45.
[12]Hodges D M,Delong JM,Foney C F,et al.Improving the thiobarbituric acid reactive substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J].Planta,1999,207(4):604-611.
[13]赵和文,崔金腾,王 杰,等.干旱胁迫下常春藤响应的生理生化机制[J].中国农学通报,2013,29(7):12-19.
[14]刘忠霞,刘建朝,胡景江.干旱胁迫对苹果树苗活性氧代谢及渗透调节的影响[J].西北林学院学报,2013,28(2):15-19.
[15]Serraj R,Sinclair T R.Osmolyte accumulation:can it really help increase crop yield under drought conditions[J].Plant Cell and Environment,2002,25(2):333-341.
[16]Khalil A A M,Grace J.Acclimation to drought in Acer pseudoplatnus L.(Sycamore)seedlings[J].Journal of Experimental Botany,1992(43):1591-1602.
[17]Turner NC,SternW R,Evans P.Water relationsand osmotic adjustment of leaves and roots of lupins in response to water deficits[J].Crop Science,1987,27(5):977-983.
[18]Morgan J A.Interaction of water supply and N in wheat[J]. Plant Physiology,1984,76(1):112-117.
[19]丁玉梅,马龙海,周晓罡,等.干旱胁迫下马铃薯叶片脯氨酸、丙二醛含量变化及与耐旱性的相关性分析[J].西南农业学报,2013,26(1):106-110.
[20]赵江涛,李晓峰,李 航,等.可溶性糖在高等植物代谢调节中的生理作用[J].安徽农业科学,2006,34(24):6423-6425,6427.
[21]黎 栋,杨 健,窦俊焕,等.黄麻幼苗期对干旱胁迫的形态生理响应及抗旱性评价[J].西南农业学报,2013,26(1):125-130.
[22]吴阳清,周晓慧,王永亮,等.“星白”勋章菊对干旱处理的生理响应[J].江西农业大学学报,2013,35(1):80-83.
Effect of drought stress on the photosynthetic trait and another physiology of Photinia lochengensis seedling
LYU Chun-hua1,CHEN Fen1,WANGWei-wei2,WANG Hao1
(1.Suqian Institute of Agricultural Sciences,Jiangsu Academy of Agricultural Sciences,Suqian,223800 China;2.Jiangsu Academy of Forestry,Nanjing 211153,China)
By using the leaves of two-year-old Photinia lochengensis cutting seedling,we determined RWC(relative water content),MDA,proline,soluble sugars,soluble proteins and light response under different levels of drought stress.The resultshowed as follows,(1)Undermild andmoderate droughtstress,no significant(P>0.05)difference occurred in RWC,MDA,proline and soluble sugar content between treatments and CK while the soluble protein content of treatmentswas significantly(P<0.05)lower.(2)Under severe drought stress,RWC decreased significantly,only 47.16%of CK.MDA and proline content increased rapidly,significantly higher,and extremely significantly higher than CK.Soluble sugar content decreased significantly.No significant difference appeared in soluble protein content between treatment and CK.(3)With the intensification of drought stress,photosynthetic rate,light saturation point and apparent quantum effect declined.We concluded that under drought stress,by reducing RWC,increasing osmolytes,lowing photosynthetic rate and another physiological responses,Photinia lochengensis gained drought resisting capacity.
Photinia lochengensis;Drought Stress;Physiological trait;Light response curve
S687
A
10.3969/j.issn.1001-7380.2015.01.003
1001-7380(2015)01-0011-05
2014-09-25;
2014-11-05
江苏省农业科技自主创新资金项目“矮生红叶石楠规模化生产技术集成创新示范”(CX(12)3010)
吕春华(1975-),女,江苏宿迁人,高级工程师,大学本科毕业,从事林木育种科研工作。E-mail:lchua740414@126.com。
