微生物碳酸酐酶在岩溶系统碳循环中的作用与应用研究进展
2015-06-09吴雁雯张金池
吴雁雯,张金池
(南京林业大学林学院,江苏省水土保持与生态修复重点实验室,江苏南京210037)
微生物碳酸酐酶在岩溶系统碳循环中的作用与应用研究进展
吴雁雯,张金池
(南京林业大学林学院,江苏省水土保持与生态修复重点实验室,江苏南京210037)
岩溶动力系统是一个三相不平衡开放系统,该系统在由生物圈主导的四圈层间进行物质循环与能量流动,以CO2-H2O-CaCO3循环为主进而对全球碳循环起到推动作用。碳酸酐酶(carbonic anhydrase,CA)是一种以Zn为活动中心的金属酶,在微生物中广泛存在,通过催化CO2的水合反应对岩溶动力系统中的碳循环起到驱动作用。综述了微生物碳酸酐酶结构与功能的研究历程,系统阐述了该酶对岩溶动力系统碳循环的重要驱动作用,并结合化工业上对该酶开发应用的相关成果,为破坏山体恢复技术的应用与发展提供新思路。
微生物碳酸酐酶;岩溶动力系统;碳循环;破坏山体恢复
岩溶生态系统是地球表层系统的重要组成部分,全球岩溶面积占陆地面积的12%。中国岩溶地区分布广泛,发育成熟,类型多样,该类型地区常见土壤遭受严重侵蚀,岩石裸露,植被难以生长等极端表现。
生物是地球表层系统中最为活跃的地质营力之一,研究发现,通过以碳循环为主的作用过程,生物圈在地球表层系统中具有捕获、赋存及转化太阳能,驱动表层物质与能量循环,引发包括岩溶作用在内的各种表层地质作用。随着生物岩溶作用研究的不断深入,张捷等[1]探究了地表与土壤中细菌、真菌对岩溶侵蚀过程的影响及其对CaCO3沉淀的促进作用,并对研究结果作了初步探讨和总结。通过分析,微生物在代谢过程中产生的有机酸及相关酶类可加快石灰岩的溶蚀速率[2]。在众多酶类中,微生物所产的碳酸酐酶已逐渐成为近年来研究的热点。
自碳酸酐酶于1963年在Neisseria Sicca中被首次确定存在以来,该酶对石灰岩的溶解作用逐渐引起学者关注,刘再华[3]以牛碳酸酐酶为材料的研究发现,生物中的碳酸酐酶是催化微生物风化碳酸盐岩的关键酶,并证明在室内模拟条件下,对石灰岩在高CO2分压时其溶解速率可增加10倍,对白云岩则主要在低CO2分压时溶解速率增加,可达3倍左右;余龙江等[4]在岩溶系统中加入细菌胞外碳酸酐酶粗提液,证明其对石灰岩的溶蚀具有较强的驱动作用。
利用碳酸酐酶对岩石溶蚀的作用,加快岩石成土的速率,并与近年来发展较快的客土喷播技术相结合,从而提高该技术应用的有效性。这一技术上的创新将对岩溶地区生态环境中岩壁裸露、水土大量流失等问题起到有效的治理与修复作用。
1 相关概念与背景
1.1岩溶动力系统中碳循环过程
岩溶生态系统由无机环境(包括偏碱性可溶岩,贫瘠土壤和具有双层结构的特殊水文系统)和有机生命(岩溶植被和地下生物群落)组成。其中的无机环境方面即为基于岩溶系统中的物质与能量迁移、循环的研究而提出的“岩溶动力系统”(KDS)[5],该系统是控制岩溶形成与演化,并受已有岩溶形态的制约,在岩石圈-水圈-大气圈-生物圈界面上的、以CO2-H2O-CaCO3循环为主的三相不平衡开放系统。可用图1所示概念模型来描述岩溶动力系统的结构。

图1 岩溶动力系统概念模型[6]Fig 1 Karstdynam ic system conceptualmodel[6]
由此可见,当大气中大量CO2进入该系统时,就会促进溶蚀作用的发生,进入的CO2越多则溶蚀作用越强烈;而当有大量CO2从该系统逸出时,就会促进系统中沉积作用的发生,逸出的CO2越多,沉积作用越明显。岩溶动力系统中存在丰富的碳酸盐岩,而碳酸盐岩中的碳库容量占全球总碳量的99.5%,是地球上最重要的碳库,因此岩溶作用的强度决定着全球碳循环的速率与进程,即该系统可通过驱动岩溶作用调节大气中CO2含量,从而对全球碳循环起到重要的源汇作用。
国际地质对比计划项目“IGCP379”的研究结果表明,生物对岩溶动力系统的运行过程具有不可替代的作用[7]。而微生物在该系统中则可通过自身代谢活动与产物,以CO2为中心环节将生物圈碳循环与“CO2-H2O-碳酸盐岩”三相不平衡开放岩溶动力系统相耦联[8]。因此,微生物的代谢活动在对岩石动力系统的研究过程中愈加受到关注,而如碳酸酐酶等相关代谢产物在微生物界的分布范围与类型的探究也日趋成熟。
1.2 碳酸酐酶的种类与分布
碳酸酐酶是一种以Zn为活动中心,广泛存在于生物界的一种金属酶,可催化二氧化碳(碳酸酐)可逆的水合反应,目前该酶在生物界中的种类、分布、功能与结构受到众多学者的关注[9]。
碳酸酐酶分为α、β、γ、δ和ε共5个家族,5个家族之间不存在显著的序列同源性,显示它们是趋同进化的典型[10]。
其中,α类碳酸酐酶从5~6亿年前一个共同的原始基因进化而来,已发现的α-碳酸酐酶有单体亚基组成,也存在二聚体或三聚体亚基组成,其Zn2+配体由3个组氨酸残基构成。该类碳酸酐酶被证明存在于脊椎动物、高等植物的胞浆、藻类的胞浆、真菌以及一些细菌中[11],但至今未在古生菌中发现α碳酸酐酶的存在。同时,所有动物来源的碳酸酐酶被证实都属于α-家族[12],α类碳酸酐酶几乎参与到哺乳动物的所有组织的各种生命活动中,并存在至少14种不同的同工酶,其中就包括了对CO2水合反应催化效率最高的研究热点——碳酸酐酶Ⅱ[13]。据推测,β类碳酸酐酶与α类碳酸酐酶进化年代接近但组成该类碳酸酐酶的亚基数目范围从二聚体到八聚体,因此更具多样性。且与α类碳酸酐酶对磺胺类抑制剂的高敏感度不同,β类酶对抑制剂的敏感度较低,主要存在于高等植物及藻类叶绿体中,并在植物的光合作用过程中起重要作用。γ类碳酸酐酶简称“Cam”,首次发现于古细菌Methanosarcina thermophila中,被认为30亿年至45亿年前进化而来,对抑制剂的高敏感度有利于其固定化的研究。该类碳酸酐酶主要存在于细菌和古生菌中,在高等植物与真菌中也有分布。δ类碳酸酐酶主要存在于海洋硅藻中,而ε类碳酸酐酶则主要存在于蓝细菌,硅藻及一些化能自养型细菌中,两类碳酸酐酶皆由二聚体构成,是近年确定的类型,其相应的各方面研究有待进一步深入。
碳酸酐酶Ⅱ是其中最具代表性的含锌金属酶,其分子近似球形。活性中心主要包括:1)一个由Zn2+和94,96,119号组氨酸残基咪唑基侧链上的3个N原子与亲核基团-OH-中的O原子所形成包含四价金属的多面体,该部分的苏氨酸-199在反应中起到接受与提供氢键的作用;2)靠近上述多面体处存在一结合有CO2的疏水袋,由Val-121,Leu-141,Val-143,Leu-198和Trp-209构成,水合反应的进行或阻断即由此部分决定。
当碳酸酐酶Ⅱ结构中的His94被突变为Asp时,但其分子酸解离常数pK值由6.8上升到9.6,同时催化对-硝基乙酸苯酯水解的二级速率常数却明显下降,由此可以证明阴离子配位可导致碳酸酐酶催化活性变化。在基因定点突变技术的引入使得对碳酸酐酶活性位点改造成为可能,并在证明其结构对催化功能影响的研究中起到重要作用。
2 微生物碳酸酐酶对碳循环的作用
在岩溶系统特有的双层结构中,微生物不仅分布于其地表层,更活跃于其地下层,土壤中的CO2浓度与微生物的酶化学反应息息相关,土壤微生物是土层中碳酸酐酶的重要来源之一。随着研究的深入,发现碳酸酐酶不仅广泛分布于真菌、细菌与古生菌中,在部分放线菌中也检测到该酶的存在[14]。近年来,研究者对生物岩溶微形貌形成机理中动植物与藻类等生物的碳酸酐酶所起作用进行了大量研究[15-17],并逐渐将研究的焦点聚集于岩溶地区中大量存在的真菌、细菌等微生物的碳酸酐酶。
2.1微生物碳酸酐酶对碳循环的直接作用
碳酸盐岩作为地球上最重要的碳库,在其岩溶过程中CO2的水合反应,即:CO2+H2O⇔H++,是重要的限速步骤。研究中发现,无碳酸酐酶催化时,上述可逆反应要达到平衡需1m in;在有碳酸酐酶催化时,要达到平衡只需10-6s[18]。
其反应催化机理如下[19]:

即:
1)与Zn2+相连的H2O在一定生理条件下去质子化形成EZnOH-,生成的EZnOH-对疏水袋中的反应底物CO2具有极强的亲核性,二者可结合形成EZn,其中的会被溶剂中的H2O取代而生成EZnH2O与;2)EZnH2O通过碳酸酐酶中的质子转运体将H+转运至溶剂,同时还原成具催化活性的EZnOH-,该步骤是催化过程的限速步骤,通过酶分子活性区域的His-64完成。
该水合反应产生的H+会影响CaCO3的电离平衡,对碳酸盐岩的溶蚀产生驱动作用,即:

通过这一可逆反应,碳酸酐酶不仅可以促进碳酸盐岩的风化,还可以通过吸收大气中的CO2来固定碳源,从而参与到岩溶动力系统的碳循环过程中,并起到不可忽视的驱动作用。由于结构的不同,不同属的碳酸酐酶对该反应的催化速率不同,而对催化过程中的相关条件依赖性也不尽相同,有关详细研究会在本文对碳酸酐酶应用的研究部分进行阐述。
以牛碳酸酐酶为材料的研究发现,生物中的碳酸酐酶是催化微生物风化碳酸盐岩的关键酶。李为等[20]在西南不同岩溶生态系统采集土壤样品进行实验,在自然岩溶生态条件下检测到不同区系表层土壤都有碳酸酐酶分布,并在细菌菌株中广泛存在。微生物中的碳酸酐酶以胞内碳酸酐酶与分泌到细胞外的胞外碳酸酐酶两种形式存在,其中主要由胞外碳酸酐酶通过促进岩溶作用对岩溶地区碳循环起到直接的驱动作用。经比较,岩溶环境中放线菌的胞内碳酸酐酶活性较高,而真菌的胞外碳酸酐酶活性较高,且真菌对碳酸盐岩溶蚀效果相对放线菌更好。对真菌溶蚀机理进一步探究后可得:影响溶蚀作用速率的程度从大到小依次为真菌菌丝>真菌有机酸物质>真菌碳酸酐酶[21]。
作为地球表层分布最为广泛的生命形式,微生物与矿物的相互作用不仅是其对岩石风化的促进作用,还包括其对矿物沉积的控制作用。微生物的矿化作用可分为诱导矿化作用和控制矿化作用,前者形成矿物类型受环境条件制约,多出现于原核生物和真菌中。在自然条件下的矿化作用十分缓慢,约需数百年之久,而CO2矿化作用的本质是Ca2+与水中的CO2之间发生的反应[22],因此碳酸酐酶的参与可极大提高这一反应速率。
有研究发现,细菌作用于包括溶蚀、络合、转换以及结晶成核的全部成矿过程中,并形成具有明显专属性的菌生矿物[23]。近代以来海洋生物专家对碳酸酐酶与海洋生物的钙化沉积作用进行了细致研究,经SEM检测证明碳酸酐酶因催化CaCO3的电力平衡而参与到珍珠层CaCO3晶体的形成过程中[24]。在其他对珊瑚等海洋生物钙化作用的研究中,李强[25]也从氨基酸序列对比等不同角度证明了碳酸酐酶对矿化沉积作用的重要性,在一定程度上可以控制形成的CaCO3晶体构造。在对藻类碳酸酐酶活性的分析中发现白水台钙华池内的微藻胞外碳酸酐酶活性较高,间接证明碳酸酐酶通过催化CO2水合逆向反应促进碳酸钙的沉积。有研究证明[26],生物从周围环境中选择性吸收生长代谢所需营养元素,并对生物酶等在微生物形成功能性碳酸盐结构过程中所起调控作用进行了分析。李辉等[27]在以胶质芽孢杆菌诱导碳酸钙颗粒形成的过程中发现,该细菌在利用本身较强的风化能力溶蚀岩矿的同时,联合分泌的胞外碳酸酐酶促进碳酸钙的沉积,沉积作用的速率与碳酸酐酶的活性呈正相关。对前期相关研究总结的基础上,连宾等[19]提出微生物对碳酸盐矿物的破坏作用具有选择性,而对矿化沉积产生晶体的结构形貌则具有显著的调控作用。
观察发现[28],有CO2的溶解吸收参与的全球水循环可形成重要的CO2汇。而在与碳酸盐岩之间的作用过程中,微生物碳酸酐酶对岩溶动力系统水体环境中的水体pH值、氧化-还原电位、无机碳组成与含量、阴阳离子含量与组成以及钙化作用等产生影响,并由此影响水体环境中的CO2浓度、pH值、Eh、等指标。由此可见,一方面碳酸盐岩的风化不仅直接关系到水体的供给量,影响水体中碳通量的平衡,且可以直接回收大气圈中CO2;另一方面,水体生物矿化沉积又可向大气圈释放CO2,从而影响温室气体的变化。
2.2微生物碳酸酐酶对碳循环的间接作用
碳酸酐酶作为无机碳的浓缩机制广泛存在于生物体内,通过催化CO2与之间的相互转换,大大提高其反应速率[29],从而为机体正常的生长代谢提供充足的CO2或,并参与完成机体内CO2或输送过程。对某些植物而言,碳酸酐酶是其固定CO2所不可或缺的,在对诸如玉米,大豆[30]等农作物的研究中发现,碳酸酐酶参与植物的光合作用,并对植物体细胞内外的碳素转移和利用过程起到显著调节作用。碳酸酐酶的存在,不仅对许多真核生物生长过程中的呼吸作用、光合作用、离子运输、酸碱平衡、钙化作用等生理活动是必不可少的,并且在原核生物的生理代谢中也起到重要作用。通过CO2浓缩机制,碳酸酐酶为蓝藻提供无机碳原料,以助于蓝藻在水分胁迫或CO2浓度过低等恶劣环境条件下正常生长,提高其对极端环境的适应能力。
不仅如此,碳酸酐酶在古细菌与细菌界的普遍分布及多种碳酸酐酶出现于同一生物个体中的现象说明其对生物机体有多样的作用,例如E.coli中的氰酸盐诱导型碳酸酐酶可提高E.coli对氰酸盐的抗毒性并将其转化为生长所需氮源。除此之外,碳酸酐酶还可以通过将CO2转换为推动机体内脱羧反应的进行。
以上研究证明,碳酸酐酶在微生物中的作用无处不在,并可以通过帮助机体在恶劣或极端环境下维持正常的代谢与生长,促进各类微生物在碳酸盐岩表面广泛分布与殖居,从而更利于其对岩石的风化作用的发生,对岩溶系统的碳循环起到显著的驱动作用。可用图2表示微生物碳酸酐酶对岩溶动力系统碳循环的驱动作用。
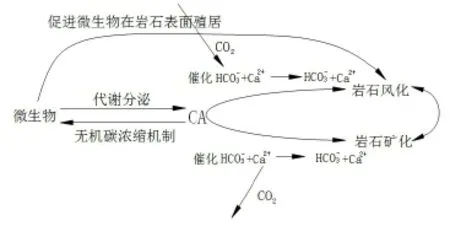
图2 微生物碳酸酐酶驱动碳循环模型(图中CA表示碳酸酐酶)Fig 2 M icrobial carbonic anhydrase drive carbon cyclemodel
3 微生物碳酸酐酶的分离技术与特性
微生物碳酸酐酶的分布与活性受生态系统、岩溶地形、植被覆盖等因素影响,并与其存在的岩溶系统特性高度相关[18],同时诸如温度、pH值、无机碳浓度等因素也对碳酸酐酶的活性产生影响。在对西南岩溶生态系统的研究中发现[30],在20~30℃,中性偏碱性条件下,细菌的胞外碳酸酐酶活性较高。小新月菱形藻分泌的胞外碳酸酐酶在高浓度CO2环境中,催化活性受到抑制[15]。水环境中的光合细菌等可通过碳酸酐酶催化自体的各类代谢活动,进而通过岩-气-水作用影响全球碳循环。虽然碳酸酐酶对岩溶系统碳循环的驱动作用已得到证实,但要将微生物碳酸酐酶的这一作用应用到自然条件相对恶劣的岩溶地区并起到预期效果,则应当对其分离纯化、热稳定性以及固定化等方面进行着重研究。
3.1碳酸酐酶的分离纯化
加强碳酸酐酶驱动岩溶地区碳循环的作用,首先应当探究如何在应用中使其高效表达,因此,对碳酸酐酶分离纯化技术的要求也随之提高。已有报道证明,在适宜条件下,以含有相应碳酸酐酶抑制剂的洗脱剂可将碳酸酐酶洗脱,从而分离纯化碳酸酐酶。因此,对碳酸酐酶分离纯化技术的研究逐渐演化为碳酸酐酶抑制剂的探究。早在20世纪60年代,一种对位氨甲基磺胺药物——磺胺米隆就被作为亲和层析的非水溶性填充原料运用于碳酸酐酶的纯化。20世纪80年代,碳酸酐酶抑制剂的研究得到进一步发展,多种碳酸酐酶Ⅱ的抑制剂被发现,其结构与抑制作用的关系及生物活性也被深入探究。相应的纯化方法与大致流程也被总结为:收集样品-分层沉淀-透析除盐-亲和层析-得纯化碳酸酐酶。同时,针对耐热性较高的碳酸酐酶纯化则通过离子交换层析来实现,而p-AMBS亲和层析则是分离纯化碳酸酐酶所必需的。
随着研究的深入,芳基磺胺类药物被作为碳酸酐酶最具代表性的抑制剂,被广泛应用于各个领域,其他诸如阴离子抑制剂(CN-、HS-、NCO-等)、苯酚也被证明对碳酸酐酶的活性具有抑制作用。计算机技术的发展使定量构效关系这一方法被逐渐引入到碳酸酐酶的研究中[31],在对碳酸酐酶抑制剂作用效果的分析上起到重要作用。近期研究[32]从分子动力学的角度对该抑制剂对碳酸酐酶活性的抑制作用以及两者结合的过程进行了详尽的分析。在未来的研究中,发现选择性强且组织特异性高的碳酸酐酶抑制剂以及探索更便捷准确操作性强的分析方法应成为主要内容。
3.2碳酸酐酶的热稳定性
由于碳酸酐酶不属于土壤酶,其热稳定性与酶活性在水热条件剧烈变化的岩溶环境中受到极大限制。
Savile等研究证明[33],自人体中提取的碳酸酐酶催化最适温度是37℃,与人体的正常体温相当。而超嗜热古生菌生长代谢最适宜的温度高达98℃,在该种微生物机体中已发现碳酸酐酶的存在[34]。在接下来的探究中发现,嗜热微生物机体中存在的碳酸酐酶多具有良好的热稳定性。以CAM为例,55℃时,其催化速率常数高达105s-1并在70℃条件下存在15min后仍保留50%反应活性,而从克劳氏芽孢杆菌中提取的α-碳酸酐酶,其热稳定性更大于CAM。存在于从嗜热生物体Cam inibactermediatlanticus DSM 16658中的碳酸酐酶,经验证在温度达到109℃时才失去活性,且在100℃的碱性环境中,15min后仍可保持40%活性并发挥催化作用。余龙江等[4]从中国西南岩溶地区筛选出的细菌GLCa102中提取出胞外碳酸酐酶,在最高60℃条件下处理30m in后仍能保持一定活性。
因此,如何使碳酸酐酶在高温的碱性条件下具有更高稳定性,并持续高效地发挥催化作用是一个值得深究的问题。近期的研究中,高伟芳[35]尝试以吸附-交联法、共价结合法与包埋-交联法3种不同方法,分别以酸性氧化铝、硅藻土、海藻酸钠-聚乙烯醇为载体进行碳酸酐酶固定化,分析固定化条件,并对固定化效果进行对比分析。通过对传统固定方法的耦合,形成新的固定法,从而提高碳酸酐酶的催化活性与稳定性。
4 微生物碳酸酐酶在生态恢复领域的可能应用前景
碳酸酐酶在医学、材料学、矿物学等方面的应用已取得令人瞩目的成绩,而在生物固碳方面的研究也经历了游离态碳酸酐酶-固定化碳酸酐酶-酶膜生物反应器这三大发展阶段,进入较为成熟的研究阶段。这种仿生固碳方式可以提高捕集大气中CO2的效率,减少温室气体的含量,对全球温室效应起到缓解作用。但如何降低该方法的成本以及减少应用时的环境条件制约因子,使其更好的发挥效果,是后期研究的主要方向。
中国具有世界上最为典型的喀斯特景观,喀斯特地区生境脆弱,成片岩石裸露,植被破坏严重且很难恢复。经过多年探索研究,针对喀斯特地区环境恶化,“石漠化”严重,土地丧失生产力等现象开发出相应的生态修复措施。而将碳酸酐酶催化CO2的水合反应应用到退化喀斯特地区驱动岩石的风化作用,则为改善该地区生态环境提供了一个新思路:可将该酶的应用与破坏山体恢复的覆绿喷播技术相结合,添加含有该酶的微生物到喷播基质中,通过微生物分泌的碳酸酐酶作用,驱动碳酸盐岩风化成土,从而使基质中的植物种在该环境下更易成活,并提高基质对岩壁的黏着力,促进基质在岩壁上附着,对喀斯特地区生态环境起到较好的改良作用。
运用于喀斯特地区生境恢复的碳酸酐酶需适应该地区的环境与气候变化,因此由该地区较常见的微生物代谢生成将对岩溶地区具有良好的适应性,更有利于生态修复技术作用的发挥。可以产生并含有碳酸酐酶的微生物种类繁多,其中胶质芽孢杆菌是较为典型和广泛应用的一种。近期研究表明,胶质芽孢杆菌在生长繁殖过程中产生多种重要的酶类,是一株较典型的可分泌碳酸酐酶微生物。在不同培养条件下,胶质芽孢杆菌分泌碳酸酐酶的能力发生变化。无N条件下培养,胶质芽孢杆菌数量较少、荚膜肥厚,所产碳酸酐酶活力较低,有N条件下则培养液中碳酸酐酶活性较高[36]。作为一种优质的产酶候选菌种,胶质芽孢杆菌不仅可分泌大量碳酸酐酶促进喀斯特地区岩石风化,同时具有良好的溶P、固N功能,并且可分泌具有吸附与持水效果的多糖类物质。结合前期研究尝试调整胶质芽孢杆菌的培养条件,可以提高碳酸酐酶产量,同时改善其分泌其他多糖类物质的能力,从而将之充分应用到恢复破坏生境的技术中。
5 结语与展望
近年来国内外对碳酸酐酶对岩溶动力系统作用的研究中可以看出在岩溶地区广泛分布的碳酸酐酶通过催化CO2水合作用,对该类地区的碳循环起到较大的驱动作用,进而影响到全球碳循环进程。不同微生物机体中碳酸酐酶的多样性也导致其功能和作用条件的不同,在今后的研究中应将重点放在探究调控碳酸酐酶催化活性的基因序列以及寻找对岩溶地区环境适应性强的微生物碳酸酐酶种类,并在推广应用中探索更加便捷经济的碳酸酐酶固定化技术,保证该酶的催化功效得以稳定高效地发挥,使该酶在生态环境恢复中的应用得以推广。
[1]张 捷,李升峰,周游游.细菌、真菌对喀斯特作用的影响研究及其意义[J].中国岩溶,1997,16(4):82-89.
[2]WeiT,DongW J,YuanW P,etal.Influence of the carbon cycle on the attribution of responsibility for climate change[J].Chinese Science Bulletin,2014,59(19):2356-2362.
[3]刘再华.碳酸酐酶对碳酸盐岩溶解的催化作用及其在大气CO2沉降中的意义[J].地球学报,2001,22(5):477-480.
[4]余龙江,吴 云,李 为,等.西南岩溶区土壤细菌胞外碳酸酐酶的稳定性研究[J].生命科学研究,2004,8(4):365-370.
[5]袁道先,章 程.岩溶动力学的理论探索与实践[J].地球学报, 2008,29(3):355-365.
[6]袁道先.“岩溶作用与碳循环”研究进展[J].地球科学进展,1999, 4(5):425-432.
[7]Philip A B,Elizabeth RH,Melanie JL,etal.Carbon cycling w ithin an EastA frican lake revealed by the carbon isotope composition of diatom silica:a 25-ka record from Lake Challa,M t.Kilimanjaro[J].Quaternary Science Reviews,2013,66(15):55-63.
[8]曾广智,黄火强,谭宁华,等.碳酸酐酶Ⅱ及其抑制剂研究进展[J].云南植物研究,2006,28(5):543-552.
[9]Tripp B C,Sm ith K,Ferry JG.Carbonic anhydrase:new insights for an ancientenzyme.[J].Journalof BiologicalChem istry,2001, 276(52):48615-48618.
[10]Bahn Y S,Mühlschlegel FA.CO2sensing in fungi and beyond.[J].CurrentOpinion in M icrobiology,2006,9(6):572-578.
[11]Moroney JV,Bartlett SG,Samuelsson G.Carbonic anhydrases in plants and algae[J].Plant Cell&Environment,2001.24(2): 141-153.
[12]Loferer M J,Tautermann C S,Loeffler H H,et al.Influence of backbone conformations of human carbonic anhydrase IIon carbon dioxide hydration:hydration pathways and binding of bicarbonate.[J].American Chem ical Society Journal,2003,125(29): 8921-8927.
[13]LiW,Yu L J,Yuan D X,etal.Bacteria biomass and carbonic anhydrase activity in some karst areas of Southwest China[J].Journalof Asian Earth Science,2004,24(2):145-152.
[14]孙新健,罗生军,范晓蕾,等.产油藻株Scenedesmus sp胞外碳酸酐酶活性及光合作用活性的研究[J].可再生能源,2012,30(11): 99-103.
[15]王 铭,桑 敏,李爱芬,等.不同理化因子对雨生红球藻CG-11碳酸酐酶活性的影响[J].植物生理学通讯,2010,46(7):701-706.
[16]聂 磊,萧洪东,侯雨佳,等.不同光照条件下石灰岩表面蓝藻生物岩溶侵蚀能力与生理活性研究[J].地学前缘,2012,19(6): 254-259.
[17]吴沿友.植物碳酸酐酶对稳定碳同位素分馏作用的影响[J].矿物岩石地球化学通报,2008,27(2):175-179.
[18]李 为,余龙江,袁道先,等.不同岩溶生态系统土壤及其细菌碳酸酐酶的活性分析及生态意义[J].生态学报,2004,24(3): 438-443.
[19]连 宾,袁道先,刘再华.岩溶生态系统中微生物对岩溶作用影响的认识[J].科学通报,2011,56(26):2158-2161.
[20]李 为,贾丽萍,余龙江,等.不同种类微生物及其碳酸酐酶对土壤-灰岩系统钙镁锌元素迁移作用的土柱模拟实验研究[J].土壤,2007,39(3):453-459.
[21]王 倩,支崇远.硅藻碳酸酐酶对石灰岩岩溶的作用及其生态意义[J].上海地质,2007,(4):25-27.
[22]梅子青,王海晶,王 丰,等.吉林省西部湿地天然水中的铁细菌[J].吉林大学学报,2002(1):91-93.
[23]Rahman M A,Oomori T,Uehara T.Carbonic anhydrase in calcified endoskeleton:novel activity in biocalcification in alcyonarian[J].Marine Biotechnology,2007,10(1):31-38.
[24]李 强.水生藻类碳酸酐酶(CA)对碳酸钙沉积速率控制的试验研究[D].南宁:广西师范大学,2004.
[25]李 为,刘丽萍,曹 龙,等.碳酸盐生物沉积作用的研究现状与展望[J].地球科学进展,2009,24(6):597-605.
[26]李 辉,连 宾,龚国洪,等.碳酸钙颗粒的细菌诱导形成[J].高校地质学报,2011,17(1):112-117.
[27]刘再华,Wolfgang D,王海静.一种由全球水循环产生的可能重要的CO2汇[J].科学通报,2007,52(20):2418-2422.
[28]李西腾,吴沿友,郝建朝.喀斯特地区碳酸配酶与环境的关系及意义[J].矿物岩石地球化学通报,2005,24(3):252-257.
[29]Lu Y K,Stem ler A J.Extrinsic photosystem IIcarbonic anhydrase in maizemesophyll chloroplasts[J].Plant Physiology,2002.128 (2):643-649.
[30]李 为,余龙江,余俊峰,等.岩溶环境因子对细菌胞外碳酸酐酶表达及活性的影响[J].微生物学通报,2005,32(5):35-39.
[31]仇明华,谢文林,刘凤萍,等.一种磺酰胺类碳酸酐酶II抑制剂3D-QSAR分析新方法[J].化学学报,2010,68(24):2581-2589.
[32]孙维琦,张继龙,郑清川,等.苯磺酰胺从碳酸酐酶II中脱离过程的分子动力学模拟[J].物理化学学报,2013,29(4):843-848.
[33]Savile C K,Lalonde JJ.Biotechnology for the acceleration of carbon dioxide capture and sequestration[J].CurrentOpinion in Biotechnology,2011,22(6):818-823.
[34]Ferry JG.Theγ-class of carbonic anhydrase[J].Biochim BiophysActa(BBA):Proteins Proteomics,2010,180(4):374-381.
[35]高伟芳.碳酸酐酶的固定化及其酶学性质研究[D].杭州:浙江工业大学,2010.
[36]周雪莹,杜叶,连 宾.不同培养条件对胶质芽孢杆菌诱导碳酸钙晶体形成的影响[J].微生物学报,2010,50(7):955-961.
M icrobial carbonic anhydraseaction and application on carbon cycling in Karst dynam ic system:a review
WUYan-wen,ZHANG Jin-chi
(Jiangsu Key Laboratory of SoilandWater Conservation and EcologicalRestoration,College of Forestry, Nanjing Forestry University,Nanjing 210037,China)
The karstdynam ics system is an open system w ith three unbalanced phases,which is dom inated by biosphere inmaterial circulation and energy flow,meanwhile,the circle between CO2,H2O and CaCO3play an significante role in promoting the global carbon cycle.Carbonic anhydrase is one kind of metal zinc enzymes,which exists w idely in m icroorganisms.This enzyme has driving effecton the carbon cycle in karst dynam ic system via catalytic hydration reaction of CO2.In this paper,we reviewed in the research of the structure and function ofm icrobial carbonic anhydrase,system elaborated the important role of the enzyme on driving the carbon cycle in karstdynam ic system,and combined w ith the developmentand application of relevantachievements in chem ical industry,thus come up w ith the new thought of its future application which combined with the destroyed mountain recovery technique research.
microbial carbonic anhydras;karstdynamicssystem;carbon cycle;destroyedmountain recovery
Q939.96;P967
A
2095-1736(2015)03-0078-06
10.3969/j.issn.2095-1736.2015.03.078
2014-09-30;
2014-10-27
国家林业局948项目“破坏山体植被恢复长期维持技术引进”(2008-4-40)
吴雁雯,主要从事水土保持和荒漠化防治,E-mail:wywhsl@sina.com;
张金池,教授,博导,从事研究方向为水土保持与林业生态工程,E-mail:zhang8811@njfu.edu.cn。
