南海长棘海星共附生真菌的分离鉴定及多样性分析*
2015-06-07梁婉玲谢中梁蓝文健李厚金杨得坡王来友
刘 威,梁婉玲,谢中梁,蓝文健,3,李厚金,杨得坡,3,王来友,5
(1.广东药学院中医药研究院,广东广州510006;2.中山大学药学院,广东广州510006;3.广东省现代中药工程技术研究开发中心,广东广州510006;4.中山大学化学与化学工程学院,广东广州510275;5.广东省中医药防治代谢性疾病重点实验室,广东广州510006)
长棘海星 (Acanthaster planci)属于棘皮动物,状似葵花,浑身长满毒刺,是热带和亚热带海域珊瑚礁的主要破坏者,严重威胁海洋生态安全与生物多样性。目前,国内外对长棘海星的研究大多集中于长棘海星的生态及活性成分的研究。1990年,Shiomi K等[1]的研究表明长棘海星体内的多种毒素能阻断哺乳动物神经肌肉的传递引起肝的严重退化;1994年,Shiroma N等[2]发现长棘海星分泌的毒素能能引起海葵等海洋生物的逃避反应;1998年,Toshiaki T等[3]研究发现花生四烯酸和α-亚麻酸对长棘海星有诱捕作用;2009年,李厚金等[4]的研究证实花生四烯酸是长棘海星体内主要的必需不饱和脂肪酸,而且体内无法合成,需要不断捕食富含花生四烯酸的珊瑚。近年来,人们发现共附生真菌与宿主在遗传、生理、代谢等方面相互渗透进化,形成互利共生关系。长棘海星体内有丰富的微生物为其提供有效的化学防御,不仅是一个潜在的微生物多样性宝库,更是天然药物的一个非常重要的来源途径。本实验室多年来先后从中国三亚的长棘海星样品中分离获得一批能够产生新颖结构的活性真菌菌株,并从中分离得到多个新骨架类型和有显著活性的化合物。如2012年,LAN W J等[5]从Trichoderma sp.培养液提取物中分离得到2个新的sorbicillinoid类似物对多种肿瘤细胞系有较强的毒性。2013年,Zhao Y等[6]从Ceriporia lacerate的GPY培养发酵液中分离得到3个新的羊毛甾烷型三萜化合物。因此,开展长棘海星共附生真菌的相关研究具有非常重要的生态意义与海洋药物资源开发利用的价值。
本文采用平板涂布法从采自三亚珊瑚礁保护区的长棘海星样品中分离得到近200株真菌,采用ITS-rDNA分子系统鉴定方法确定了16株具有代表性的真菌种属,通过统计学方法研究了长棘海星共附生真菌的种群多样性,为下一步深入研究长棘海星共生真菌的次生代谢情况奠定基础。
1 实验部分
1.1 材料
1.1.1 样品 采自中国三亚珊瑚礁保护区的长棘海星活性样本。水下采样,将采得的样本装入盛有海水的塑料桶,于冰盒保存。48 h内送至实验室于4℃保存。
1.1.2 试剂与仪器 Bioflux真菌基因组提取试剂盒(Fungal DNA Kit 50 T),日本Bioflux公司;溶菌酶、蛋白酶K、dNTPs、DNA相对分子质量标准,加拿大 MBI公司;Taq酶,日本 TaKaRa公司;
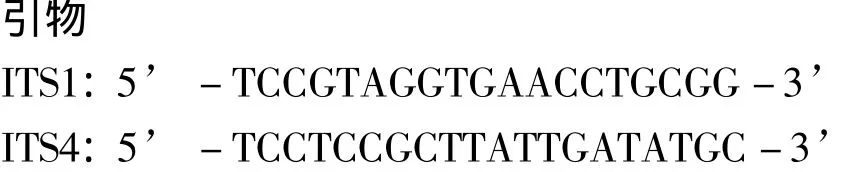
1.1.3 培养基 PDA培养基:马铃薯200 g(煮沸0.5 h,取滤液),葡萄糖20 g,琼脂20 g,人工海水1 L,pH 7.0~7.4。
马丁氏培养基:葡萄糖10 g,蛋白胨5 g,K2HPO41 g,MgSO4·7H2O 0.5 g,孟加拉红 33 mg,琼脂20 g,人工海水1 L,pH 7.0~7.4。
察氏培养基:蔗糖 30g,K2HPO41g,Mg SO4·7H2O 1.5 g,NaNO33 g,KCl 0.5g,FeSO40.01 g,琼脂20 g,人工海水1 L,pH 7.0~7.4。
以上培养基均在121℃下灭菌30 min,用前加入氯霉素200 mg/L。
1.2 方法
1.2.1 样品处理 长棘海星活体依次用无菌海水快速清洗数次,φ=75%乙醇浸泡30 s,无菌海水漂洗3次,无菌滤纸吸干。然后将长棘海星不同部位磨碎,取10 g碎片于装有90 mL无菌海水的匀浆器中,反复震荡,静置取上清液备用。
1.2.2 共附生真菌的分离纯化及保存 取200 μL备用上清液用无菌海水进行梯度稀释10-5、10-6、10-7、10-8。用灭菌涂布棒均匀涂布到相应的分离培养基平板上,与25℃倒置培养至肉眼能观察到真菌菌落,如此反复纯化3次。
纯化的菌株转接到新鲜PDA琼脂平板上培养,待菌落长满约斜面一半时,置于4℃保存。
1.2.3 纯化真菌DNA的提取与ITS-rDNA扩增及序列分析 取少量新鲜菌体,按照日本Bioflux公司的真菌DNA提取试剂盒的方法进行真菌基因组DNA的提取。以获得的DNA为模板,采用真菌通用引物ITS1和ITS4对真菌的核糖体转录间隔区ITS进行PCR扩增。
PCR反应体系 (50 μL):模板DNA 2 μL;10× PCR 缓冲液 5 μL,dNTPs 5 μL,上下游引物(10 pmol/μL)各1.8 μL,Taq 聚合酶 2 μL,无菌超纯水32.4 μL。PCR扩增条件:95℃预变性5 min;95℃变性1 min,55℃复性1 min,72℃延伸1 min,35个循环后,72℃延伸补齐10 min,最后冷却至16℃。获得的产物经1%的琼脂糖凝胶电泳检测后送至广州华大基因公司测序。
构建系统发育树:测序结果提交到GenBank数据库并获得登录号,应用Blast对所测系列进行系列相似性比对,获得相关种属的ITS系列,使用ClustalX软件进行多序列比对,使用MEGA6软件的N-J法构建系统发育树的,进化距离的计算按照Kimura2-parameter方法进行,可靠性通过1000次Bootstrap计算得出。
1.2.4 种群多样性分析 以同源性大于97%的菌种定义为同一分类单元,以Shannon-wiener指数(H)和Pielou均匀度指数(E)作为计算多样性的标准。
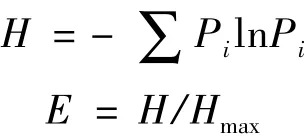
其中,Pi=Ni/N,H为实际求得的物种多样性指数,Pi是第i种的多度比例,Ni是每一个属中的菌株数,N是每个样品中菌株总数;Hmax为最大的物种多样性指数,Hmax=ln S,S为群落中的总物种数。
2 结果与讨论
2.1 长棘海星共附生真菌的分子鉴定
2.1.1 ITS序列分析 利用真菌通用引物ITS1和ITS4分别对16株长棘海星共附生真菌基因组DNA进行PCR扩增,获得长度500~600 bp的单一片段,扩增结果的电泳图 (见图1)。对PCR产物进行测序,获得的ITS序列提交GenBank数据库,登录号为KF999808-KF999822以及KJ723458。测序结果显示,所有菌种都有完整的核糖体内转录间隔区序列 (ITS1和ITS2)和5.8S,及部分18S rRNA和28S rRNA基因序列。用ClustalX软件对16株真菌的ITS序列进行比对分析,发现5.8S基因序列高度保守,而核糖体内转录间隔区序列 (ITS1和ITS2)则具有显著的多态性。ITS序列长度范围在440~530 bp,(G+C)%含量在51% ~61%之间,差异较大 (见表1)。其中F46-1的 (G+C)%含量约52%,与F1-2、F2-3、F16-1等8个菌株的 (G+C)%含量较为相似,但序列长度525 bp,明显大于后者,表明了F46-1与其他菌株是不同。F1-1与F4-1A的 (G+C)%含量约56%,可能是一类;而F7-1C、F7-1B和F27-1的 (G+C)%含量高达58%以上,明显与其他菌株不同。
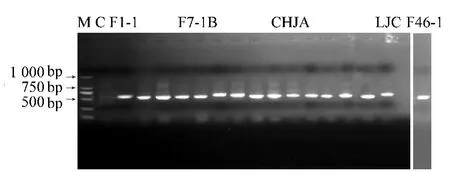
图1 长棘海星16株共附生真菌的ITS扩增产物电泳图Fig.1 Electrophoretogram of ITS amplified products of isolates from Acanthaster planci泳道编号为菌株编号,M代表Marker,C为空白对照

表1 长棘海星共附生真菌ITS片段序列 (G+C)%含量Table 1 The(G+C)%content of ITS fragments from the fungi associated with Acanthaster planci
2.1.2 16株长棘海星共附生真菌的系统学分析将获得的16株真菌的ITS序列通过Blast与数据库已有序列进行比对,均能获得相似度大于99%的匹配序列 (见表2)。
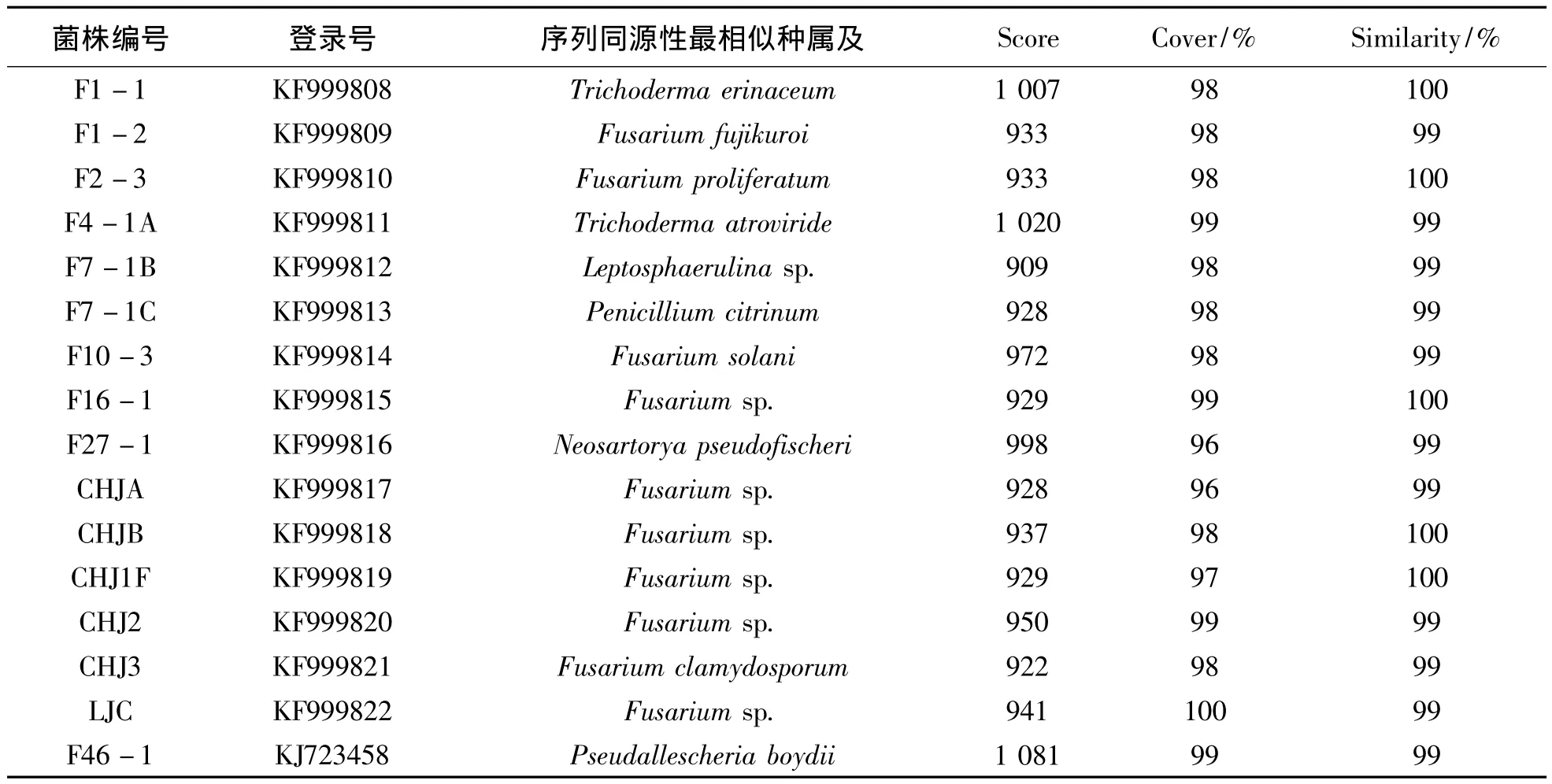
表2 长棘海星16株共附生真菌ITS序列及其最相似菌序列信息Table 2 Phylogenetic information of ITS of 16 isolates from Acanthaster planci
选取同源性较高的模式菌序列用ClustalX软件进行多序列比对,运用MEGA6以邻接法聚类构建系统发育树,外群取Mucor racemosus f.sphaerosporus(AJ878775)(见图2)。
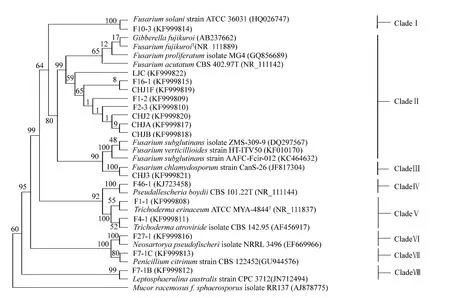
图2 基于N-J邻接法构建的16株长棘海星共附生真菌ITS系统发育树,重复1000次Fig.2 Phylogeny illustrating species relationships inferred from neighbor-joining analysis of the ITS gene.Each number indicates the percentage of bootstrap samplings,derived from 1000 samples,supporting the internal branches of 50%or higher.
图2所示是16株长棘海星共附生真菌的系统发育树,分支上为Bootstrap重复1000次大于50%的支持率。结果可以看出,16株真菌可以归为8类。F7-1B、F7-1C、F27-1、F46-1、CHJ3、F10-3分别与 Leptosphaerulina sp.、Neosartorya pseudofischeri、Penicillium citrinum、Pseudallescheria boydii、Fusarium clamydosporum、Fusarium solani的支持率都达到80%以上 (其中F27-1、F46-1、CHJ3、F10-3的支持率更是达到了100%),且分别自成一类,进而确定其种属。而F4-1A和F1-1聚为一类,与AF456917和NR_111837的支持率分别为52%和55%(均>50%),初步认为这两株菌分别是Trichoderma atroviride和Trichoderma erinaceum。剩下的8株真菌从进化树上看,亲缘关系非常接近,与Fusarium fujikuroi species complex聚成一个大类,但无法与已知菌株得到有力的支持,只能鉴定为Fusarium属而无法鉴定到种,需要借助其他方法进一步确定。这表明ITS序列对Fusarium fujikuroi species complex不能进行很好的区分。
相似列来源于GenBank,CBS:荷兰真菌菌种保藏中心;NRRL:美国农业部北方利用研究开发部;T:典型菌株。

2.2 长棘海星共附生真菌的种群多样性分析
根据ITS序列及系统学分析结果,可知长棘海星共附生真菌主要集中在 Ascomycota门的4目(Hypocreales、 Eurotiales、 Pleosporales、 Microascales),5属 (Trichoderma、Penicillium、Neosartorya、Leptosphaerulina、Pseudallescheria),以及Deuteromycota门的 1目 (Meliolales),1属 (Fusarium,有性型为Gibberella)。其中,Fusarium是长棘海星共附生真菌的优势种群 (10株),属于Fusarium fujikuroi species complex。
长棘海星共附生真菌多样性指数为1.247,均匀度指数为0.450,由此可见,长棘海星样品上菌株种类较少,而且菌体的个体数在镰刀属上表现为高度富集,均匀度比较低。
3 结论
基于ITS-rDNA的多态性的序列分析可获得相对足够的信息进行生物亲缘关系的研究,广泛应用于真菌的属种间及部分种内水平的系统学研究[7-9]。但对于ITS区差异小的菌株如某属种的复合体,ITS就不适合属内种的鉴定,此时必须结合形态学和生理生化特征,或进行多态位点基因序列的分析。
本文从南海三亚珊瑚礁保护区的长棘海星样品中分离纯化得到近200株共附生真菌,并对16株进行鉴定,但所选的ITS-rDNA片段不能很好区分其中的8株镰刀属,它们均属于复合种Fusarium fujikuroi species complex(GFC)。GFC是由至少10个不同的交配群组成,种内形态特征非常相似,采用传统的形态学分类方法难以区分[10]。Ma等[11]发现利用 TEF-1基因片段可将 F.fujikuroi、F.veticillioides和 F.proliferatum很好地区分开来,而且重复性好。因此,TEF-1基因可用于GFC复合种内的分子生物学鉴定[12]。
基于ITS序列分析的海洋生物共附生真菌的分子鉴定方法表明长棘海星是微生物群落多样性丰富的宿主。对长棘海星进行深入的共附生真菌研究,尤其是天然产物分子多样性的研究具有潜在而重要的药物开发价值和生态意义。
[1]SHIOMI K,YAMAMOTO S,YAMANAKA H,et al.Liver damage by the crown-of-thorns starfish(Acanthaster planic)lethal factor[J].Toxicon,1990,28(5):469-475.
[2]SHIROMA N,NOGUCHI K,MATSUZAKI T,et al.Haemodynamic and haematologic effects of Acanthaster planci venom in dogs[J].Toxicon,1994,32(10):1217-1225.
[3]SUENAGA K.Bioorganic studies on marine natural products with bioactivity,such as antitumor activity and feeding attractance[J].Bull Chem Soc Jpn,2004,77:443-451.
[4]李厚金,李淑青,王丰,等.长棘海星的体内脂肪酸成分及其生物学意义分析[J].中山大学学报:自然科学版,2009,48(5):55-60.
[5]LAN W J,ZHAO Y,XIE Z L,et al.Novel Sorbicillin Analogues from the Marine Fungus Trichoderma sp.Associated with the Seastar Acanthasterplanci[J].Natural Product Communications,2012,7(10):1337-1340.
[6]ZHAO Y,LI S Q,LI H J,et al.Lanotane triterpenoids from the fungus Ceriporia lacerate assoicated with Acanthaster planci[J].Chemistry of Natural Compounds,2013,49(4):653-656.
[7]IWEN P C,HINRICHS S H,RUPP M E.Utilization of the internal transcribed spacer regions as molecular targets to detect and identify human fungal pathogens[J].Medical Mycology,2002,40(1):87-109.
[8]赵国柱,张天字,张猛.核糖体基因簇在真菌系统学研究中的意义[J].生命的化学,2002,22(1):13-15.
[9]CARMELA B,TERESA F E,AMPARO Q,et al.An analysis of inter-and intraspecific genetic variabilities in the Kluyveromyces marxianus group of yeast species for the reconsideration of the K.lactis taxon [J].Yeast,2002,19(3):257-268.
[10]HENG M H,SALLEH B,ZAKARIA L.Molecular identification of Fusarium species in Gibberella fujikuroi Species Complex from rice,sugarcane and maize from Peninsular Malaysia[J].International Journal of Molecular Sciences,2011,12(10):6722-6732.
[11]马晓伟,邢春杰,于金凤,等.水稻恶苗病菌 (Fusarium fujikuroi)β-微管蛋白基因克隆及与多菌灵抗药性关系[J].微生物学报,2012,52(5):581-587.
[12]GEISER D M,JIMENEZ-GASCO M D,KANG S C,et al.FUSARIUM-ID v.1.0:a DNA sequence database for identifying Fusarium [J].European Journal of Plant Pathology,2004,110(5):473-479.
