线性探针技术和传统基因检测技术在耐药结核病诊断中的可靠性和及时性对比
2015-06-05韩珍林日文骆妙卡
韩珍,林日文,骆妙卡
(惠州市结核病防治研究所,广东 惠州516008)
结核病(Tuberculosis,TB)是可造成人类死亡的常见感染性疾病,是全球公共卫生面临的重大威胁[1]。近年来耐药结核病的发病率不断上升,耐药结核病是结核病控制的难题。TB的早期特异性诊断和及时治疗、及时切断传播链并保护易感人群对结核病的治疗和预防具有重要意义[2]。细菌学早期诊断是结核病防治的关键,抗酸染色、罗氏固体培养等传统TB诊断技术操作简单、经济、方便,易于推广,但也存在耗时长、敏感度和特异性差、难以标准化等不足,无法满足临床需求[3,4]。随着医疗技术的发展,分子线性探针杂交技术检测结核病的临床应用得以推广[5]。然而目前国内外关于分子线性探针技术和传统基因检测技术在耐药结核病诊断中的可靠性和及时性分析比较少。本研究比较MTBDR plus技术和传统基因检测技术诊断耐药TB的结果。准确性、敏感度、特异度、Kappa值及出报告所需时间,为耐药TB的早期诊断方法的选择提供依据,现将结果报道如下。
1 资料与方法
1.1 研究对象 连续纳入2014年1月至10月期间我院收治的246例涂阳肺结核患者作为研究对象。246例患者中男127例,女119例,年龄19~79岁,平均年龄(42.52±8.78)岁,患者均无其他呼吸系统疾病或严重心肺肝肾功能障碍。
1.2 检测方法
1.2.1 痰标本的收集 每例例涂阳肺结核患者均留取连续3d共3份痰标本,将获取标本置于4℃冰箱中保存并于留取标本3d内完成耐药情况的诊断。痰标本的分离和培养均严格按照中国防痨协会《结核病诊断实验室检验规程》的要求进行。
1.2.2 传统药敏实验 对分离出的菌株进行结核分枝杆菌菌种进行鉴定并进行异烟肼和利福平药敏实验,菌株鉴定采用对硝基苯甲酸和噻吩-2-羧酸肼鉴别培养基进行生长实验。药敏实验参照WHO/IUATLD标准,菌株培养采用中和离心法,使用接种环取一环培养基上的菌落制成1mg/ml的悬液并梯度稀释为10-2和10-4mg/ml,分别接种于含40μg/ml利福平和0.2μg/ml异烟肼的罗氏固体培养集中。将标本置于37℃恒温箱中培养,培养时间为6周。培养完成后读取菌落数并计算耐药百分比,耐药百分比低于1%为敏感,耐药百分比高于1%为耐药,同时出现异烟肼和利福平耐药为耐多药。实验操作均严格按照中国防痨协会 《结核病诊断实验室检验规程》要求进行,所用培养基均由Basco公司提供。
1.2.3 MTBDR plus线性探针技术检测 每例患者均取1份阳性级别最高的痰标本进行检测,检测试剂盒为德国Hain Life Sciences公司的GenotypeRMTBDR plus试剂盒,具体操作步骤如下:将标本进行消化后制成重悬液,将500μl重悬液加入离心管内5000r/min离心10min后去掉上清液并加入100μl的裂解缓冲液,将重悬液进行涡旋震荡后于95℃水中水浴5min,5000r/min离心 1min后去掉上清液再次加入100μl的裂解缓冲液,将重悬液进行涡旋震荡5s,再次5000r/min离心5min。取上清液5μl加入预先配置好的PCR扩增体系中,扩增循环为95℃扩增15min、95℃扩增30min、56℃扩增 3min,共 10个循环;然后 95℃扩增 25s、53℃扩增 40s、70℃扩增 40s,共20个循环;最后 70℃扩增8min。扩增完成后将产物与探针试纸条进行杂交,根据显色结果进行耐药性的判读。
1.2.4 传统核酸扩增技术检测 检测方法参照参考文献[6],将痰标本进行去污处理,取0.5μl痰标本提取DNA模版进行扩增加后进行耐药性分析。
1.3 线性杂交技术结果判读 试纸条共27个反应条带和4各区域,第1区为对照质控带,其他区为耐药相关基因探针区,其中第2区是利福平耐药相关rpoB基因探针区,第3、4区分别为与异烟肼耐药相关的KatG、inhA基因探针区,野生条带均显色而突变条带无显色时为敏感,野生条带缺失和突变条带显色或不显色均为耐药。
1.4 统计学方法 采用SPSS19.0软件进行统计学数据处理,计数资料比较采用卡方检验,计量资料以均数±标准差表示,采用t检验,采用敏感度和特异度对检测结果的真实性进行评价,采用准确性对检测方法的应用价值进行评价,采用Kappa值分析MTBDR plus技术、核酸扩增检测技术与传统药敏实验方法检测结果的一致性,以P<0.05为差异有统计学意义。
2 结果
2.1 MTBDR plus技术、核酸扩增检测技术检测结果比较 MTBDR plus技术与传统药敏实验检测所得利福平耐药结核病发生率、异烟肼耐药结核病发生率和耐多药结核病发生率比较差异均无统计学意义(P>0.05)。核酸扩增检测技术检测所得利福平耐药结核病发生率、异烟肼耐药结核病发生率和耐多药结核病发生率则均低于传统药敏实验检测所得结果,差异有统计学意义(P<0.05),见表1。

表1 MTBDR plus技术、核酸扩增检测技术检测结果比较[n(%)]
2.2 MTBDR plus技术、核酸扩增检测技术诊断耐药结核病的准确性比较 与核酸扩增检测技术比较,MTBDR plus技术检测利福平耐药、异烟肼耐药和耐多药的敏感度、Kappa值均较高,差异有统计学意义(P<0.05),见表2、表3和表4。
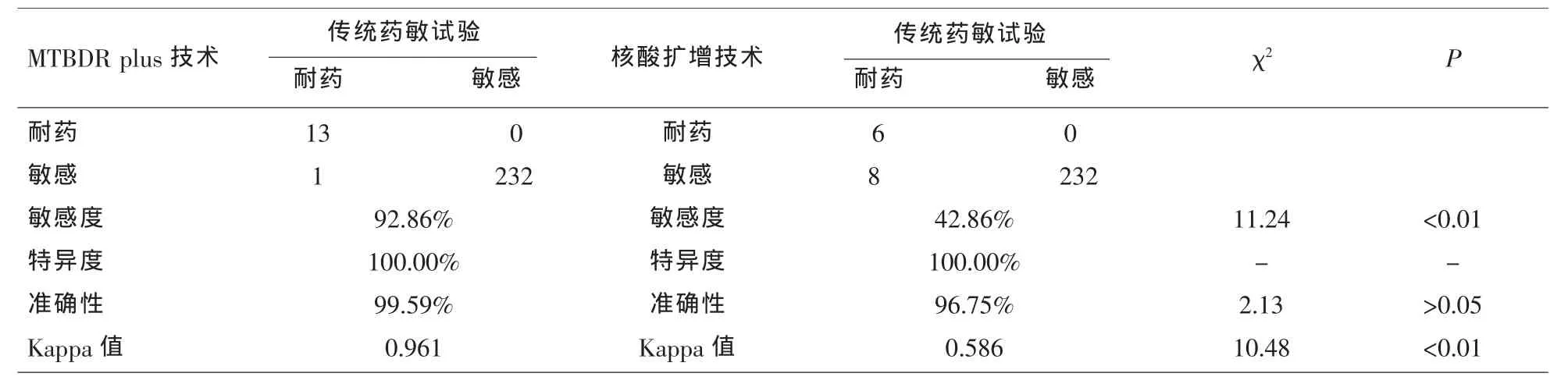
表2 MTBDR plus技术、核酸扩增检测技术诊断利福平耐药的准确性比较

表3 MTBDR plus技术、核酸扩增检测技术诊断异烟肼耐药的准确性比较

表4 MTBDR plus技术、核酸扩增检测技术诊断耐多药的准确性比较
2.3 MTBDR plus技术、核酸扩增检测技术出报告时间比较 MTBDR plus技术出报告时间0.5~2d,平均出报告时间为(1.26±0.58)d,核酸扩增出报告时间 4~15d,平均出报告时间为(8.89±1.08)d,MTBDR plus技术出报告时间显著短于核酸扩增检测技术出报告时间,差异有统计学意义 (t=13.82,P<0.01)。
3 讨论
近年来我国耐药结核病的发病率不断上升,作为全球27个耐药结核病高发国家之一,我国初诊结核病患者中约5%的患者为耐药结核病患者,而复发结核病患者中约1/4的患者为耐药结核病患者[7,8]。目前地市级医院由于实验室诊断能力落后,结核耐药诊断报告往往需数月时间,耐药诊断结果的滞后性可明显影响治疗效果,耐药结核患者无法得到及时有效的治疗且耐药结核病的传播无法得以控制[9,10]。传统耐药检测耗时长且灵敏性和特异性均较低,无法满足耐药结核病早期准确诊断的需求[11]。线性探针技术可通过对耐药相关基因的PCR扩增和反向杂交确定结核分枝杆菌对利福平和异烟肼的耐药性,报告可于24h内获得,具有快速准确的特点[12,13]。国外研究表明,线性探针技术用于涂阳痰标本检测的敏感度和特异度均较高[14]。2008年世界卫生组织亦推荐线性探针技术可应用于低收入国家耐药结核病的诊断[15]。然而目前国内关于线性探针技术诊断结合耐药性的可靠性和及时性的研究报道甚少。明确线性探针杂交技术和传统基因检测技术检测耐药结核病的准确度和所需时间可为耐药结核病的早期诊断和疾病的控制提供指导。
本研究结果显示,分子线性探针杂交技术检测所得利福平耐药结核病、异烟肼耐药结核病及耐多药结核病的发病率与传统药敏检测结果相近,而传统基因检测技术检测所得分子利福平耐药结核病、异烟肼耐药结核病及耐多药结核病的发病率低于分子线性探针杂交技术和传统药敏实验检测结果。传统基因检测诊断利福平耐药结核病、异烟肼耐药结核病及耐多药结核病的特异性和准确性均较高,说明传统基因检测在耐药结核病的诊断中具有一定价值,然而其敏感度和Kappa值均较低,传统基因检测在耐药结核病检测中的准确性有待提高。而分子线性探针杂交技术检测诊断耐药结核病的敏感度、特异性、准确性及Kappa值均较高,分子线性探针杂交技术检测诊断耐药结核病具有较好的可靠性。分子线性探针杂交技术检测诊断耐药结核病出报告的时间短,可于2d内给出耐药结核病诊断报告,而传统基因检测耗时长,出报告时间需约10d,分子线性探针杂交技术检测诊断耐药结核病具有较高的及时性。线性探针杂交技术可通过异烟肼和利福平等耐药相关基因的检测来完成耐药结核分枝杆菌的检测,有助于耐药TB的早期诊断和及时治疗。由于实验室检测受操作人员水平、环境等多方面因素的影响,因此明确线性探针技术和传统基因检测技术在结核病诊断中的可靠性和及时性需进一步全面深入研究。
综上所述,分子线性探针技术较传统基因检测技术可更及时、准确地诊断耐药结核病,同时具有较高的可靠性,是耐药结核病诊断的有效方法。
[1]陆伟,周扬,陈诚,等.江苏省社区人群结核杆菌耐药状况及影响因素研究[J].中华疾病控制杂志,2013,17(7):560-563.
[2]何丽,雷英,吴芳,等.结核杆菌Pup-蛋白酶体系统与耐药结核杆菌耐药性的相关性研究 [J].中国免疫学杂志,2014,(11):1441-1447,1451.
[3]Ezati N,Lukoye D,Wampande EM,et al.The Mycobacterium tuberculosis Uganda II family and resistance to first-line anti-tuberculosis drugs in Uganda[J].BMC Infect Dis,2014,14(1):703.
[4]魏存乐,王岐,王志刚.223例结核分枝杆菌耐药分析[J].中国卫生检验杂志,2012,22(9):2222-2224.
[5]时金艳,李铁成,夏荣荣,等.线性探针技术用于快速筛查耐多药结核病的研究[J].实验与检验医学,2012,30(4):330-333.
[6]Gholoobi A,Masoudi-Kazemabad A,Meshkat M,et al.Comparison of Culture and PCR Methods for Diagnosis of Mycobacterium tuberculosis in Different Clinical Specimens[J].Jundishapur J Microbiol,2014,7(2):e8939.
[7]花春玲,孙晓穗,平静珍,等.结核分枝杆菌的耐药性研究[J].中国消毒学杂志,2013,30(7):626-627.
[8]李琦,张逸彪,雷敏,等.2008-2011年结核分枝杆菌的耐药性变迁[J].中华医院感染学杂志,2013,23(19):4841-4843.
[9]杜增兰,王岐,王峰,等.253株人型结核分枝杆菌耐药性分析[J].内科,2012,07(4):370-372.
[10]江渊,赵丽丽,桂晓虹,等.MGIT960系统快速检测结核分枝杆菌药物敏感性的应用评价[J].环境与职业医学,2013,30(3):202-204.
[11]孙炳奇,张娟,孙秀华,等.MGIT960法和绝对浓度法对耐多药结核杆菌药敏检测比对分析[J].广东医学,2014,(12):1877-1879.
[12]Imperiale BR,Di Giulio AB,Adrián Cataldi A,et al.Evaluation of Mycobacterium tuberculosis cross-resistance to isoniazid,rifampicin and levofloxacin with their respective structural analogs[J].J Antibiot(Tokyo),2014,67(11):749-754.
[13]梁建琴,李洪敏,高华方,等.应用PCR-荧光探针法快速检测耐多药结核分枝杆菌基因型 [J].中华医院感染学杂志,2013,23(21):5140-5142.
[14]Palomino JC,Vandamme P,Martin A.Classical and new assays for detecting drug resistance in tuberculosis[J].Biomark Med,2014,8(9):1105-1014.
[15]Ali IF,Babak F,Fazlollah MS,et al.Rapid detection of MDR-Mycobacterium tuberculosis using modified PCR-SSCP from clinical Specimens[J].Asian Pac J Trop Biomed,2014,4(Suppl 1):S165-170.
