α⁃硫辛酸对EAE大鼠的保护作用和机制探讨
2015-06-05徐晓臣赵冉冉徐飞路志民李建社檀国军
徐晓臣 赵冉冉 徐飞 路志民 李建社 檀国军
·论 著·
α⁃硫辛酸对EAE大鼠的保护作用和机制探讨
徐晓臣 赵冉冉 徐飞 路志民 李建社 檀国军
目的 研究α⁃硫辛酸(alpha⁃lipoic acid,ALA)在实验性变态反应性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)大鼠模型中对脊髓组织的保护作用并探讨其机制。 方法 Wistar大鼠随机分为对照组(NC组)、EAE组(EAE组)和α⁃硫辛酸组(ALA组)。对照组不接受任何处理,EAE组接受免疫注射,ALA组在EAE组基础上加用ALA治疗。采用Kono评分法进行大鼠神经功能评估,在实验60 d时取材,观察脊髓腰膨大段组织的病理学改变,以免疫组化方法标记白介素⁃17(IL⁃17),观察其表达变化,分光光度计检测脑组织中还原型谷胱甘肽(glutathione,GSH)、丙二醛(malondialdehyde,MDA)的含量。 结果 EAE组出现明显的神经功能障碍,ALA组大鼠神经功能明显改善(P<0.05);免疫细胞化学染色结果显示,EAE组大鼠脊髓腰膨大炎症标记物IL⁃17蛋白的表达比NC组明显增加(P<0.05);ALA治疗后IL⁃17蛋白的表达显著降低(P<0.05);与NC组相比,EAE组大鼠脑组织中GSH含量明显下降(P<0.05),MDA含量明显增加(P<0.05),ALA治疗后显著增加了GSH含量(P<0.05),降低了MDA含量(P<0.05)。 结论 ALA可能是通过抑制炎症反应和减轻氧化应激发挥了在EAE大鼠模型中的保护作用。
多发性硬化;α⁃硫辛酸;炎症;氧化应激
多发性硬化(multiple sclerosis,MS)及其动物模型实验性自身变态反应性脑脊髓炎(EAE)是以中枢神经系统的炎症及脱髓鞘改变为特征的疾病。近年来研究发现α⁃硫辛酸(alpha⁃lipoic acid,ALA)在EAE模型中具有保护作用[1],但其机制还不明确,国外研究发现ALA有抑制中枢神经系统T淋巴细胞和巨噬细胞增殖从而抑制自身免疫的作用[2]。本研究观察ALA在EAE大鼠中的保护作用及其对炎症和氧化应激的影响,探讨其机制,为临床EAE的诊治提供理论依据。
1 材料和方法
1.1 实验动物 清洁级健康雌性Wistar大鼠30只,6~8周龄,体质量180~200 g;清洁级雌雄不限豚鼠3只,体质量350~400 g,河北医科大学实验动物中心提供。
1.2 主要试剂和仪器 ALA(美国Sigma公司),佐剂用卡介苗(北京生物制品研究所),兔抗多克隆抗体IL⁃17(北京博奥森生物技术有限公司),丙二醛(MDA)试剂盒(碧云天生物技术有限公司),还原型谷胱甘肽(GSH)试剂盒(碧云天生物技术有限公司)。主要仪器:石蜡切片机(德国莱卡RM2015),光学显微镜(日本OLYMPUS BX51T⁃PHD⁃J11)。
1.3 动物模型的建立 将健康豚鼠3只用水合氯醛350 mg/kg麻醉后,迅速取脊髓全长,去除脊膜并称重,按脊髓质量与冰盐水体积1∶10制成豚鼠脊髓匀浆,再与等量含6 mg/ml卡介苗的完全福氏佐剂充分混合,冰上抽打制成油包水乳剂,为完全免疫抗原。按0.5 ml/只分别于大鼠四肢足垫及背部皮下注射抗原匀浆,建立EAE大鼠模型。
1.4 实验分组 将Wistar大鼠随机分为:正常对照组(NC组)不接受任何处理,EAE组注射免疫抗原,ALA组在EAE基础上接受ALA治疗,各组10只。ALA组自第1次发病起给予药物腹腔注射,按100 mg/(kg· d)连续注射60 d。
1.5 IL⁃17免疫组化、MDA和GSH检测 在免疫第60天时动物麻醉后,冰上迅速取脊髓腰膨大段组织和脑组织。每组取3只进行脊髓腰膨大段组织多聚甲醛固定,常规切片,行IL⁃17染色。另外每组7只脑组织液氮速冻后-80℃保存,用于检测MDA和GSH含量,实验步骤按照试剂盒说明书进行。
1.6 Kono评分方法 动物尾部无力为1分,尾部无力伴双前肢或双后肢无力为2分,双前肢或双后肢瘫痪为3分,四肢瘫痪被动翻身不能复原为4分,濒死状态或死亡为5分。
1.7 统计学处理 采用SPSS 13.0软件进行统计分析,计量资料用¯x±s表示。组间比较采用方差分析,2组之间比较采用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠发病和神经功能缺损情况 在抗原免疫后,大鼠出现精神萎靡、皮毛光泽下降、体质量减轻等变化,于免疫后第11天起陆续出现神经功能障碍,表现为尾部张力下降、尾部无力,逐渐出现四肢麻痹、大小便失禁等变化。20只免疫的大鼠中共有16只发病。
自免疫开始每天对大鼠的神经功能进行评分,共记录20 d,并对各组大鼠的平均每日神经功能评分进行比较。NC组大鼠平均每日神经功能缺损评分为0;EAE组为1.65±0.11,与NC组比较差异有统计学意义(P<0.01);ALA组为0.51±0.02,与EAE组相比,ALA显著缓解了EAE模型大鼠神经功能障碍(P<0.05)。
2.2 脊髓腰膨大组织IL⁃17表达的变化 各组脊髓腰膨大前角IL⁃17免疫染色的AOD值分别为:NC组0.23±0.01,EAE组0.48±0.02,ALA组0.33±0.01。3组大鼠脊髓前角IL⁃17蛋白的表达存在明显差异(P<0.05),见图1。EAE组IL⁃17蛋白表达比正常对照组增加108%,ALA治疗后IL⁃17蛋白的表达明显降低(P<0.05),表现为ALA组IL⁃17蛋白免疫反应强度的AOD值比EAE组降低32%(P<0.05)。
2.3 脑组织GSH和MDA含量的改变 与NC组相比,EAE组大鼠脑组织中GSH含量明显下降(P<0.05),MDA明显升高(P<0.05);ALA组与EAE组相比,GSH含量明显增加(P<0.05),MDA水平显著降低(P<0.05)。见表1。
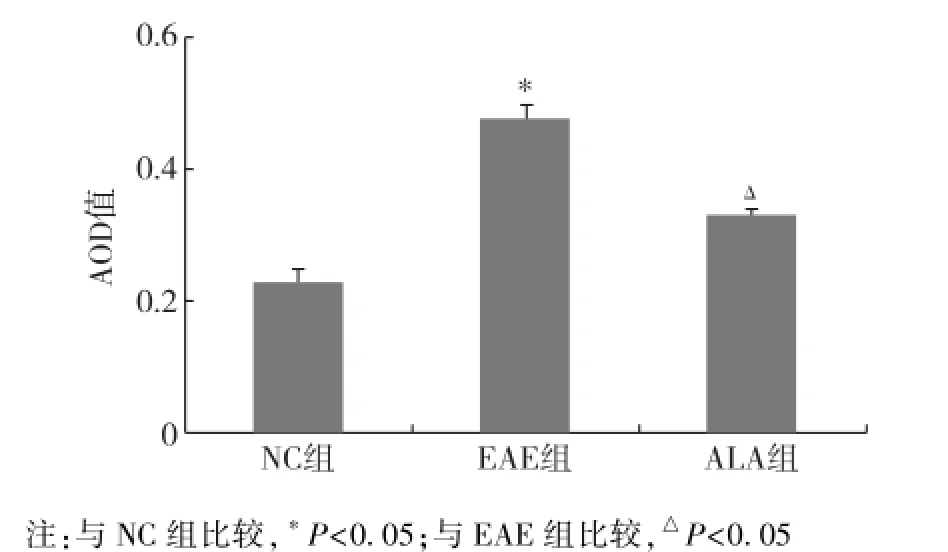
图1 各组大鼠脊髓IL⁃17 AOD值(n=3)

表1 ALA对脑组织中MDA和GSH含量的影响(¯x±s,n=7)
3 讨论
EAE模型很好地模拟了MS的病理过程,其神经功能评分、组织病理学、特异性T细胞增殖及其炎性细胞因子的反应等方面符合MS的发病[3],广泛应用于MS的实验研究。近年来研究发现氧化应激和炎症参与了MS的发展过程,抗氧化应激治疗有可能是治疗MS的有效策略。
ALA是一种强抗氧化剂,主要通过清除自由基和活性氧、螯合金属离子、再生其他内源性抗氧化剂而发挥其抗氧化作用[6],作为神经保护剂已被应用于神经系统多种疾病的防治[7]。ALA能够改善2型糖尿病患者周围神经病变[8],对局麻药物布比卡因引起的小鼠神经损害也有保护效应[9]。
本研究发现,EAE组大鼠出现明显的神经功能缺损,模型建立成功,免疫组化发现脊髓腰骶膨大处的前角细胞有IL⁃17蛋白表达明显升高,脑组织中MDA含量增高,GSH含量下降;ALA可改善神经功能,降低IL⁃17的表达,降低脂质过氧化物MDA含量,升高机体抗氧化物GSH的含量。表明在EAE大鼠模型中,ALA具有缓解EAE临床症状、抑制IL⁃17表达、减轻氧化应激的作用。
MS的发病有多种机制参与,目前尚无定论。目前认为IL⁃17在MS的发生发展中发挥了非常重要的作用,IL⁃17/IL⁃23轴是MS最重要的治疗靶点。IL⁃17是一种前炎性细胞因子,在细胞增殖、分化、生物因子转录表达及免疫调节等方面发挥重要作用。研究表明,IL⁃17在MS患者外周血单核细胞表达数量高于健康对照组,且表达水平增高与疾病严重程度有关联[4],应用抑制IL⁃17活性的药物能够减轻EAE病情严重程度[5]。有研究报道,在溃疡性结肠炎小鼠模型中,ALA能够抑制IL⁃17的表达,减轻机体炎症反应[10]。结合本研究中ALA组大鼠临床症状改善、IL⁃17表达下降,ALA在EAE大鼠中有可能是通过下调IL⁃17、减轻炎症反应,从而发挥了神经保护作用。
近年来研究表明,MS发病过程不仅有炎症反应,氧化应激也参与了MS的发生发展。氧化应激是指机体氧自由基生成超过了机体处理氧自由基的能力,过多的氧自由基对蛋白质、脂质膜、DNA等结构造成损伤,造成细胞功能异常甚至死亡。研究认为MS的炎症环境将导致氧自由基的生成增加和氧化应激的生成,从而进一步促进了MS的进展和恶化[11]。炎症可以导致氧化应激,氧化应激反过来也可以促进炎症,二者形成了恶性循环。作为强效抗氧化剂,ALA对EAE大鼠的保护作用,也有可能是通过减轻氧化应激,继而减轻炎症反应来实现的。
综上所述,ALA有可能通过减轻氧化应激和炎症反应发挥了对EAE大鼠的神经保护作用,本研究为阐明MS的发病机制和临床治疗提供了实验依据。
[1] Marracci GH,Jones RE,McKeon GP,et al.Alpha lipoic acid inhibits T cell migration into the spinal cord and suppres⁃ses and treats experimental autoimmune encephalomyelitis[J].J Neuroimmunol,2002,131(1/2):104⁃114.
[2] Chaudhary P,Marracci GH,Bourdette DN.Lipoic acid in⁃hibitsexpressionofICAM⁃1andVCAM⁃1byCNS endothelial cells and T cell migration into the spinal cord in experimental autoimmune encephalomyelitis[J].J Neuroim⁃munol,2006,175(1/2):87⁃96.
[3] 李波,刘瑞春,檀国军,等.小剂量豚鼠脊髓匀浆诱导Wistar大鼠实验性自身免疫性脑脊髓炎模型的建立[J].脑与神经疾病杂志,2009,17(5):367⁃369.
[4] Matusevicius D,Kivisakk P,He B,et al.Interleukin⁃17 mRNA expression in blood and CSF mononuclear cells is augmented in multiple sclerosis[J].Mult Scler,1999,5(2):101⁃104.
[5] Hofstertter HH,Ibrahim SM,Koczan D,et al.Therapeutic efficacy of IL⁃17 neutralization in murine experimental auto⁃immune encephalomyelitis[J].Cell Immunol,2005,237(2):123⁃130.
[6] Smith AR,Shenvi SV,Widlansky M,et al.Lipoic acid as a potentialtherapyforchronicdiseasesassociatedwith oxidative stress[J].Curr Med Chem,2004,11(9):1135⁃1146.
[7] Jones RE,Moes N,Zwickey H,et al.Treatment of experi⁃mental auto⁃immune encephalomyelitis with alpha lipoic acid and associative conditioning[J].Brain Behav Immun,2008,22(4):538⁃543.
[8] 谷雪静,王燕,樊海英.α⁃硫辛酸治疗2型糖尿病周围神经病变22例疗效观察[J].实用老年医学,2012,26(1):47⁃49.
[9] 王晓辉,姚玉珍,丁正年,等.α⁃硫辛酸对布比卡因所致小鼠神经细胞损伤的保护作用[J].实用老年医学,2010,24(2):118⁃121.
[10]Trivedi PP,Jena GB.Role of α⁃lipoic acid in dextran sulfate sodium⁃induced ulcerative colitis in mice:studies on inflam⁃mation,oxidative stress,DNA damage and fibrosis[J]. Food Chem Toxicol,2013,59:339⁃355.
[11]Ortiz GG,Pacheco⁃Moisés FP,Bitzer⁃Quintero OK,et al. Immunology and oxidative stress inmultiplesclerosis:clinical and basic approach[J].Clin Dev Immunol,2013,2013:708659.
Effect of alpha⁃lipoic acid on experimental allergic encephalomyelitis rats and related mechanisms
XU Xiao⁃chen,LI Jian⁃she.Department of Neurology;XU Fei,LU Zhi⁃min.
Department of Urology,the First Hospital of Handan,Handan 056002,China;ZHAO Ran⁃ran,TAN Guo⁃jun.Department of Neurology,the Second Hospital of Hebei Medical University,Shijiazhuang 050071,China
Objective To explore the effects of alpha⁃lipoic acid(ALA)on experimental allergic encephalomy⁃elitis(EAE)and the possible mechanisms. Methods Female Wistar rats were randomly divided into three groups:normal control group(NC group),EAE model group(EAE group),and the ALA administrated EAE model group(ALA group).Kono scale was used to evaluate neurofunction deficiency.Immunohistochemistry was used to detect the expression of IL⁃17 in the spinal cord on the 60th day of the disease course.Spectrophotometry was used to detect the levels of malondialdehyde(MDA)and glutathione(GSH)in the brain. Results In EAE group,the score of Kono scale was significantly higher(P<0.05),the expression of IL⁃17 significantly increased,MDA significantly increased(P<0.05),and GSH significantly decreased(P<0.05).However,ALA could effectively improve neurofunction(P<0.05),decrease the expression of IL⁃17(P<0.05),decrease the level of MDA(P<0.05),and increase the level of GSH(P<0.05). Conclusions ALA may exert its neuroprotective effect through ameliorating inflammative reacts and oxidative stress.
mutiple sclerosis;alpha⁃lipoic acid;inflammation;oxidative stress
R 593.2
A
10.3969/j.issn.1003⁃9198.2015.03.006
2014⁃08⁃11)
河北省科技厅课题(11276425);河北省重点科技计划(20090371)
056002河北省邯郸市,邯郸市第一医院神经内科(徐晓臣,李建社),泌尿科(徐飞,路志民);050071河北省石家庄市,河北医科大学第二医院神经内科(赵冉冉,檀国军)
檀国军,Email:ecg001@sohu.com
