红松松球鳞片多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用
2015-06-05包怡红王振宇
李 波,包怡红,高 锋,王振宇
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.黑龙江省农业科学院科研处,黑龙江哈尔滨 150086;3. 黑龙江省农业科学院,黑龙江哈尔滨 150086)
红松松球鳞片多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用
李 波1,2,包怡红1,*,高 锋3,王振宇1
(1.东北林业大学林学院,黑龙江哈尔滨 150040;2.黑龙江省农业科学院科研处,黑龙江哈尔滨 150086;3. 黑龙江省农业科学院,黑龙江哈尔滨 150086)
本文研究了红松松球鳞片多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用,并采用Lineweaver-Burk双倒数法分析了其动力学性质。结果表明,红松松球鳞片多酚对α-葡萄糖苷酶的抑制作用略弱于阳性对照阿卡波糖,二者的半数抑制浓度分别为713.94μg/mL和623.73μg/mL;对α-淀粉酶的抑制作用明显不及阳性对照阿卡波糖,二者的半数抑制浓度分别为1902.91μg/mL和865.96μg/mL。动力学分析结果显示红松松球鳞片多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用均为非竞争性抑制类型。
红松松球鳞片,多酚,α-淀粉酶,α-葡萄糖苷酶,抑制
餐后高血糖的发生与α-淀粉酶和α-葡萄糖苷酶的活性密切相关,这两种酶的活性越强,水解淀粉和低聚糖的量也就越多,进而导致葡萄糖在小肠黏膜上吸收加快[1]。因此,抑制α-淀粉酶和α-葡萄糖苷酶的活性是控制餐后血糖升高的一个重要途径,也就是说,通过对这两种酶的抑制作用能够有效降低餐后高血糖的发生[2]。一直以来,植物多酚有益于人类健康的生物活性备受研究学者关注。目前已研究证实,植物多酚不仅能够减少氧化应激作用,而且能够通过抑制碳水化合物水解酶的作用来预防高血糖[3-4]。
我国红松资源丰富,但对其多酚类物质的研究还很少。本项研究前期实验表明,红松松球鳞片含有丰富的多酚类物质,而且该类多酚具有很好的抗氧化性。本实验通过研究红松松球鳞片多酚对α-淀粉酶和α-葡萄糖苷酶的抑制作用,并采用Lineweaver-Burk双倒数法研究其动力学性质,揭示红松松球鳞片多酚对α-淀粉酶和α-葡萄糖苷酶的抑制机理。
1 材料与方法
1.1 材料与仪器
红松松球鳞片 收集于2011年9月份,地点在黑龙江省伊春林区,自然晾干后粉碎过60目筛,其乙醇提取液经AB-8树脂柱层析纯化、Sephadex LH-20凝胶柱层析纯化后,减压浓缩,冷冻干燥得纯化的红松松球鳞片多酚(PP,Purified Polyphenol)粉末;猪胰α-淀粉酶(PPA)、α-葡萄糖苷酶、4-硝基苯基-α-D-吡喃葡萄糖苷(PNPG) 购自Sigma公司;其他试剂均为国产分析纯。
DK-8D型电热恒温水槽 上海一恒科学仪器有限公司;ELx800NB 酶标仪 美国BioTek公司;PHS-3C型数字酸度计 上海精密科学仪器有限公司;FA2004型电子天平 上海天平仪器厂。
1.2 实验方法
1.2.1 α-淀粉酶活性抑制实验 α-淀粉酶活性测定参照张永军等[5]的方法,略加修改。取20μL α-淀粉酶溶液,分别加入20μL不同浓度的多酚溶液,混合均匀后置于37℃水浴中预热,然后加入40μL预热到37℃的1%淀粉溶液,在该温度下反应3min后,立即加入80μL DNS显色溶液,沸水浴8min,冷至室温后,加800μL蒸馏水稀释,用酶标仪于540nm波长处测吸光值A2。另取20μL磷酸盐缓冲溶液代替多酚溶液,测得无抑制剂时酶反应体系的吸光值A1,计算出抑制率,并进行多元非线性拟合,利用回归方程求出半数抑制浓度。抑制率计算公式为:
抑制率(%)=[(A1-A2)/A1]×100
式(1)
式中:A1和A2分别代表无抑制剂和有抑制剂时的酶反应体系的吸光值。
1.2.2 α-葡萄糖苷酶活性抑制实验 α-葡萄糖苷酶活性测定参照Xu Hai-Wei等[6]的方法,并略加修改。分别取不同浓度的多酚溶液100μL,加入1U/mL的α-葡萄糖苷酶溶液50μL,37℃水浴10min后,加入已经预热到37℃、5mmol/L的底物PNPG溶液50μL,37℃水浴10min,立即加入1mol/L的Na2CO3溶液100μL,用酶标仪于405nm波长下测定吸光值A2,另取100μL磷酸盐缓冲溶液代替多酚溶液,测得无抑制剂时酶反应体系的吸光值A1,按照式(1)计算出抑制率,并进行多元非线性拟合,利用回归方程求出半数抑制浓度。
1.2.3 动力学分析 固定底物浓度,改变酶浓度,分别测定添加和不添加红松松球鳞片多酚时反应体系的吸光值,并计算酶反应速率,然后根据酶反应速率与酶浓度之间的变化关系作图,判断其抑制类型是否可逆。
固定酶浓度,改变底物浓度,分别测定添加和不添加红松松球鳞片多酚时反应体系的吸光值,并计算酶反应速率,按照Lineweaver-Burk作图法,以酶反应速率的倒数对底物浓度的倒数作图,求得米氏方程。根据方程确定米氏常数Km和最大反应速率Vmax,通过比较有无红松松球鳞片多酚存在时的Km和Vmax的变化来判断其可逆性抑制类型。
1.2.4 数据分析处理 所有实验均重复3次,取平均值。采用Excel软件进行作图分析。
2 结果与分析
2.1 红松松球鳞片多酚对α-淀粉酶抑制作用分析
2.1.1 半数抑制浓度的确定 图1所示的是红松松球鳞片多酚和阳性对照阿卡波糖对α-淀粉酶的抑制作用结果。由图可知,随着二者浓度的增加,其对α-淀粉酶的抑制作用也都在增强,呈现了良好的量效关系。但是在整个测试浓度范围内,阳性对照阿卡波糖对α-淀粉酶的抑制作用要显著优于红松松球鳞片多酚,通过比较二者的EC50值,我们也可以确认这一点,红松松球鳞片多酚的EC50值为1902.91μg/mL,而阿卡波糖的EC50值仅为865.96μg/mL。
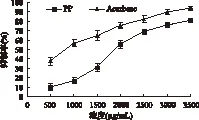
图1 不同浓度多酚对α-淀粉酶的抑制作用Fig.1 Inhibitory effect of polyphenol on α-amylase
2.1.2 抑制类型的确定 红松松球鳞片多酚对α-淀粉酶的抑制动力学曲线如图2所示。当反应体系中有可逆性抑制剂存在时,得到的直线通过原点,但斜率小于无抑制剂的直线斜率,当体系中存在不可逆抑制剂时,得到的直线不通过原点[7-8]。因此由图2可推断出,红松松球鳞片多酚对α-淀粉酶的抑制类型为可逆性抑制。
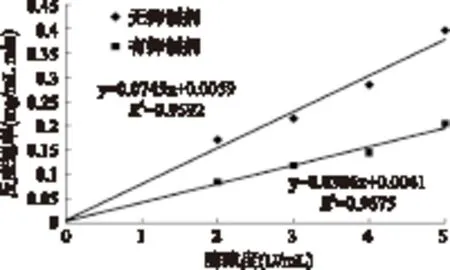
图2 多酚对α-淀粉酶的抑制动力学曲线Fig.2 Kinetics curves of inhibition of α-amylase
2.1.3 可逆性抑制类型的确定 可逆性抑制一般分为四种类型,即为竞争性抑制、非竞争性抑制、反竞争性抑制和混合性抑制。在确定抑制机理时,根据抑制作用的双倒数图,分别计算出无抑制剂和有抑制时反应体系的米氏常数Km和最大反应速率Vmax,通过比较二者的变化,即可推断出可逆性抑制类型[9]。
图3所示的是固定α-淀粉酶浓度,在不添加和添加红松松球鳞片多酚(2mg/mL)条件下,改变底物淀粉的浓度(0.5%~2%),得到的Lineweaver-Burk曲线。由图可以看出,两条直线相交于横轴。通过两条直线方程计算得出,有抑制存在时,米氏常数Km值17.42mg/mL,最大反应速度Vmax为0.5049mg/mL·min;无抑制剂存在时,米氏常数Km值16.49mg/mL,最大反应速度Vmax为1.045mg/mL·min。由此可知,和无抑制剂时相比,当红松松球鳞片多酚存在时,α-淀粉酶催化淀粉的酶促反应的最大反应速Vmax降低了,而米氏常数Km基本保持不变,因此推测红松松球鳞片多酚对α-淀粉酶属非竞争性抑制类型。

图3 多酚对α-淀粉酶的抑制作用的Lineweaver-Burk曲线Fig.3 Lineweaver-Burk plot for inhibition of polyphenol on α-amylase
2.2 红松松球鳞片多酚对α-葡萄糖苷酶抑制作用分析
2.2.1 半数抑制浓度的确定 通过测定不同浓度的红松松球鳞片多酚对α-葡萄糖苷酶的抑制率,并以阿卡波糖作为阳性对照,来确定多酚的抑制作用,其结果如图4所示。由图4可以看出,随着红松松球鳞片多酚浓度的增加,其对α-葡萄糖苷酶的抑制作用也在增强,呈现了良好的量效关系。浓度在1000~2000μg/mL范围内,红松松球鳞片多酚对α-葡萄糖苷酶的抑制作用同阿卡波糖相近,这也说明了红松松球鳞片多酚对α-葡萄糖苷酶有很好的抑制效果。但通过比较二者的EC50值,我们发现红松松球鳞片多酚(EC50,713.94μg/mL)对α-葡萄糖苷酶的抑制能力略弱于阳性对照阿卡波糖(EC50,623.73μg/mL)。
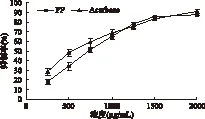
图4 不同浓度多酚对α-葡萄糖苷酶的抑制作用Fig.4 Inhibitory effect of polyphenol on α-glucosidase
2.2.2 抑制类型的确定 通过测定不同α-葡萄糖苷酶酶浓度在添加和不添加抑制剂(多酚浓度为750μg/mL)时的酶反应速率,得到多酚对α-葡萄糖苷酶的抑制动力学曲线,如图5所示。由图5可知,红松松球鳞片多酚对α-葡萄糖苷酶的抑制类型为可逆性抑制。

图5 多酚对α-葡萄糖苷酶的抑制动力学曲线Fig.5 Kinetics curves of inhibition of α-glucosidase
2.2.3 可逆性抑制类型的确定 固定α-葡萄糖苷酶浓度,在不添加和添加红松松球鳞片多酚(750μg/mL)条件下,改变底物PNPG的浓度(2~5mmol/L),测定反应体系的反应速率,得到α-葡萄糖苷酶在有无抑制剂存在时的Lineweaver-Burk曲线。根据图6中的两条直线方程可以计算出,有抑制存在时,米氏常数Km值5.867mmol/L,最大反应速度Vmax为0.138mmol/Lmin;无抑制剂存在时,米氏常数Km值5.929mmol/L,最大反应速度Vmax为0.241mmol/Lmin。由此可知,和无抑制剂时相比,当红松松球鳞片多酚存在时,α-葡萄糖苷酶催化PNPG的酶促反应的最大反应速Vmax降低了,而米氏常数Km基本保持不变,因此推测红松松球鳞片多酚对α-葡萄糖苷酶属非竞争性抑制类型。

图6 多酚对α-葡萄糖苷酶的 抑制作用的Lineweaver-Burk曲线Fig.6 Lineweaver-Burk plot for inhibition of polyphenol on α-glucosidase
3 结论与讨论
α-葡萄糖苷酶抑制剂,如已广泛应用于临床的阿卡波糖、伏格列波糖等对α-淀粉酶和α-葡萄糖苷酶都有很强的抑制作用,使淀粉类分解为葡萄糖的速度减慢,从而减缓肠道内葡萄糖的吸收,降低餐后高血糖。但是,这些抑制剂同时也具有一些副作用,像腹胀、腹痛、腹泻、胃肠痉挛性疼痛、顽固性便秘等。先前的一些研究表明,这些副作用是抑制剂对α-淀粉酶的过度抑制导致了结肠部位未被吸收的碳水化合物经细菌发酵产生的[10]。因此,更有效的抑制剂应当是在有效控制餐后高血糖的同时,能减少这些副作用,即这种抑制剂对α-葡萄糖苷酶有很强抑制作用,而对α-淀粉酶有较温和的抑制作用[11-12]。
体外实验研究表明,红松松球鳞片多酚可有效抑制α-葡萄糖苷酶的活性,其作用效果虽然略弱于阿卡波糖,但是其对α-淀粉酶的抑制作用比较温和,说明该多酚组分不仅能对淀粉酶促水解直至生成葡萄糖的整个过程产生抑制作用,从而可有效延缓单糖的释放和吸收,抑制餐后高血糖;而且还能避免或减缓对α-淀粉酶的过度抑制导致的一些副作用。抑制作用的动力学分析表明,红松松球鳞片多酚对α-淀粉酶和α-葡萄糖苷酶的抑制反应类型均为可逆的非竞争性抑制。
[1]Gray D M. Carbohydrate digestion and absorption-role of small intestine[J]. New England Journal of Medicine,1995,29:1225-1230.
[2]Krentz A J,Bailey C J. Oral antidiabetic agents:Current role in type 2 diabetes mellitus[J]. Drugs,2005,65:385-411.
[3]de Sousa,Zanatt,Seifriz I,Creczynski-Pasa T B,Pizzolatti M G,Szpoganicz,B. Hypoglycemic effect and antioxidant potential of kaempferol-3,7-O-a-dirhamnoside from Bauhinia forficata leaves[J]. J Nat Prod,2004,67:829-832.
[4]Hanamura T,Hagiwara T,Kawagishi H. Structural and functional characterization of polyphenols isolated from acerola(Malpighia emarginata DC.)fruit[J]. Biosci Biotechnol Biochem,2005,69:280-286.
[5]张永军,黄惠华. 茶多酚对胰α-淀粉酶的抑制动力学研究[J]. 食品工业,2010(1):7-9.
[6]Xu Hai-Wei,Dai Gui-Fu,Liu Gai-Zhi. Synthesis of andrographolide derivatives:A new family of a-glucosidase inhibitors[J]. Bioorganic & Medicinal Chemistry,2007,15:4247-4255.
[7]徐俊,鲍娇琳,沈伟哉,等. 穿心莲内酯衍生物炎琥宁对α-葡萄糖苷酶抑制活性及机制研究[J]. 时珍国医国药,2012,23(7):1637-1640.
[8]刘艳丰,黄惠华. 乌龙茶与普洱茶浸提液对胰α-淀粉酶的抑制作用[J]. 食品与发酵工业,2010,36(7):54-57.
[9]王镜岩,朱圣庚,徐长法,等. 生物化学[M]. 北京:高等教育出版社,2002:170-173.
[10]Yee H S,Fong N T. A review of the safety and efficacy of acarbose in diabetes mellitus[J]. Pharmacotherapy,1996,16:792-805.
[11]Kwon Y I,Vattem D V,Shetty K. Evaluation of clonal herbs of Lamiaceae species for management of diabetes and hypertension[J]. Asian Pacific Journal of Clinical Nutrition,2006,15:107-118.
[12]柴艳伟,张根义. 茶多酚对淀粉消化酶动力学的影响[J].食品工业科技,2013,34(10):81-88.
Inhibitory effect of polyphenols from Korean pine cone lamella on α-amylase and α-glucosidase
LI Bo1,2,BAO Yi-hong1,*,GAO Feng3,WANG Zhen-yu1
(1.College of Forestry,Northeast Forestry University,Harbin 150040,China;2.Department of Scientific Research Management,Heilongjiang Academy of Agricultural Sciences,Harbin 150086,China;3. Heilongjiang Academy of Agricultural Sciences,Harbin 150086,China)
Inhibition kinetics of α-amylase and α-glucosidase by polyphenols from Korean pine cone lamella was studied. The results suggested that inhibitory activity of polyphenols(EC50,713.94μg/mL)on α-glucosidase was slightly lower than that of the positive control acarbose(EC50,623.73μg/mL)and inhibitory effect of polyphenols(EC50,1902.91μg/mL)on α-amylase was significantly lower than that of acarbose(EC50,865.96μg/mL). A Lineweaver-Burk plot indicated that the inhibition of polyphenols from Korean pine cone lamella on α-amylase and α-glucosidase were both uncompetitive.
Korean pine cone lamella;polyphenols;α-amylase;α-glucosidase;inhibition
2014-03-20
李波(1980-),男,在读博士,副研究员,主要从事植物活性成分的分离与开发。
*通讯作者:包怡红(1970-),女,博士,教授,主要从事功能性食品开发研究。
国家自然科学基金(31170510)。
TS201.1
A
1002-0306(2015)01-0063-04
10.13386/j.issn1002-0306.2015.01.004
