大鼠雪旺细胞体外分离培养纯化及鉴定
2015-06-05张春燕张自强刘玉梅王玉琴
张春燕,张自强,刘玉梅,邓 雯,王玉琴,2
(1.河南科技大学 动物科技学院,河南 洛阳 471003;2.河南省肉羊繁育工程技术中心,河南 洛阳 471003)
大鼠雪旺细胞体外分离培养纯化及鉴定
张春燕1,张自强1,刘玉梅1,邓 雯1,王玉琴1,2
(1.河南科技大学 动物科技学院,河南 洛阳 471003;2.河南省肉羊繁育工程技术中心,河南 洛阳 471003)
雪旺细胞在周围神经损伤后的修复过程中起着关键的作用,因此,建立一种稳定的分离、培养和纯化方法极其重要。本文通过一种简单的培养方法获取大量高纯度的雪旺细胞。首先,从出生6 d的SD大鼠分离获得坐骨神经,用胰酶和胶原酶消化得到雪旺细胞;待细胞贴壁后,用阿糖胞苷进行纯化,随后在培养基中加入氟丝扣林促进细胞增殖研究。研究结果显示:雪旺细胞的形态以细长梭形为主,少数呈现三角形。混杂的成纤维细胞经阿糖胞苷作用后逐渐变圆、死亡,而雪旺细胞无明显减少,纯化后的雪旺细胞经氟丝扣林作用后增殖速度提高。经S-100和胶质原纤维酸性蛋白(GFAP)免疫荧光鉴定,雪旺细胞的纯度达到97%以上,因此,通过该方法可获得大量高纯度的雪旺细胞。
雪旺细胞;体外培养;纯化;鉴定
0 引言
雪旺细胞是周围神经系统中主要的神经胶质细胞,能够营养保护外周神经,在外周神经损伤修复中发挥着重要作用[1],它可以分泌多种神经营养因子促进轴突再生,保护外周神经的正常功能[2]。但在雪旺细胞的提取过程中总会混杂有成纤维细胞,因此,要获得高纯度的雪旺细胞,就必须除去其中混杂的成纤维细胞[3],传统的除去成纤维细胞的方法有很多,但是效果都不太理想。因此,本研究通过对传统方法进行改良,采用双酶消化法和阿糖胞苷对分离培养的雪旺细胞进行两次纯化,并添加氟丝扣林促进细胞增殖,以此获得大量高纯度的雪旺细胞。
1 材料和方法
1.1 试验动物
出生6 d的雄性SD仔鼠5只,由郑州大学实验动物中心提供,动物质量合格证号:生产许可证SCXK(豫)2010-0002。
1.2 主要试剂
高糖培养基(DMEM):GIBCO公司;胰蛋白酶、青霉素-链霉素溶液:碧云天生物技术研究所;胎牛血清(FBS):杭州四季青生物工程材料公司;S-100:Abcam公司;胶质原纤维酸性蛋白(GFAP):Chemicon公司;阿糖胞苷、氟丝扣林、Ⅰ型胶原酶:SIGMA公司。
1.3 仪器设备
倒置荧光显微镜:Olympus公司;CO2培养箱:Thermo公司;超净工作台:苏州佳宝净化工程设备有限公司。
1.4 方法
1.4.1 雪旺细胞体外分离培养与纯化
选择出生6 d的SD仔鼠,颈椎脱臼处死后在无菌环境中取出两侧坐骨神经,剪成2 mm的小段;然后用含有青链霉素的磷酸盐缓冲液(PBS)清洗3次,将神经组织转移到离心管中,并向其中加入2 mL(2.5 g/L)的胰蛋白酶和1 mL(625 U/mL)Ⅰ 型胶原酶,37 ℃下在恒温振荡器中消化30 min。然后,加入血清终止消化,1 500 r/min离心5 min,弃去上清,剩余组织中加入625 U/mL的 Ⅰ 型胶原酶2 mL,于37 ℃下消化50~60 min。随后加入等体积的DMEM培养液稀释,1 500 r/min离心5 min,弃去上清,最后用DMEM培养液(每100 mL DMEM培养液中含15 mL FBS)重悬细胞,接种于25 cm2培养瓶中培养。待细胞基本贴壁后,向培养瓶中加入含10-5mol/L阿糖胞苷的DMEM培养液4 mL作用48 h,然后改为含2 μmol/L 氟丝扣林的DMEM培养液,每2~3 d换一次液,当细胞长至80%融合时开始进行传代培养,每天观察细胞的形态变化。
1.4.2 雪旺细胞的鉴定
纯化后的雪旺细胞培养到第3代,将细胞消化离心并制作爬片,72 h后各组细胞爬片用0.01 mol/L PBS清洗2次,然后放到40 g/L的多聚甲醛固定1 h,在室温下加入100 mL/L甲醇和30 g/L过氧化氢封闭40 min,再加PBS 清洗3次。随后加入2 mL、2.5 g/L的胰蛋白酶,在室温下放置5 min后用PBS振荡洗涤3次,再用正常的羊血清37 ℃孵育1 h后吸出,用S-100(鼠抗IgG,抗体和PBS按1∶500体积稀释)、GFAP抗体(鼠抗IgG,抗体和PBS按1∶500体积稀释)4 ℃孵育过夜后,用异硫氰酸荧光素(FITC)标记的羊抗鼠IgG抗体(抗体和PBS按1∶250体积稀释)37 ℃孵育2 h,PBS洗涤3次,晾干后封片于倒置荧光显微镜下观察。
2 结果与分析
2.1 原代和传代细胞形态的观察
细胞接种3 h后少量细胞开始贴壁,24 h后贴壁细胞逐渐增加。贴壁细胞根据形态可分两种:胞体宽大、体积较大、立体感不强的是成纤维细胞,此类细胞数量较少;两极长突起、胞体呈细长梭形、边缘有光晕的为雪旺细胞,此类细胞数量较多(见图1)。随着培养时间的延长,雪旺细胞数量逐渐增多,阿糖胞苷处理后,雪旺细胞数量无明显减少,而成纤维细胞逐渐变圆,死亡(见图2)。图3为不同显微倍数下氟丝扣林作用后的雪旺细胞。由图3可见:纯化后的雪旺细胞经氟丝扣林作用后增殖速度明显加快,在1周内即出现增殖汇合。
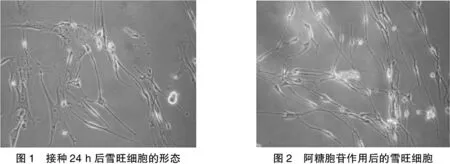
图1 接种24h后雪旺细胞的形态图2 阿糖胞苷作用后的雪旺细胞
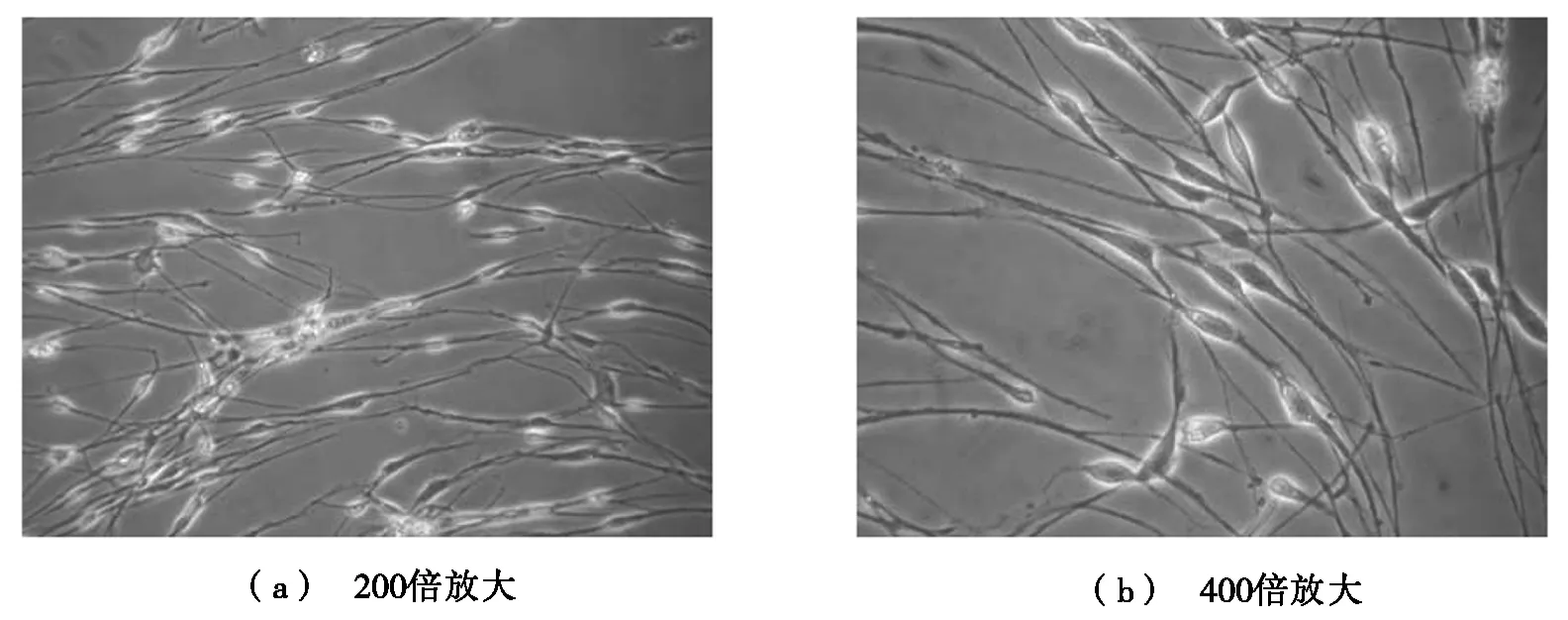
图3 氟丝扣林作用后的雪旺细胞形态
2.2 雪旺细胞特异性蛋白S-100及GFAP的表达
经免疫荧光检测所培养细胞的标记物GFAP和S-100发现:细胞均呈现绿色荧光,图4为S-100和GFAP经免疫荧光染色后的表达结果。说明GFAP和S-100在细胞中呈阳性表达,证实本试验分离培养纯化后的细胞为雪旺细胞。

(a) S-100 (b) GFAP
图4 雪旺细胞特异性蛋白S-100及GFAP的表达
3 讨论
由于雪旺细胞在周围神经结构组成中具有重要的特殊地位和作用,因此成为近年来神经修复领域的热点。到目前为止,周围神经损伤后修复最好的方法是自体神经移植[4],而这种方法会导致供体神经损伤。随着组织工程技术的发展,人们发现将体外培养的雪旺细胞移植到神经支架上,再植入动物体后对周围神经损伤的修复有一定的效果[5]。进一步研究发现:人工神经中雪旺细胞与嗅球成鞘细胞的联合应用,在缺损神经的再生速度上能起到与自体神经移植同样的效果[6]。人工神经的发展应用不仅能取得同自体神经移植相似的治疗效果,也避免了由于自体神经取材而造成对供体的损伤。然而,人工神经需要大量高纯度的雪旺细胞,如何快速有效地获取足够的雪旺细胞仍是一个难点。1906年,Harrison发表了一篇关于雪旺细胞体外培养技术的文章,自此之后,雪旺细胞体外培养技术便不断得以改善。目前,雪旺细胞的培养方法主要有组织块培养法、酶消化法以及两者联合应用[7],但这些方法都存在一定的缺陷,本研究通过试验,摸索出最佳的雪旺细胞体外培养方法。
文献[8]研究发现:雪旺细胞培养难度随动物年龄增高而增大,因此,本试验选择出生6 d的SD大鼠,既避免了新生动物的坐骨神经与周围黏连过紧难于分离,也不会降低细胞的增殖速度。目前,雪旺细胞纯化的方法主要有双酶消化法、层黏连蛋白吸附法、免疫磁珠法及抗有丝分裂法等[9],本研究在双酶消化法的基础上进行了改良。传统的双酶消化法是在剪碎的神经组织块中直接加入胶原酶和胰酶进行长时间的消化[10],这种消化方法不能彻底去除其中混杂的成纤维细胞。而本试验在处理过的神经中先加入胰酶和胶原酶,消化掉外层的成纤维细胞和部分细胞间质,再通过较长时间的胶原酶消化去除剩余的细胞间质,最终得到较为纯净的雪旺细胞。这种方法虽然多一个步骤,但能较好地去除杂质,且不会对雪旺细胞造成显著的损害。在雪旺细胞贴壁后,为了清除残余的成纤维细胞,又在培养基中加入阿糖胞苷,进一步进行纯化。在这一系列的纯化过程中,为使雪旺细胞的数量提高,又加入了氟丝扣林促进其增殖。研究发现氟丝扣林可以通透细胞、激活腺苷酸环化酶、提高胞内环磷酸腺苷的水平。环磷酸腺苷参与调节细胞多种功能,可促进神经系统中一些神经细胞的分化及突起的生长,从而促进细胞的有丝分裂[11]。本文的方法不仅可以较好地去除杂质,对雪旺细胞影响较小,而且还大大提高了雪旺细胞的数量,取材方便,步骤简单易掌握。
雪旺细胞作为组织工程种子细胞的重要来源一直备受关注,本试验采用简单的方法即可获得大量高纯度的雪旺细胞,为进一步研究建立周围神经损伤模型提供了一个简单可行的方案。
[1] Corfas G,Velardez M O,Ko C P,et al.Mechanisms and Roles of Axon-Schwann Cell Interactions[J].J Neurosci,2004,24(42):9250-9260.
[2] 孙晓宇.雪旺细胞对于周围神经再生的功能与作用[J].内蒙古民族大学学报:自然科学版,2010,25(1):105-107.
[3]BuchstallerJ,SommerL,BodmerM,etal.EfficientIsolationandGeneExpressionProfilingofSmallNumbersofNeuralCrestStemCellsandDevelopingSchwannCells[J].JNeurosci,2004,24(10):2357-2365.
[4] 李煜,於子卫.神经干细胞与雪旺细胞联合应用于神经损伤修复的研究进展[J].临床耳鼻咽喉头颈外科杂志,2014,28(13):1006-1009.
[5]BozkurtA,DeumensR,BeckmannC,etal.InVitroCellAlignmentObtainedwithaSchwannCellEnrichedMicrostructuredNerveGuidewithLongitudinalGuidanceChannels[J].Biomaterials,2009,30(2):169-179.
[6] 游华,矫树生,陈建梅,等.组织工程人工神经对大鼠坐骨神经缺损后神经再生速度的影响[J].成都医学院学报,2010,5(3):193-195.
[7] 连小峰,侯铁胜,傅强,等.植块法与酶消化法结合培养原代大鼠雪旺细胞[J].中国脊柱脊髓杂志,2008,18(9):703-706,726.
[8]CasellaGT,BungeRP,WoodPM.ImprovedMethodforHarvestingHumanSchwannCellsfromMaturePeripheralNerveandExpansioninVitro[J].Clia,1996,17(4):327-338.
[9] 付红运,王锐英.雪旺细胞体外培养与纯化进展[J].海南医学,2012,22(23):118-121.
[10] 张勇杰,金岩,聂鑫,等.多步法分离和纯化雪旺细胞的实验研究[J].中华神经外科疾病研究杂志,2002(4):347-350.
[11]SchmidtU,PilgrimC,BeyerC.DifferentiativeEffectsofDopamineonStriatalNeuronsInvolveStimulationofthecAMP/PKAPathway[J].MolCellNeurosci,1998,11(1/2):9-18.
国家自然科学基金项目(31101779)
张春燕(1990-),女,河南义马人,硕士生;邓 雯(1964-),男,河南商丘人,教授,硕士生导师,主要从事动物生理学的教学和科研工作;张自强(1978-),男,通信作者,内蒙古正蓝旗人,副教授,博士,主要从事干细胞和神经生物学方面的研究.
2015-01-06
1672-6871(2015)04-0082-03
Q813.11
A
