腺苷A2A受体阻断剂SCH58261对大鼠杏仁核点燃癫痫模型的影响
2015-06-05康慧聪刘晓艳杨春水李建英朱遂强
李 巷,康慧聪,刘晓艳,杨春水,李建英,朱遂强*
(1.深圳市南山区人民医院神经内科,广东深圳518052;2.华中科技大学附属同济医院神经内科,湖北武汉430030)
腺苷A2A受体阻断剂SCH58261对大鼠杏仁核点燃癫痫模型的影响
李 巷1,康慧聪2,刘晓艳2,杨春水1,李建英1,朱遂强2*
(1.深圳市南山区人民医院神经内科,广东深圳518052;2.华中科技大学附属同济医院神经内科,湖北武汉430030)
目的研究腺苷A2A受体阻断剂SCH58261对大鼠杏仁核点燃癫痫模型的作用。方法制作杏仁核电刺激模型。点燃成功后的大鼠,通过腹腔给药的方法,观察SCH58261对模型成功后各发作参数的作用。整个实验过程中,严密观察药物对大鼠行为学的影响。结果在成功点燃的癫痫模型中,SCH58261(0.005,0.05,0.5mg/kg)对全面性发作阈值(GST)没有影响。以GST(+4μA)为刺激强度,SCH58261(0.005,0.05mg/kg)可以降低杏仁核后放电时间(ADD),运动性发作持续时间(MSD),5级发作持续时间(S5D)和癫痫发作总的持续时间(SD);SCH58261(0.005,0.05mg/kg)对癫痫4级发作潜伏期(S4L)和癫痫发作状态(SS)没有影响;SCH58261(0.5mg/kg)对点燃模型各发作参数均无抑制作用。以2×GST为刺激强度,SCH58261(0.05mg/kg)对ADD和S5D均无明显抑制作用,但可以降低MSD和SD发作时间。结论SCH58261在0.005-0.05mg/kg范围内可以抑制模型点燃成功后痫性发作。
SCH58261;杏仁核点燃;后放电持续时间
(Chin J Lab Diagn,2015,19:0175)
腺苷受体包括A1,A2A,A2B和A3受体。以往将其分为与抑制性G蛋白偶联的A1和A3受体,及与兴奋性G蛋白偶联的A2A和A2B受体[1]。腺苷作为内源性抗癫痫物质主要通过与A1受体偶联发挥抗癫痫作用[2]。但是癫痫反复发作导致细胞外腺苷浓度下降,腺苷A1受体密度及结合力也降低,导致腺苷的这种抗癫痫作用明显减弱。研究发现,在多种慢性动物模型中如帕金森模型、亨廷顿模型中,相较于腺苷A1受体,A2A受体密度及结合力均增高,是腺苷发挥作用的主要受体。并且发现,阻断A2A受体可以有效的起到脑保护作用[3];但在电点燃癫痫模型中,腺苷A2A受体阻断剂对各发作参数没有明显影响。然而,该实验选取时间点在癫痫点燃急性期,且以脑区方式给药,未对癫痫反复发作后的状态进行研究。
本实验即在此基础上,应用选择性高的腺苷A2A受体阻断剂SCH58261,制作杏仁核点燃癫痫模型,研究其对点燃成功一个月后各发作参数的影响。
1 材料与方法
1.1 实验动物
SPF级雄性Wistar大鼠250-300g,购自湖北省实验动物中心,所有实验大鼠均在标准实验条件下饲养(12h昼夜交替光照、避噪音、单笼、自由饮食、温度18-25℃、相对湿度40%-70%)。实验动物在手术前后均给予充足水和食物,实验过程中尽可能减轻动物痛苦。所有实验均经华中科技大学伦理委员会审查批准。
1.2 电极植入及模型点燃
实验动物用水合氯醛麻醉后(6%,用量为0.5 ml/100g体重,腹腔注射),固定在立体定位仪上,根据Paxins and Watson图谱[4]确定右侧杏仁核基底外侧核(BLA)的坐标,前囟后2.2mm(Y),旁开右侧4.8mm(X),颅骨表面下8.5mm(Z),将五芯电极中扎入电极植入。将其他3个电极分别接上微型螺丝,置于前囟点左右作为记录电极,置于人字缝后方作为参考电极。用牙托粉将电极固定于颅骨表面。术后将大鼠置于笼中,白炽灯取暖。术后一周,每天抓取,监测体重变化,自由进食水和食物。
手术一周后,所有大鼠每天在固定时间开始予以电刺激(细电流,连续串刺激,延时100ms,波宽1 ms,波间隔19ms,频率50Hz,串长100,方波,刺激强度500μA,1次/d)。刺激前后记录杏仁核后放电(ADD)及大鼠行为学变化。发作强度参照国际通用的Racine分级[5]。0级:无反应;1级:不动,闭眼睛,耳朵和胡须颤搐,吸气及面部痉挛;2级:点头及更严重的面部痉挛;3级:前肢单肢阵挛;3.5级:双前肢阵挛,未直立;4级:双前肢阵挛伴身体直立;4.5级:强直阵挛发作伴随向一侧倒地(身体未直立);5级:强直阵挛发作伴随直立并背部倒地。连续10天达到5级发作视为模型点燃。
1.3 药物对完全点燃癫痫模型的影响
①对于点燃成功的大鼠,测定全面性发作阈值(GST):方法为杏仁核刺激电流最开始为10μA,其余参数设置同前,刺激后观察大鼠行为学变化,根据Racine分级记录大鼠发作级数,若大鼠未达到5级发作,继续予以刺激,间隔为1min,刺激电流每次增加20%,直到大鼠达到5级发作的电流值即为GST。GST测定重复2-3天,直到GST及GST所引起的癫痫发作稳定。不满足上述条件大鼠排除实验。
②符合实验条件的大鼠,随机挑选一部分分为3个浓度组(0.005mg/kg,0.05mg/kg,0.5mg/kg),测定对点燃大鼠GST的影响。不同实验组的动物首先在刺激前30min腹腔注射溶剂(含10% DMSO的生理盐水),测定GST并记录数值作为对照组;24h后,同样方式腹腔注射不同浓度的SCH58261,测定GST作为药物组。
③随机挑选符合实验条件的大鼠,分为三个浓度组:0.005mg/kg,0.05mg/kg,0.5mg/kg。不同实验组的动物首先在刺激前30min腹腔注射溶剂(含10%DMSO的生理盐水),用接近GST(GST+4μA)电流强度刺激并记录参数作为对照组;24h后,同样方式腹腔注射不同浓度的SCH58261,刺激后记录发作参数作为药物组,观察药物对模型的作用。
④随机挑选符合实验条件的大鼠,以2×GST为刺激电流,观察0.05mg/kgSCH58261对杏仁核点燃模型的影响。
⑤每次刺激后记录以下参数:Ⅰ癫痫发作级数(SS);Ⅱ杏仁核后放电持续时间(ADD);Ⅲ4级发作潜伏期(S4L),即从刺激开始到4级发作的时间;Ⅳ运动性发作持续时间(MSD)Ⅴ5级发作持续时间(S5D)ⅤⅠ癫痫发作持续时间(SD)。实验中大鼠在运动性发作后会有长时间呆立不动,偶有面部抽动,不计入SD。
1.4组织学变化
实验完成后,将大鼠断头处死,取出脑组织,迅速置于在-80度冰箱预冷的异戊烷中速冻,约一分钟后取出,锡纸包裹做标记后存于-80度冰箱备用。制备冰冻切片,尼氏染色后中性树胶封片,镜下观察电极位置是否正确,有无异常出血及组织损害。有以上情况出现的大鼠实验数据予以剔除。整个实验过程中,严密观察药物对大鼠行为学的影响。
1.5 统计学分析
数据分析和作图采用Spss 16.0和Sigmaplot 11.0软件。数据以x—±s来表示。点燃模型中每个浓度药物组与对照组之间比较采用配对T检验,各组间差异分析采用两样本T检验或单因素方差分析。P<0.05代表有统计学意义。
2 结果
2.1 杏仁核点燃大鼠癫痫模型的行为学及脑电特点
实验中所有大鼠随刺激次数的增加,SS和ADD均逐渐增加,最终达到稳定5级发作(图1A和B)。点燃过程中个别动物发作状态可有轻度波动,多数出现在达到4级发作前。图1C和D显示的是点燃前后所记录的脑电波:点燃前未见痫样放电,点燃后模型癫痫发作时可以看见大量高幅棘波发放,发作间期脑电基本频率正常,偶有棘波出现。
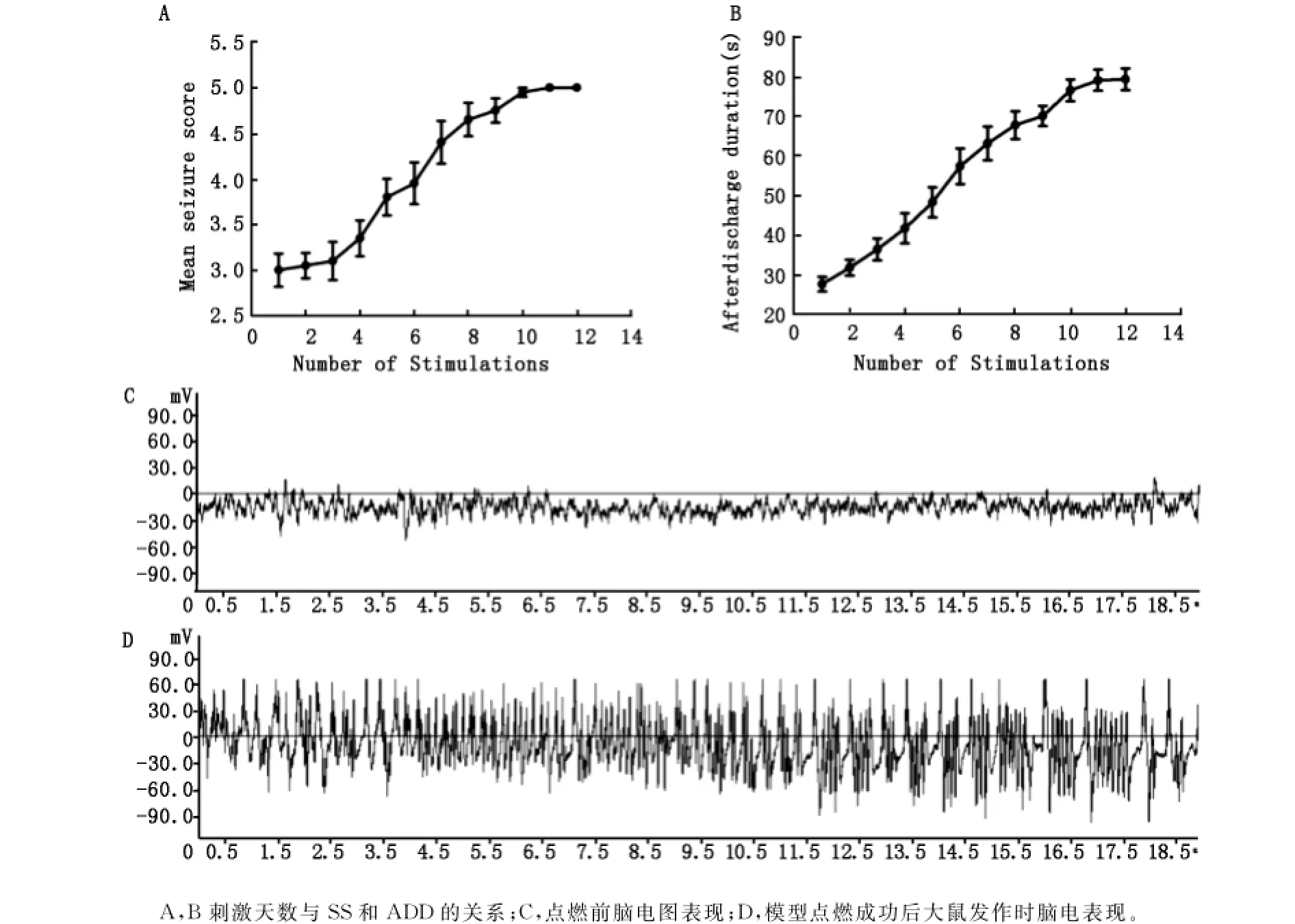
图1 杏仁核点燃癫痫模型的行为学和脑电图特点
2.2 SCH58261对杏仁核点燃癫痫模型GST的影响
图2显示3个浓度SCH58261对GST均没有明显影响。
2.3 SCH58261对杏仁核点燃癫痫模型的作用(刺激电流:GST+4μA)
在完全点燃的大鼠模型中,实验中3个浓度SCH58261对SS和S4L的影响均没有统计学意义。SCH58261(0.005-0.05mg/kg)腹腔注射可以降低ADD,MSD,S5D和SD。SCH58261(0.005mg/kg)对ADD,MSD,S5D和SD的降低程度分别为17.33%,22.34%,25.50%and 15.98%;SCH58261(0.05mg/kg)对ADD,MSD,S5D和SD的降低程度分别为22.24%,28.76%,26.02%and 22.47%(图3)。尽管随着浓度的增加,上述指标的降低程度也有所增加,但是,两样本T检验分析显示两个浓度对发作参数的影响差别无统计学意义。实验中所选取的0.5mg/kg剂量对发作时所有参数均无影响。
图3中,尽管3个不同剂量所对应的对照组数据之间有差异,实验中采用加药前后配对T检验来进行统计学研究,对照组间差异不影响实验结果的分析。

图2 腹腔注射不同浓度SCH58261对杏仁核点燃癫痫大鼠GST的影响
2.4 SCH58261对杏仁核点燃癫痫模型的作用(电流刺激:2×GST)
在SCH58261剂量为0.05mg/kg时,观察不同刺激强度下,药物对杏仁核点燃模型各发作参数的影响。从图4中可以看见,随着刺激强度的增加,SCH58261(0.05mg/kg)对ADD和S5D的抑制作用消失,虽然仍可以降低MSD和SD发作时间,但抑制作用减弱。
2.5 组织学分析和行为学评价
实验中所有大鼠均表现出稳定的5级发作,溶剂(10%DMSO)对癫痫发作参数没有影响。SCH58261(0.005,0.05,0.5mg/kg)不影响大鼠正常行为学表现。一只大鼠因为GST不稳定排除实验,切片分析电极附近脑组织有损伤;另有一只大鼠因电极不在杏仁核外侧核从实验组中剔除。
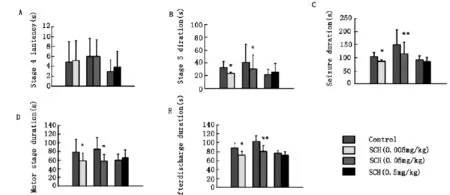
图3 腹腔注射SCH58261(0.005-0.5 mg/kg)对杏仁核点燃大鼠S4L,ADD,MSD,S5D和SD的影响。结果以均值±标准差表示。(刺激电流强度为GST+4μA)(*P<0.05 and**P<0.01,配对T检验)
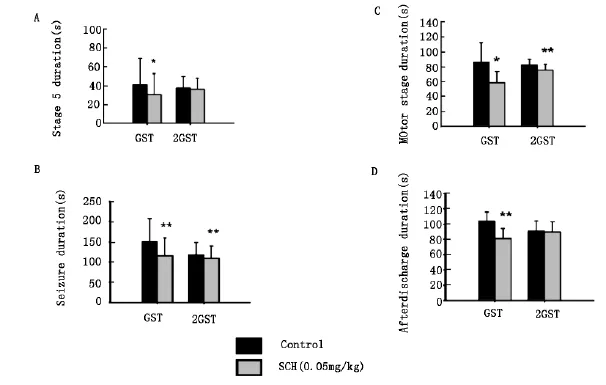
图4 腹腔注射SCH58261(0.05 mg/kg)对杏仁核点燃大鼠ADD,MSD,S5D和SD的影响。结果以均值±标准差表示。(刺激电流强度为2×GST)(*P<0.05 and**P<0.01,配对T检验)
3 讨论
在成功点燃的癫痫模型中,SCH58261(0.005,0.05,0.5mg/kg)对GST没有影响,即不影响癫痫全面发作。以GST(+4μA)为刺激强度,SCH58261(0.005,0.05mg/kg)可以降低ADD,
MSD,S5D和SD;SCH58261(0.005,0.05mg/kg)对S4L和SS没有影响;SCH58261(0.5mg/kg)对点燃模型各发作参数均无抑制作用。以2×GST为刺激强度,SCH58261(0.05mg/kg)对ADD和S5D的抑制作用消失,但可以降低MSD和SD发作时间。
与腺苷A1受体在脑中的广泛分布不同,腺苷A2A受体主要分布于基底节区,较其他脑区相比分布密度高出20倍之多[6]。有关腺苷A2A受体的研究集中在纹状体间接通路的中间神经元,主要与锥外系相关。但是,近年来多种实验方法如原位杂交,受体结合力实验,免疫及功能学研究均发现腺苷A2A受体在新皮层和边缘系统也有分布。分布于基底节的腺苷A2A受体主要定位于突触后膜,基底节以外的A2A受体则主要分布于突触前膜,调节兴奋性及抑制性氨基酸的释放[7]。研究证实,在慢性毒性条件下,如帕金森模型[8],A2A受体表达密度上调,这种分布也存在于基底节区以外,而且更明显[9]。这就说明,相对于A1受体,A2A受体在一些慢性模型如癫痫模型所起的作用更大。目前关于A2A受体在癫痫中的作用存在争议:脑干癫痫模型中,激活A2A受体可以有效控制癫痫发作[10];A2A受体激动剂CGS21680对毛果芸香碱诱发癫痫的抑制作用是通过激活A1受体实现的[11];Vaugeois等用A2A受体敲除鼠证实较野生型小鼠,A2A受体的缺失可以有效抵抗精神运动性发作和酒精撤退导致的癫痫发作[12,13]。在电刺激点燃模型中,A2A受体激动剂增加了ADD而A2A受体阻断剂没有明显作用[14]。上述不同的实验结果可能是因为不同的癫痫模型形成机制及药物作用的浓度方式不同所致。
本实验的结果显示刺激强度为GST+4μA时,腹腔注射SCH58261(0.005,0.05mg/kg)可以降低杏仁核点燃癫痫模型的ADD,MSD,SD,和S5D,刺激强度增加为2×GST时,MSD及SD持续时间仍有所降低。与之前的研究有所不同(局部脑区注射ZM241385 50-500μM,选择性A2A受体阻断剂,对梨状皮层点燃癫痫模型没有抑制作用)。分析原因如下:当大鼠点燃模型成功时,作为一种代偿机制大鼠脑内腺苷释放增加,腺苷A1受体密度及结合力均增加,同时伴随腺苷A2A受体密度及结合力降低[15];在这种情况下,内源性腺苷主要通过A1受体起作用,此时应用A2A受体阻断剂不能有效发挥作用;而本实验选取大鼠均在点燃四周以后,腺苷A2A受体密度及结合力均上调,内源性腺苷主要与A2A受体结合发挥兴奋性作用,此时应用A2A受体阻断剂可以有效发挥抑制作用。已有研究报道,SCH58261腹腔注射30min后可以在脑内达到有效的药物浓度,起到脑保护作用[16]。本课题组前期应用另一种高选择性腺苷A2A受体阻断剂ZM241385侧脑室注射也取得相似结果[17];本实验再次证实了腺苷A2A受体阻断剂在杏仁核点燃癫痫模型慢性期的抑制作用。
实验中所记录的点燃模型的发作参数中,ADD是判断癫痫活动的一个重要指标,结果显示SCH58261可以降低杏仁核ADD,同时,SCH58261也不同程度减低了MSD,S5D及SD。实验也发现,SCH58261对S4L没有影响,即不影响1-3级发作,也就是说SCH58261不能抑制痫性放电从杏仁核向其他脑区扩散。基于上述分析,SCH58261在杏仁核点燃癫痫模型中主要抑制4,5级发作而不是部分性发作。
实验发现,SCH58261在浓度为0.005-0.05 mg/kg时有抗癫痫作用,而剂量增加到0.5mg/kg时此作用又消失;在0.005-0.05mg/kg浓度范围内,尽管随着剂量的增加,SCH58261对各发作参数的抑制作用增强,但两者之间差异没有统计学意义。分析原因可能是由于SCH58261是一个高选择性A2A受体阻断剂[18],SCH58261的抗惊厥作用最可能通过阻断A2A受体介导。SCH58261在浓度达到0.005mg/kg时可能就可以完全阻断脑内起作用的A2A受体,在浓度继续增加的情况下,更高浓度的SCH58261并没有发挥有效作用。事实上,已有研究证实高剂量的A2A受体阻断剂可能丧失其神经保护作用[19]。本实验也发现当SCH58261浓度达到0.5mg/kg时不能起到抗癫痫作用。这可能是因为当A2A受体阻断剂剂量更高时,其他的腺苷受体如A1受体也被阻断,减弱A1受体的保护作用。同时,更高剂量的SCH58261可能产生一些其他系统的作用从而影响药物作用的发挥[20]。
与A1受体激动剂相比,A2A受体阻断剂的药理学特性使其更有可能成为有效的脑保护剂。多项研究证实其发挥脑保护作用的有效浓度远低于其产生心血管作用的浓度[21]。文献报道,当SCH58261腹腔注射剂量达到1mg/kg时,不会对血流动力学产生影响。同时,在已进行的临床试验中,也没有发现A2A受体阻断剂有明显的神经系统副作用。本实验中,SCH58261(0.005-0.5mg/kg)没有影响大鼠正常行为学表现。综上所述,在有效浓度范围内A2A受体阻断剂对心血管及其他系统没有明显的影响,同时在多种疾病模型中A2A受体有较长作用时间,使A2A受体及其阻断剂成为药物研究新靶点。
关于SCH58261发挥抗癫痫作用的机制有多种可能:多位研究者体外实验证实A2A受体可以调节皮层、海马和纹状体神经元突触前膜谷氨酸的释放,并提出假说:阻断A2A受体可以抑制兴奋性氨基酸(谷氨酸)的释放从而发挥脑保护作用[22,23]。有研究证实谷氨酸释放增加可以促发癫痫[24]。同时,Dr R.Ciccarelli也进一步在失神癫痫模型中证实了激活A2A受体谷氨酸释放增多,浓度增高[25]。因此,本实验SCH58261可能通过抑制谷氨酸释放发挥抗癫痫作用。另一种可能的原因是,阻断A2A受体减弱了A2A受体对A1受体的抑制作用,从而使其更好的发挥脑保护作用。除此之外,Sergio fucile等在离体实验中也发现阻断A2A和A3受体可以降低转入爪蟾卵细胞中的人类GABA(A)电流的脱敏作用,从而增加突触后膜GABA(A)电流的稳定性,使抑制性电流发挥作用时间延长[26]。同时,阻断A2A受体还可以减低钙内流发挥保护作用。
实验证实,SCH58261可以抑制大鼠杏仁核癫痫模型点燃成功后模型的发作参数,并且在有效浓度范围内,对其他系统没有明显的影响。
[1]Cristalli G,Lambertucci C,Marucci G,et al.A2Aadenosine receptor and its modulators:overview on a druggable GPCR and on structure-activity relationship analysis and binding requirements of agonists and antagonists[J].Curr Pharm Des,2008,14(15):1525
[2]Fedele DE,Li T,Lan JQ,et al.Adenosine A1receptors are crucial in keeping an epileptic focus localized[J].Exp Neurol,2006,200(1):184.
[3]Cunha RA.Neuroprotection by adenosine in the brain:From A(1)receptor activation to A(2A)receptor blockade[J].Purinergic Signal,2005,1(2):111.
[4]Paxinos G,Watson CR,Emson PC.AChE-stained horizontalsections of the rat brain in stereotaxic coordinates[J].JNeurosci Methods,1980,3(2):129.
[5]Racine RJ.Modification of seizure activity by electricalstimulation.II.Motor seizure[J].Electroencephalogr Clin Neurophysiol,1972,32(3):281.
[6]Lopes LV,Halldner L,Rebola N,et al.Binding of the prototypical adenosine A(2A)receptor agonist CGS 21680to the cerebral cortex of adenosine A(1)and A(2A)receptor knockout mice[J].Br J Pharmacol,2004,141(6):1006.
[7]D'Alimonte I,D'Auro M,Citraro R,et al.Altered distribution and function of A2Aadenosine receptors in the brain of WAG/Rij rats with genetic absence epilepsy,before and after appearance of the disease[J].Eur J Neurosci,2009,30(6):1023.
[8]Tomiyama M,Kimura T,Maeda T,et al.Upregulation of striatal adenosine A2Areceptor mRNA in 6-hydroxydopamine-lesioned rats intermittently treated with L-DOPA[J].Synapse,2004,52(3):218.
Protective effect of adenosine A2Areceptor antagonist SCH58261 on amygdalakindled seizures in Wistovr rats
LI Xiang1,
KANG Hui-cong2,LIU Xiao-yan1,et al.(1.Department of Neurology Nanshan Hospital Shanzhen,Guangdong 518052,China;2.Department of Neurology Tongji Hospital,Tongji Medieal College,Huazhong University of Science and Technology,Wuhan,Hubei 430030,China)
ObjectiveEvaluate the effect of adenosine A2Areceptor antagonist SCH58261on amygdala-kindled seizures and its potential for epileptogenesis.MethodsKindling was accomplished through stimulitingthe amygdala in rats.Then effect of SCH58261was studied in fully kindled rats after intraperitoneal injection.In addition,In all experiments,behavioral changes in the rats in response to SCH58261were monitored closely.ResultsIn fully amygdala-kindled rats SCH58261(0.005,0.05,0.5mg/kg)had no effect on generalized seizure threshold(GST).In the stimulus intensity of GST(+4μA)SCH58261(0.005,0.05mg/kg)decreased afterdischage duration(ADD),motor seizure duration(MSD),stage 5duration(S5D)and seizure duration(SD);it had no influence on stage 4latency(S4L)and seizure stage(SS).SCH58261(0.5mg/kg)had no effect on all seizure parameters.In the stimulus intensity of 2×GST SCH58261(0.05mg/kg)decreased MSD and SD,but can not affect ADD and S5D.ConclusionSCH58261had potent anticonvulsant profile and little adverse effects at the dosage of 0.005-0.05mg/kg,suggesting that the substance was effective against amygdala-kindled seizures.
SCH58261amygdala-kindled afterdischage duration
R742.1
A
2014-11-20)
1007-4287(2015)02-0175-06
国家自然科学基金青年基金项目:81201006,湖北省自然科学基金项目:2011CDB201,深圳市南山区技术研发和创意设计项目分项基金:南科研卫2012002
*通讯作者
