盐酸吡柔比星在67例乳腺癌患者中的用药情况调查
2015-06-01刘正军朱振伟
刘正军,朱振伟
·短篇论著·
盐酸吡柔比星在67例乳腺癌患者中的用药情况调查
刘正军,朱振伟
目的 调查本院67例乳腺癌患者应用盐酸吡柔比星的情况,并尝试建立细胞毒类药物应用评价方法。方法 建立Excel综合分析表评价病例单位体表面积用量、肝肾功能及用药过程监护情况等。结果 ①28例(41.8%)用药剂量在说明书推荐剂量范围内;②36例(53.73%)用药前3 d没有常规心电图检查记录;③病例资料完整可进行肾功能评估的66例(98.5%),可进行肝功能评估的58例(86.6%)。结论 本院乳腺癌病例在盐酸吡柔比星用药剂量、临床监护等方面有待进一步规范。
盐酸吡柔比星;细胞毒;临床监护
0 引言
基层医院(本文指县市级及其以下医疗机构)的细胞毒类药物合理应用评价,一直是临床药学工作的难点,建立较实用的评价方法与模式可以有效推动基层医院细胞毒类药物的合理应用。目前,以蒽环类药物为主的联合方案是公认的乳腺癌辅助治疗的标准方案[1]。本文尝试以单病种盐酸吡柔比星使用情况为样本,利用医院电子病历系统收集2年的全部相关病例数据,现总结如下。
1 资料与方法
1.1 资料来源 根据本院电子病历系统提供的信息,收集本院全部病区2011年7月至2013年6月共67份乳腺癌病例的盐酸吡柔比星静脉用药使用数据,同一患者不同化疗阶段(住院号不同)均按独立病例处理,并将注射用盐酸吡柔比星(深圳万乐药业有限公司)的说明书纳入分析资料。
1.2 方法 调查项目包括病区、住院号,患者性别、年龄、身高、体重、临床诊断、住院天数、相关化疗处方组成、使用盐酸吡柔比星前血常规和常规心电图检查次数、血清肌酐(CREA)、总胆红素(TBIL)、白蛋白(ALB)、凝血酶原时间(PT)、静脉用药过程中心电监护时间等16项内容。应用Excel设计盐酸吡柔比星单位体表面积用量计算表,计算分析调查病例相关用量情况,并对相关病例进行肝肾功能评估。最后结合药品说明书内容进行评价。
2 结果
2.1 用药剂量情况 67份乳腺癌病例来自肿瘤外科及另外2个外科病区,全部为女性患者,化疗方案为盐酸吡柔比星,再联合环磷酰胺、氟尿嘧啶中的1个或2个。根据盐酸吡柔比星说明书推荐的联合用药剂量范围,采用体表面积(m2)=0.006 1×身高(cm)+0.012 8×体重(kg)-0.152 9[Stevenson(许文生)公式][2]体表面积计算方法,计算全部病例实际用量的单位体表面积吡柔比星剂量数据,结果表明,有32例(47.8%)用药剂量平均低于说明书推荐剂量范围低值12.5%;28例(41.8%)用药剂量在推荐剂量范围内;7例(10.4%)用药剂量平均高于说明书推荐剂量范围高值3.4%。主要数据如下:年龄37~80岁,平均(55.3±8.4)岁;身高150~168 cm,平均(158.6±4.2)cm;体重45.0~78.5 kg,平均(57.8±7.0)kg;用药量50~80 mg,平均(62.8±11.1)mg;体表面积剂量29.9~52.8 mg/m2(说明书推荐剂量范围:40~50 mg/m2,采用Excel 2003的描述统计,取平均置信度=95%),平均(40.4±6.2) mg/m2。
2.2 临床监护情况 根据药品说明书[注意事项]相关规定,统计所有调查病例在住院期间的血常规、常规心电图、生化项目(包括血清肌酐、总胆红素、白蛋白)、出凝血4项或D-二聚体检查次数,确定用药前3 d内是否有相应的检查,见表1。
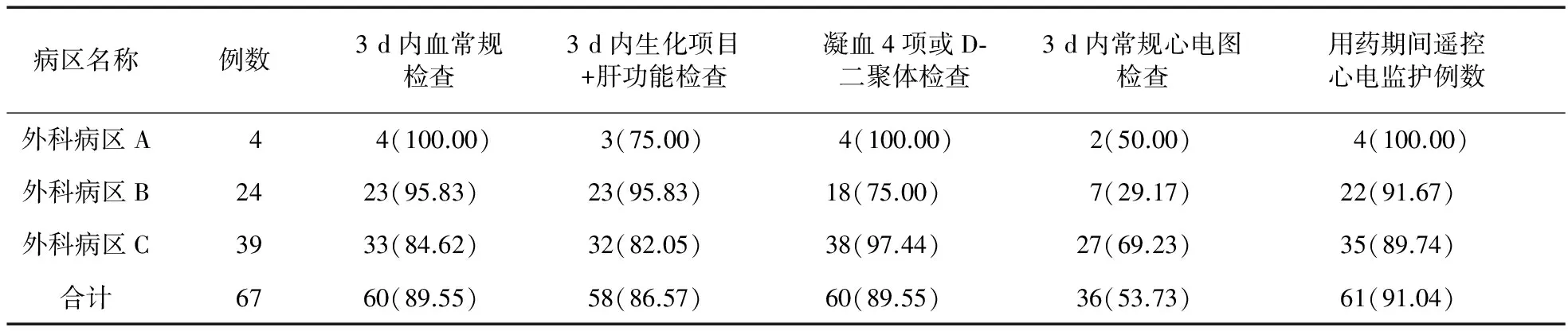
表1 临床监护情况数据(例,%)
2.3 肝肾功能评估 药品说明书中要求密切监测患者肝肾功能,笔者根据资料中性别、年龄、身高、体重、血清肌酐值、总胆红素、白蛋白、凝血酶原时间等8项指标进行肝肾功能评估。采用临床常用的Chlid-Puhg评分,分A、B、C级评估肝脏功能[3],共完成58例(86.6%),其中54例(93.1%)评估结果为Child A级,4例(6.9%)评估结果为Child B级;肾功能评估采用[浙江省抗菌药物临床合理应用指导方案(试行)推荐方法][4],完成评估66例(98.5%),其中9例(13.6%)为“正常”,52例(78.8%)为“轻度损害”,5例(7.6%)为“中度损害”。评估结果病区分布情况见表2。
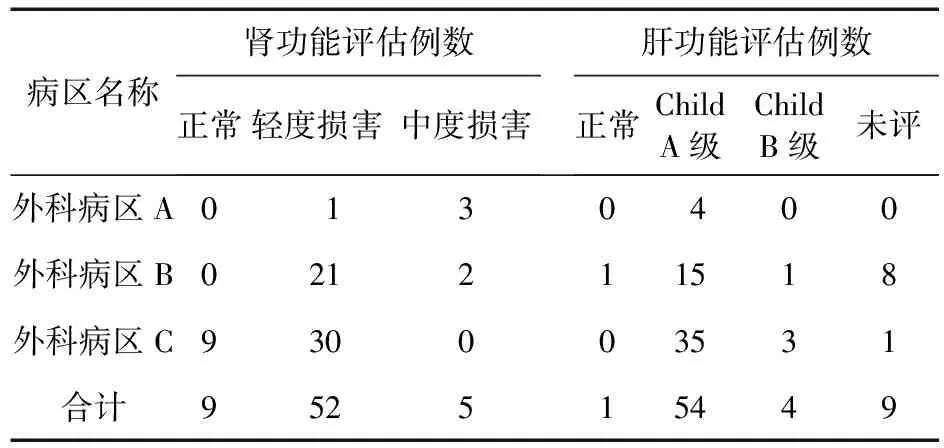
表2 肝肾功能评估结果病区分布(例)
注:未评:相关病例缺少评估指标,无法进行肝或肾功能评估
3 讨论
3.1 吡柔比星是蒽环类抗肿瘤药物,心脏毒性作用是其不良反应。蒽环类药物的心脏毒性为剂量限制性,且呈进展性与不可逆性[5],其导致的心脏毒性与药物的累积剂量呈正相关性[6]。“2.1项”中用药剂量平均超说明书剂量范围高值3.4%的7例涉及2例乳腺癌转移(肺、骨)患者,根据说明书规定,吡柔比星总限量为按体表700~950 mg/m2,结合该患者化疗计划等情况分析,认为此7例的单疗程用药剂量应属合理。需要关注的是,有47.8%(32例)用药剂量平均低于说明书推荐剂量范围低值12.5%(最小25.2%),调查发现这些低剂量病例均来自非肿瘤专科病区。
3.2 “2.2”项中,36例(53.73%)未发现用药前3 d有常规心电图检查记录,但有61例(91.04%)在用药过程中有遥控心电监护记录,说明许多病例用药前的常规心电图检查被用药时的心电监护替代,这种做法有待商榷。全部调查病例用药前的血常规、生化及肝功能检查等临床监护情况也有待进一步规范。
3.3 “2.3”项中,回顾性完成66例(98.5%)的肾功能评估,说明相关病例评估用参数及指标基本齐全,结果提示57例(85.1%)肾功能评估结果不正常;调查病例中有9例(13.4%)因缺少凝血酶原时间(PT)指标而无法进行肝功能评估,原因是Child-Pugh分级标准需要有TBIL、ALB、PT、是否存在肝性脑病和腹水及分级程度等指标数据[7]。
3.4 根据调查结果,吡柔比星联合用药是采用2~3种细胞毒类药物并配合相关辅助药物的化疗方案,这些方案均依据相关抗恶性肿瘤技术规范要求制订[8],相关评价有待于今后进一步开展。
4 建议
4.1 应用蒽环类药物时,应在用药前3 d内进行包括常规心电图在内的相关心脏功能检查。心电图作为蒽环类抗肿瘤药物最常用的心脏毒性检测手段,尽管特异性不高[9],在判别药物心脏毒性演变方面也不应被心电监护替代。积极、有效地监测患者的心脏功能变化,可以有助于指导临床用药、优化治疗方案(化疗/靶向药物、剂量强度和密度等),在不影响抗肿瘤疗效的同时,有可能使心脏毒性的发生率和程度降到最低[10]。
4.2 所有细胞毒用药患者的生化检查中,均应配合检查包含PT的相关检查项目,以建立肝功能评估参数体系。并建议医院相关医疗质量管理部门将相关检查项目作为病历质量管理的必备指标。
4.3 通过本项调查,初步建立了本院细胞毒类药物临床应用的监测方法,包括用药电子信息采集、剂量计算分析、指标监测统计及肝肾功能评估4个步骤,建立的Excel表格具有通用性,使用直观方便。
结果表明,本院在细胞毒类药物的临床规范化应用方面有待进一步提高,建议临床药师对所有细胞毒类药物的临床应用均进行定期监测,并将结果及时通报相关临床科室,促进医院细胞毒类药物规范合理应用。
[1] 张彦,李曼,赵璐.乳腺癌不同剂量表柔比星联合辅助化疗的疗效分析[J].中华肿瘤防治杂志,2014,21(15):1168-1173.
[2] 李红娟,高宇,王艳,等.不同体质量指数初一年级女生心肺功能发育水平比较[J].中国学校卫生,2014,35(6):803-805.
[3] 王丽,周乐兴.肝硬化Child_Pugh分级与肝脏合成功能相关性分析[J].中国现代药物应用,2014,3(8):62-63.
[4] 浙江省医院药事管理质控中心.浙江省抗菌药物临床合理应用指导方案(试行)[S].2008.
[5] 姜龙,龙浩,王华庆,等.蒽环类抗肿瘤药物的心脏毒性及保护剂的研究进展[J].中国肿瘤临床,2011,38(16):991-993.
[6] 刘培延,孙蔚莉,武渊,等.蒽环类药物在乳腺癌治疗中的心脏毒性及防治[J].中国医药指南,2012,10(22):105-108.
[7] 肝功能分级(Child-Pugh分级) [J].临床普外科电子杂志,2013,2(1):36.
[8] 马胜林.常见恶性肿瘤治疗管理及技术规范[M].杭州:浙江大学出版社,2006:97-98.
[9] 王梦,杨继元.蒽环类药物心脏毒性防治的新进展[J].癌症进展,2013,11(5):435-439.
[10]中国临床肿瘤学会,中华医学会血液学分会.蒽环类药物心脏毒性防治指南[J].临床肿瘤学杂志,2013,18(10):925-934.
A survey on clinical administration of pirarubicin hydrochloride to 67 cases with breast cancer
LIU Zheng-jun,ZHU Zhen-wei
(The People's Hospital of Haining City,Haining 314400,China)
Objective To investigate the clinical administration of pirarubicin hydrochloride to 67 patients with breast cancer in our hospital,and to establish evaluation methods for the application of cytotoxic drugs.Methods Excel tables for comprehensive analysis were established for the evaluation of the dosage based on body surface area,hepatic and renal functions and treatment process monitoring of each patient.Results ①The dosage for 28 patients (41.8%) was within the dose range recommended in instructions;②No routine ECG record was found in 36 patients (53.73%) in the first three days of treatment;③The assessment of renal function could be conducted on 66 patients (98.5%) with complete data,while hepatic function could be done on 58 patients (86.6%).Conclusion The dosage of pirarubicin hydrochloride,clinical monitoring and other aspects of patients with breast cancer treated in our hospital need to be further standardized.
Pirarubicin hydrochloride;Cytotoxin;Clinical monitoring
2014-07-16
海宁市人民医院,浙江 海宁 314400
10.14053/j.cnki.ppcr.201502031
