替莫唑胺治疗多形性胶质母细胞瘤的化疗耐药机制
2015-06-01陈欢欢蔡炜嵩
陈欢欢,蔡炜嵩
·综述·
替莫唑胺治疗多形性胶质母细胞瘤的化疗耐药机制
陈欢欢,蔡炜嵩*
胶质瘤约占原发性颅内肿瘤的50%以上,多形性胶质母细胞瘤(GBM)为WHO Ⅳ级胶质瘤,复发率高,5年生存率不到10%。化疗是GBM综合治疗中的重要一环,而替莫唑胺作为多形性胶质母细胞瘤基石化疗药物在临床广泛应用,然而因其化疗耐药性的存在,严重影响了治疗效果的进一步提高。本文针对目前胶质瘤化疗药物的主要耐药机制:多药耐药、DNA损伤修复机制、凋亡通路异常、胶质瘤干细胞学说等几个方面,结合替莫唑胺药理机制进行分析、总结,希望对提高替莫唑胺在多形性胶质母细胞瘤中的疗效有一定启示。
多形性胶质母细胞瘤;替莫唑胺;化疗耐药
0 引言
胶质瘤(Glioma)是成年人最常见的颅内恶性肿瘤,其中多形性胶质母细胞瘤(Glioblastoma Multiforme,GBM)占胶质瘤的40%~50%,是人类生存预后最差的恶性肿瘤之一。临床上现普遍采取手术切除,术后替莫唑胺同步放化疗序贯替莫唑胺口服化疗为主要治疗手段。然而,即便经积极治疗后,GBM中位生存期平均仅为14.6个月,5年生存率不到10%[1]。除GBM恶行程度高、侵袭性生长及某些部位手术难度较大外,胶质瘤的放疗抵抗与化疗耐药也是肿瘤复发预后不良的重要原因。有研究表明,替莫唑胺(Temozolomide,TMZ)对恶性胶质瘤的有效率约45%[2],TMZ耐药是造成GBM化疗失败的主要原因之一。
1 替莫唑胺药理机制
TMZ是第二代咪唑并四嗪类烷化剂,广泛应用于恶性胶质瘤和黑色素瘤中。TMZ口服给药,易通过血脑屏障,生物利用度高。进入胶质瘤碱性组织中后,自动分解,其分解产物作用于肿瘤DNA,甲基化肿瘤DNA嘌呤残基—主要分为甲基化鸟嘌呤N7(70%)、O6(6%)以及腺嘌呤N3(9%)、O3,为N7-meG、O6-meG及N3-meA、O3-meA,使DNA在复制时出现碱基错配,最终致DNA双链断裂,干扰DNA合成,使肿瘤细胞G2/M期停止生长,诱导肿瘤细胞自噬或凋亡。其中,O6位点鸟嘌呤甲基化是TMZ发挥细胞毒性效应的主要途径[3]。其次,实验和部分临床Ⅰ/Ⅱ期研究表明,低剂量节拍式[4]TMZ给药方案能够诱导内源性血管生成抑素,抑制新生肿瘤血管,使肿瘤相关内皮细胞凋亡。此外,小剂量持续每天应用TMZ还具有放疗增敏作用,在恶性胶质瘤放射治疗中广泛应用[5]。
2 替莫唑胺治疗胶质瘤化疗耐药机制
既往对胶质瘤化疗耐药的主要研究涉及:多药耐药(Multidrug resistance,MDR)机制、DNA损伤修复机制、凋亡通路异常、胶质瘤干细胞学说等几个方面。
2.1 多药耐药机制 多药耐药机制包括P-糖蛋白(P-glycoprotein,P-gp,P-170)、多药耐药相关蛋白(Mutidrug resistance associated protein,MRP)、肺耐药相关蛋白(Lung resistance-related protein,LRP)、谷胱甘肽S转移酶(Glutathione s-transferase,GST)或GSH解毒系统、拓扑异构酶(Topoisomerase Ⅱ,topoⅡ)等,但与TMZ耐药的相关性尚不明确[6]。
2.2 DNA损伤修复机制及肿瘤细胞DNA异常修复 哺乳动物的DNA损伤修复机制包括:直接修复(Direct repair,DR)、DNA错配修复(Mismatch repair,MMR)、碱基切除修复(Base excision repair,BER)、核苷酸切除修复(Nucleotide excision repair,NER)、双链断裂修复(Double strand break repair,DSBR)[7]。六氧甲基鸟嘌呤DNA甲基转移酶(O6-methylguanine DNA methyltranferase,MGMT)普遍存在于细胞核与细胞质中,是机体内最重要的直接修复酶,可修复DNA烷基化,尤其是甲基化。当TMZ作用于肿瘤细胞,主要造成DNA鸟嘌呤第六位氧原子甲基化为O6-meG,MGMT可在DNA形成交连前将O6-meG上的甲基转移到自身蛋白第145位半胱氨酸残基上,使鸟嘌呤还原。而MGMT甲基化可以使其失去活性。因此既往理论认为恶性胶质瘤中MGMT的表达及甲基化状态是胶质瘤对TMZ耐药的主要原因[8],但结合国内外最近的多项研究成果,笔者认为对MGMT相关的TMZ耐药机制不能过高评估。有研究指出,胶质瘤细胞耐药主要与肿瘤细胞DNA异常修复有关,所以,对导致TMZ耐药的关键DNA损伤修复通路的寻找有重大意义。
2.2.1 ATM-Chk2和ATR-Chk1通路 ATM是共济失调-毛细血管扩张基因(Ataxia-telangiectasia-mutated kinase),ATR是共济失调-毛细血管扩张突变基因Rad3相关蛋白(Ataxia-telangiectasia-mutated Rad3-related kinase)。TMZ作用于GBM细胞,引起肿瘤细胞DNA损伤,若未被MGMT修复,被MMR识别,遂激活ATM-Chk2(Checkpoint 2 kinase)和ATR-Chk1(Checkpoint 1 kinase)通路,在MRE11-RAD50-NBS1(MRN)蛋白复合物 (MRN protein complex)、γ-H2AX蛋白以及MDC1蛋白的共同作用下,传导DNA损伤信号,激活细胞周期检测点,使细胞停滞于S-G2期,修复DNA损伤,若损伤无法修复,则诱导细胞凋亡。Cui等[9]研究发现,TMZ作用后,GBM细胞DNA存在异常修复:Cui等培养出胶质母细胞瘤耐药细胞系U251(OTR)与D54(OTR),并排除了高MGMT活性和MMR功能的不同是该细胞系对TMZ产生耐药的机制,之后发现存在DNA烷基化损伤与DNA链断裂的胶质母细胞瘤耐药细胞并未促发正在进行的DNA复制的抑制,揭露了这些细胞中存在抗甲基化DNA合成(Methylation-resistant DNA synthesis,MDS),细胞周期检测点缺失,且DNA损伤应答(DNA damage response,DDR)信号无法从ATM-Chk2通路传导。在耐药的胶质母细胞瘤中,γ-H2AX蛋白无法结合于DNA损伤位点,识别DNA损伤,从而导致TMZ耐药,GBM肿瘤细胞继续生长,不发生凋亡。
2.2.2 PI3K/Akt通路 恶性胶质瘤PTEN/PI3K/Akt/mTOR 和Ras/Raf/MEK/ERK 信号传导通路对基因表达和防止凋亡的调控发挥关键的作用。在人类癌症,尤其是胶质母细胞瘤里,这些通路的组成部分是突变的或异常表达的(例如: Ras、B-Raf、PI3K、PTEN 和Akt)。磷脂酰肌醇3激酶(Phosphatidylinositol 3-kinase,PI3K)和PKB蛋白激酶B(Akt)是突变过程的主要信号途径,而且在胶质瘤的发生、发展中起着重要作用[10]。研究表明,通过抑制PI3K/Akt信号通路关键因子PI3K能有效增强TMZ抗肿瘤的细胞毒性并降低耐药性[11]。
2.3 凋亡通路异常 由于大多数化疗药物发挥作用的机制是通过诱导肿瘤细胞凋亡或自噬而完成的,所以细胞凋亡的异常改变是肿瘤耐药的重要机制之一。相关研究涉及p53基因(p53 gene)、p53上调凋亡调控因子(p53 up-regulated modulator of apoptosis,PUMA)、Bcl-2 基因(Bcl-2 gene)[6,12]以及骨髓细胞瘤癌基因(Myelocytomatosis oncogene,c-myc)、抑癌基因PTEN等。其中尤以对p53的研究最为深入。p53基因有两种表型:野生型p53(wt-p53)与突变型p53(mt-p53)。wt-p53为抑癌基因;mt-p53不仅失去抑癌作用,而且可以使细胞凋亡信号丧失,使抗肿瘤药物疗效降低或丧失。30%~50%的胶质母细胞瘤中均发生突变。Blough等[13]研究表明,通过基因敲除或RNA干扰法使p53失活,结果MGMT表达下调,进而影响TMZ引起的耐药。Li等[14]研究表明,p53的功能状态是胶质瘤产生耐药的一个主要因素。
2.4 胶质瘤干细胞学说 胶质瘤干细胞(Glioma stem cells,GSC) 的研究始于2002年。GSCs高表达CD133、nestin、sOX-2,低表达GFAP和TUJ1。且具有自我更新、无限增殖(但GSC无稳定性,且不能正常调控)、多潜能分化的特性。在动物模型上,同位移植最小数量的GSC后,即能形成与原始肿瘤性质相似的肿瘤,且这一特性已作为鉴定肿瘤干细胞的金标准。GSCs还具有自发产生高水平促血管生成因子VEGF的能力,并诱导内皮细胞和内皮祖细胞增殖、迁移和管型形成作用。现研究已证明,肿瘤边缘富含GSC,在肿瘤侵袭前沿发挥促血管生成作用,进而为肿瘤侵袭转移提供物质支撑。GSC还呈高侵袭特性,虽然其运动能力很弱,却具有极强的浸润转移能力,导致手术难以根除。许多研究表明,GSCs相较于普通胶质瘤细胞而言有更强的耐药性[15]。Qiu等[16]研究发现,胶质瘤肝细胞中MGMT表达增强,与胶质瘤干细胞对替莫唑胺的耐药有关。胶质瘤干细胞与普通肿瘤细胞均可能存在MGMT的耐药机制,但在肿瘤干细胞中表现更强。也有研究者指出,与普通胶质瘤细胞不同,GSC中高表达三磷酸腺苷结合盒转运蛋白G2(ABCG2,系ABC超家族亚族G的第二个成员,具有ATP依赖性药物外排功能),是GSC对TMZ耐药的主要原因,与MGMT无关[17]。胶质瘤中也存在着一小群边缘(Side population,SP) 细胞,当胶质瘤经过TMZ治疗后,细胞数量增加,ABCG2表达增加,细胞的耐药性增强。Bleau等[18]研究认为,SP细胞是GSC 的1种细胞模型,在化疗耐药中起重要作用。而ABCG2可能是GSC发生耐药的根本原因,或许可以作为GSC的新标记。另外,大量的信号通路(例如RTK-Akt、Notch、BMPs、TGF-β、Hedgehog-Gli、Wnt-β-catenin、STAT3、GSK3-β)与GSC的稳定/维持相关,也与化疗耐药相关。经过替莫唑胺处理后,CD133+细胞的生存率高于CD133-细胞,相应的自溶相关蛋白(Atg5、LC3-ò和Beclin-1)水平明显降低,表明自溶蛋白的降低也可能是GSC耐药的一个因素。现有治疗肿瘤的方法主要是针对肿瘤组织内的大多数细胞,而不是肿瘤干细胞(Tumor stem cell,TSC)。GSC的存在从细胞层面更好地解释了胶质瘤耐药的生物学行为。MicroRNAs(miRNAs)为非编码RNAs,通过结合于mRNA导致mRNA降解或抑制其翻译来调节基因表达。miRNAs可通过调制相应的靶点影响肿瘤化疗耐药。Li等[19]的研究指出,miR-181b可以抑制GSC增殖,并且可以增加U87GSC对TMZ诱导的生长抑制的敏感性,减少GSCs中TMZ的化疗抵抗,但其作用机制尚不明确。有报道,miR-124 和miR-137 可诱导脑肿瘤干细胞分化。有研究显示,miR-125b 通过调节细胞周期蛋白CDK6 和CDC25A,是抑制人类U251胶质瘤干细胞增殖的关键[20],见表1。
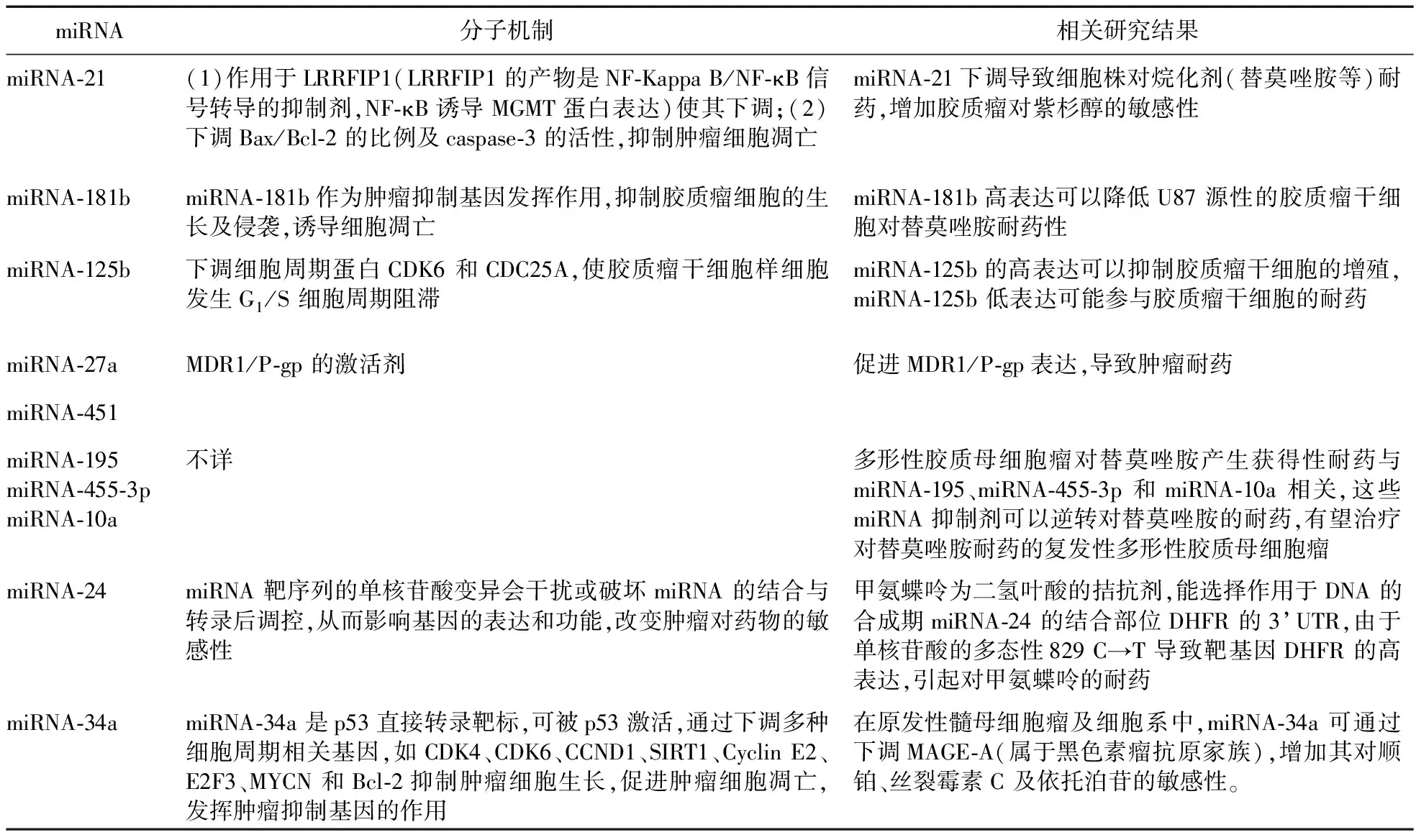
表1 miRNA与胶质瘤耐药总结
2.5 自噬在胶质瘤细胞化疗中的作用[21]自噬是降解受损或退化的细胞器和蛋白的动态的亚细胞过程,是对饥饿或感染等应激的一种细胞反应[22]。过度自噬导致的自噬性细胞死亡,又称Ⅱ型程序性细胞死亡,该过程不依赖caspase[23]。许多因素参与调节自噬:氧化应激、饥饿、放化疗,还有二氢青蒿素、GAIP、AGS3、氨基酸、激素、钙等。在肿瘤发展的早期阶段,自噬起肿瘤抑制作用,早期促自噬治疗可能抑制肿瘤形成;然而在肿瘤形成后,自噬作为一个对抗缺氧、缺少营养的应激条件的保护机制,在肿瘤组织内是上调的[24]。恶性胶质瘤的一个主要标志是对经典的依赖caspase的凋亡通路的高度耐药性。相比凋亡来说,胶质母细胞瘤的化疗更有可能通过自噬起作用。大量研究表明,增强胶质瘤细胞自噬作用,可增加胶质瘤对TMZ敏感性;但也有少数研究显示,抑制自噬可以增强化疗效果,因此,目前自噬在胶质母细胞瘤化疗中的确切作用还需进一步探索。
3 结语
为改善因胶质瘤对TMZ、烷化剂耐药而导致治疗效果不佳这一现状,既往针对克服有关耐药机制的方法,如联合应用烷化剂和MGMT抑制剂或开发不被MGMT修复的替莫唑胺类似物[25]、对于p53突变的患者应用嘧啶亚硝脲等药物和射线治疗[26]等,并未得到理想的效果。因此,笔者认为,对除了MGMT导致TMZ耐药关键的DNA损伤修复异常机制以及肿瘤干细胞在化疗耐药、肿瘤复发方面作用的研究值得重视。胶质瘤化疗耐药是多种因素共同作用的结果,是一个非常复杂的生物学过程。研究者应当更加深入地探索肿瘤细胞的耐药机制,研究相关解决方案,制定更为合理的临床治疗方案,以更有效地治疗GBM。
[1] Stupp R,Mason WP,Van den Bent MJ,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma[J].N Engl J Med,2005,352(10):987-996.
[2] Lashford LS,Thiesse P,Jouvet A,et al.Temozolomide in malignant gliomas childhood :a United Kingdom Children’s Cancer Study Group and French Society for Pediatric Oncology Intergroup Study [J].J Clin Oncol,2002,20(24):4684-4691.
[3] Omar AI,Mason WP.temozolomide: The evidence for its therapeutic efficacy in malignant astrocytomas [J].Core Evid,2010,4:93-111.
[4] Ma J,Waxman DJ.Modulation of the antitumor activity of metronomic cyclophosphamide by the angiogenesis inhibitor axitinib[J].Mol Cancer Ther,2008,7(1):79-89.
[5] 沈冬,杨群英,陈忠平.替莫唑胺在恶性胶质瘤化疗中的研究进展[J].中国神经肿瘤杂志,2010,8(4):271-276.
[6] 孙国臣,许百男,马晓东.脑胶质瘤化疗耐药机制的研究进展[J].临床军医杂志,2011,39(2):392-394.
[7] 刘晓玲,唐文如,罗瑛,等.DNA修复与肿瘤的耐药[J].生命的化学,2012,32(6):526-532.
[8] 宁显明,张继红,屠文莲,等.替莫唑胺耐药性研究进展.[J]中国新药与临床杂志,2013,32(4):251-256.
[9] Cui B,Johnson SP,Bullock N,et al.Decoupling of DNA damage response signaling from DNA damages underlies temozolomide resistance in glioblastoma cells[J].Journal of Biomedical Research,2010,24(6):424-435.
[10]王俊杰,王刚,杜士明,等.脑胶质瘤多药耐药与PI3K-Akt信号传导通路的关系及其治疗进展[J].癌症进展,2013,11(4):287-291,296.
[11]Chen L,Han L,Shi Z,et al.LY294002 enhances cytotoxicity of temozolomide in glioma by down-regulation of the PI3K/Akt pathway [J].Mol Med Report,2012,5(2):575-579.
[12]范益民,刘晓东,王宏勤.胶质瘤耐药机制的相关研究进展[J].中国医药科学,2011,1(15):9-11.
[13]Blough MD,Zlatescu MC,Cairncross JG.O6-methylguanine-DNA methyltransferase regulation by p53 in astrocytic cells[J].Cancer Res,2007,67(2):580-584.
[14]Li S,Jiang T,Li G,et al.Impact of p53 status to response of temozolomide in low MGMT expression glioblastomas: preliminary results[J].Neurol Res,2008,30(6):567-570.
[15]Tabatabai G,Weller M.Glioblastoma stem cells[J].Cell Tissue Res,2011,343(3):459-465.
[16]Qiu ZK,Shen D,Chen Ys,et al.Enhanced MGMT expression contributes to temozolomide resistance in glioma stem-like cells [J].Chin J Cancer,2013,33(2):115-122.
[17]Chamberlain MC,Bota DA,Linskey ME,et al.Neural stem/progenitors and glioma stem-like cells have differential sensitivity to chemotherapy[J].Neurology,2011,77(22):e135.
[18]Bleau AM,Huse JT,Holland EC.The ABCG2 resistance network of glioblastom[J].Cell Cycle,2009,8(18):2936-2944.
[19]Li P,Lu XM,Wang YY,et al.MiR-181b suppresses proliferation of and reduces chemoresistance to temozolomide in U87 glioma stem cells.[J]Journal of Biomedical Research,2010,24(6):436-443.
[20]Shi L,Zhang J,Pan T,et al.MiR-125b is critical for the suppression of human U251 glioma stem cell proliferation[J].Brain Res,2010,1312:120-126.
[21]周渊.王汉东.自噬在胶质母细胞瘤化疗中的作用[J].中国肿瘤外科杂志,2012,4(5):281-283.
[22]Voss V,Senft C,Lang V,et al.The pan-Bcl-2 inhibitor (-)-gossypol triggers autophagic cell death in malignant glioma[J].Mol Cancer Res,2010,8(7):1002-1016.
[23]Pirtoli L,Cevenini G,Tini P,et al.The prognostic role of Beclin 1 protein expression in high-grade gliomas[J].Autophagy,2009,5(7):930-936.
[24]Lefranc F,Facchini V,Kiss R.Proautophagic drugs: a novel means to combat apoptosis-resistant cancers,with a special emphasis on glioblastomast[J].Oncologis,2007,12(12):1395-1403.
[25]Zhang J,Stevens MFG,Hummersone M,et al.Certain imidazotetrazines escape O6-methylguanine-DNA methyltran sferase and mismatch repair [J].Oncology,2011,80(3-4):195-207.
[26]梁武,陈治军,罗勇,等.野生型p53 基因可以增强胶质瘤细胞对替莫唑胺的敏感性研究.[J]中华临床医师杂志,2011,5(13):3924-3926.
Mechanism of chemotherapy resistance of temozolomide in glioblastoma multiforme
CHEN Huan-huan,CAI Wei-song*
(Department of Medical Oncology,Shengjing Hospital of China Medical University,Shenyang 110022,China)
Gliomas accounts for more than 50% of primary intracranial tumors.Glioblastoma multiforme (GBM),as a WHO grade Ⅳ glioma,has high recurrence rate with low 5 years survival rate(<10%).Chemotherapy is a pivotal part of multimodality therapy for GBM.Temozolomide is the most commonly administrated footstone chemotherapy drug in glioblastoma multiforme,but the chemotherapy resistance limits the improvement of the therapeutic effect for GBM.This paper aims at the main mechanisms of drug resistance of GBM chemotherapy drugs: multidrug resistance,DNA damage repair mechanism,apoptosis pathway abnormalities,glioma stem cell theory,and so on,combines with temozolomide pharmacological mechanism and the mechanisms of drug resistance to analyze and summarize,to improve the efficacy of temozolomide in glioblastoma multiforme treatment.
Glioblastoma multiforme;Temozolomide;Chemotherapy resistance
2014-04-24
中国医科大学附属盛京医院肿瘤科,沈阳 110022
国家自然科学基金资助项目(81172410)
10.14053/j.cnki.ppcr.201502027
*通信作者
