超声靶向微泡破坏增强人-防御素3抑制小鼠体内耐药葡萄球菌生物膜形成*
2015-06-01朱晨方诗元孔荣禹德万黄炎夏睿徐玮王英明马锐祥刘应生李雷李多玉
朱晨 方诗元*孔荣禹德万黄炎夏睿徐玮王英明马锐祥刘应生李雷李多玉
朱晨 方诗元*孔荣禹德万黄炎夏睿徐玮王英明马锐祥刘应生李雷李多玉
目的探讨内源性抗菌肽人 -防御素-3(HBD-3)联合低频超声(US)及造影剂微泡(MB)的靶向破坏(UTMD)在体内抑制耐药葡萄球菌生物膜形成的作用。方法钛片与2种耐药葡萄球菌共培养24小时待生物膜形成后,放置于小鼠后背部脊柱皮下的两侧;再通过液体微量稀释法,获取HBD-3对2种耐药菌的最小抑菌浓度(MIC)。48只小鼠按不同的处理条件随机分为6组:(a)0 g/mLHBD-3;(b)超声处理组;(c)微泡+超声处理组;(d)10 MIC HBD-3;(e)10 MIC HBD-3+超声处理组;(f)10 MIC HBD-3+超声+微泡处理组。术后3天,处死各组小鼠取出钛片。涂板计数、激光共聚焦显微镜及电子显微镜观察不同实验处理条件下,钛片生物膜的厚度及膜内的剩余活菌量。Realtime PCR定量分析相关成膜基因及耐药基因,并进行统计学分析。结果与其它治疗组相比,体内最高浓度的HBD-3联合UTMD组的活细菌数百分比明显下降。同时,超声微泡还能显著提高HBD-3抑制成膜相关基因icaAD以及耐甲氧西林基因MecA的表达并同时促进icaR的表达。结论UTMD可能有很大的潜力,提高HBD-3的抗菌活性并抑制小鼠体内的生物膜感染。
超声;微泡;葡萄球菌;生物膜; -防御素
做为条件致病菌,葡萄球菌已经成为院内感染以及骨科内植物感染的主要致病菌[1]。大多数葡萄球菌的感染常合并生物膜形成,而生物膜内的细菌对传统的抗菌药物高度耐药。研究表明,US能显著提高抗生素对浮游菌和生物膜内细菌的杀灭作用[2]。MB造影剂能提供空化效应并降低空化阈值,可以做为一种靶向药物制剂[3]。UTMD通过提高细菌细胞膜的渗透性和代谢活性,增加氧气和其他营养物质的传输,进而提高抗生素对细菌的运输率,以增加抗生素的效果[3]。HBD-3是一种主要由人上皮细胞、成骨细胞或汗腺分泌的内源性抗菌肽,具有广谱和较稳定的抗菌活性,对耐甲氧西林的金黄色葡萄球菌(Methicillin-resistant strains of Staphylococcusaureus,MRSA)甚至耐万古霉素的粪肠球菌都有很强的抑制作用[4]。笔者以前的研究已表明,HBD-3或HBD-3联合超声靶向微泡破坏对耐甲氧西林表皮葡萄球菌(Methicillin-resistant strains of Staphylococcus epidermidis, MRSE)和 MRSA在钛片表面形成生物膜有明显抑制作用[5,6]。然而,体内联合UTMD是否可以进一步提高HBD-3对MRSA和MRSE已形成的生物膜具有抗菌效果,仍然未知。因此,本研究中笔者对UTMD联合HBD-3,抑制在小鼠体内植入物表面MRSA和MRSE生物膜的形成进行相关研究。
1 材料和方法
1.1 菌株鉴定与HBD-3的抗菌活性
表皮葡萄球菌(ATCC35984)和金黄色葡萄球菌(ATCC 43300)购买于美国标准细菌细胞培养库。使用VITEK2自动化鉴定系统(BioMérieux,Marcy)进行菌种的鉴定和药敏试验。耐甲氧西林菌株的决定基因(A)证实2种菌株是否为MRSE或MRSA[7]。使用微孔板法(MTP)检测形成生物膜的能力[8]。HBD-3(Sigma)以冻干粉的形式储存,稀释溶解于0.1%乙酸,并制备成1mg/mL的原液储存。HBD-3的最低抑菌浓度(Minimuminhibitoryconcentration,MIC)由液体微量稀释法进行测定[9]。
1.2 超声微泡的制备与生物膜处理
超声源为US-100超声理疗康复治疗仪(日本伊藤株式会社),其探头为直径30 mm的超声波换能器,占空比5%~100%,声强为100 mW/cm2~3W/cm2,频率0.8MHZ。微泡造影剂声诺维(Bracco)溶解在5 mL生理盐水中,浓度为2×108~5×108MBs/mL。MBS的直径为1~8 m(平均2.5 m),外层由磷脂组成,内部封装六氟化硫气体[10]。过夜孵育的细菌稀释1:1000,50L的2种细菌悬液(细菌数约106)被添加到含钛片和0.2%(w/v)葡萄糖的0.5×BBL胰蛋白酶大豆肉汤(TSBG,BDBiosciences)中[11]。接种前,钛板(厚1 mm,直径10 mm)进行灭菌,钛片与细菌共培养24小时形成生物膜。
1.3 动物分组及涂平板计数法
BALB/c雄性小鼠,近交系,年龄为8~12周,48只小鼠随机分为6组。腹腔注射麻醉,无菌条件下后背部皮肤切开,长度约10mm,钛片表面生物膜形成后,放置于后背部皮下的两侧。分组:(a)0 g/mL HBD-3(未处理对照组);(b)超声处理组;(c)微泡+超声处理组;(d)10MICHBD-3;(e)10 MIC HBD-3+超声处理组和(f)10 MIC HBD-3+超声+微泡处理组。HBD-3对2种不同菌株的MIC为:ATCC 35984(4 g/mL)和ATCC43300(8 g/mL)。10 MICHBD-3 /100lPBS皮下钛片周围注射,每天3次。HBD-3皮下注射后,立即局部应用超声靶向微泡或超声20分钟,每天3次。30 L的MB皮下注射到钛片周围,超声波频率为0.08 MHz、声强为200mW/cm2、50%的占空比[3]。术后3天,6组不同的实验条件处理后12小时,处死各组小鼠取出钛片。从眼眶后静脉窦抽取血液样本(2mL),进行血培养;同时,血标本倍比稀释到BBL胰酪胨大豆琼脂(TSA;BDBiosciences)表面进行涂板,用于明确细菌从钛片表面逃逸进入血液中的浮游活菌数;同时,实验中钛板表面的菌落形成单位(CFUs)的数量被用来确定在生物膜内的剩余活菌。钛片放入已消毒的含有0.5mL0.5×TSB的无菌试管中,通过超声水浴震荡收集细菌。然后进行倍比稀释至TSA涂板,24小时后计数分析,结果为细菌数/钛片材料表面积(CFU/mm2)[12]。
1.4激光共聚焦显微镜(Confocal laser scanning microscopy, CLSM)及扫描电子显微镜(Scanning electron microscopes, SEM)观察
实验处理条件同上述涂平板计数法。取出小鼠体内的覆盖生物膜的钛片进行荧光染色。Live/Dead试剂盒含有两种荧光染液,荧光染液 SYTO能使活细菌发出绿色荧光,PI可使死亡细菌发出红色荧光。CLSM(LeicaTCS)下观察材料表面生物膜的形态结构及细菌活力。死活细胞可以在荧光显微镜下被区分,活菌因完整的细胞膜呈现绿色荧光,而死菌因损坏的细胞膜而出现红色荧光[13]。取出小鼠体内覆盖生物膜的钛片用2.5%戊二醛溶液固定,梯度酒精脱水,临界点干燥并喷金。最后在SEM(JEOL JSM-6360LV)下观察并拍照[13]。
1.5 Realtime定量分析
ATCC35984进行成膜基因 AD及 R的表达分析。ATCC43300被选定为耐药基因A的表达分析。实验条件同上述涂平板计数实验方法。取出小鼠体内的钛片后,将上述各组钛片表面的细菌生物膜使用超声及无菌刮子收集,溶解于细菌RNA保护液(Qiagen)中,以保护细菌RNA的完整性(1.5 mL离心管)。然后离心管在4℃,8000g条件下离心8分钟;弃去保护液,100 g/mL溶葡球菌酶(Sigma)的缓冲液200 L溶解菌珠。RNeasyminikit试剂盒(Qiagen)提取总RNA进行纯度测定。使用Fermentas RevertAid First Strand cDNA Synthesis Kit试剂盒将提取的RNA反转录为cDNA。最后,根据Roche FastStart Universal SYBR Green Master(Rox)试剂盒操作说明,在ABI7500RealTimePCR(AppliedBiosystems)反应仪上进行PCR操作,所用基因引物序列由上海生工生物合成。PCR扩增条件:50°C,20秒1个循环;95°C,15秒,60°C,1分钟,40个循环,最后95°C,10分钟。16S rRNA为内参基因,以每个样品的CT值为基础,每个样品平均重复3次进行测定[13]。
1.6 统计分析
2 结果
2.1 评估抑菌活性
ATCC35984及ATCC43300的MTP值分别为(0.962± 0.18)及(0.445±0.12),均大于0.240,且 A及A表达阳性,表明实验菌株为可形成生物膜的耐药菌[8]。小鼠体内钛片表面每mm2ATCC35984和ATCC43300的计数在超声处理组、超声+微泡处理组和10 MIC HBD-3组,2个菌株钛片表面的细菌数与对照组相比无显著差异(>0.05)。10 MIC HBD-3+超声处理组和10 MIC HBD-3+超声+微泡处理组,2个菌株钛片表面的细菌数明显低于对照组(<0.05)。10 MICHBD-3+超声+微泡处理组有最低的细菌量(<0.05)。尽管钛片表面大量的细菌生长,但6个实验组所有的血培养涂板计数均未见细菌生长。
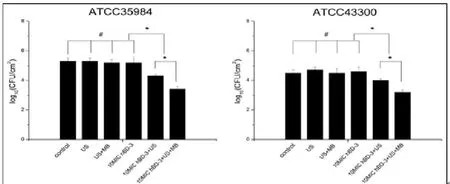
图1 各实验组之间生物膜内复苏的活菌数量比较。数据表示为(±s)。*显示2组间统计学显著性差异,<0.05;#表示的无显著差异,>0.05
2.2 CLSM和SEM观测
CLSM观察发现,在对照组中、超声处理组和超声+微泡处理组,可以观察到高密度聚集的生物膜(图2、图3彩图见插页)。超声+微泡处理组的生物膜表现出比超声处理组和对照组更大的微孔。3个处理组包括10MICHBD-3,超声处理组和超声+微泡处理组,绿色荧光在钛片表面明显聚集形成。此外,HBD-3+超声+微泡处理组比相同浓度HBD-3处理组或 HBD-3+超声处理组生物膜内检测到更少的活菌。应用SEM进一步观察发现,以下3种条件下,即超声处理组,超声+微泡处理组和10 MIC HBD-3处理组,2株细菌钛片表面仍聚集多个小菌落。相反,当HBD-3联合超声或超声+微泡进行处理时,仅见一些小的、单菌落在钛片表面生长。此外,在2种不同菌株的钛片表面10 MIC HBD-3+超声+微泡处理组比相同浓度的 HBD-3+超声处理组有更少的菌落残留(图4、图5)。
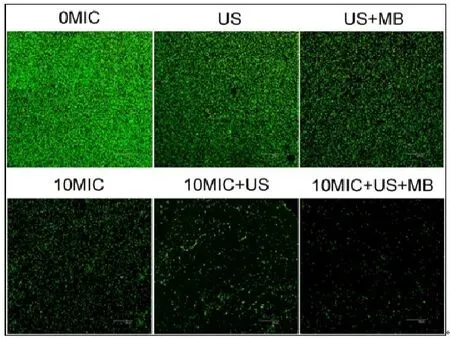
图2 CLSM观察 US联合 MB在体内增强 HBD-3抑制钛片表面ATCC35984生物膜形成(400×)
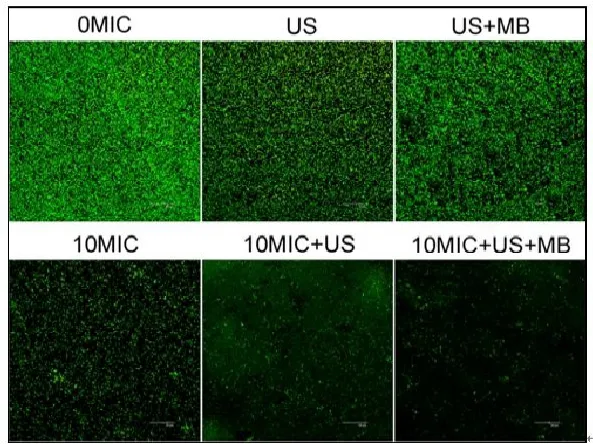
图3 CLSM观察 US联合 MB在体内增强 HBD-3抑制钛片表面ATCC43300生物膜形成(400×)
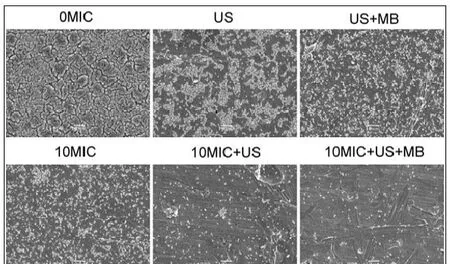
图4 SEM观察US联合MB在体内增强HBD-3抑制钛片表面ATCC 35984生物膜形成(1000×)
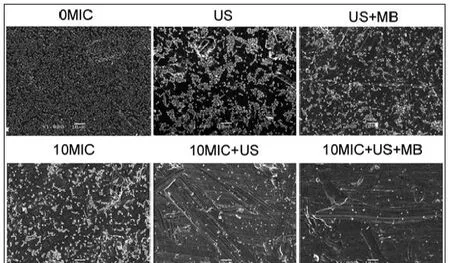
图5 SEM观察US联合MB在体内增强HBD-3抑制钛片表面ATCC 43300生物膜形成(1000×)
ATCC35984生物膜形成过程中, AD和 R基因表达水平是如图6所示(彩图见插页)。 A和 D的表达水平在10MIC HBD-3联合超声或超声+微泡处理组,与对照组、超声处理组,超声+微泡处理组和HBD-3单独处理组相比显著降低(<0.05)。 R表达水平在10 MIC HBD-3联合超声或超声+微泡处理组则明显上调(<0.05)。ATCC43300中A基因的表达水平在10 MIC HBD-3联合超声或超声+微泡处理组,与对照组、超声处理组、超声+微泡处理组和 HBD-3单独处理组相比,显著降低(<0.05)。此外,10MIC HBD-3联合超声+微泡处理组与10 MIC HBD-3+超声处理组相比, AD和A的表达水平明显降低,而R基因的表达明显升高(<0.05)。
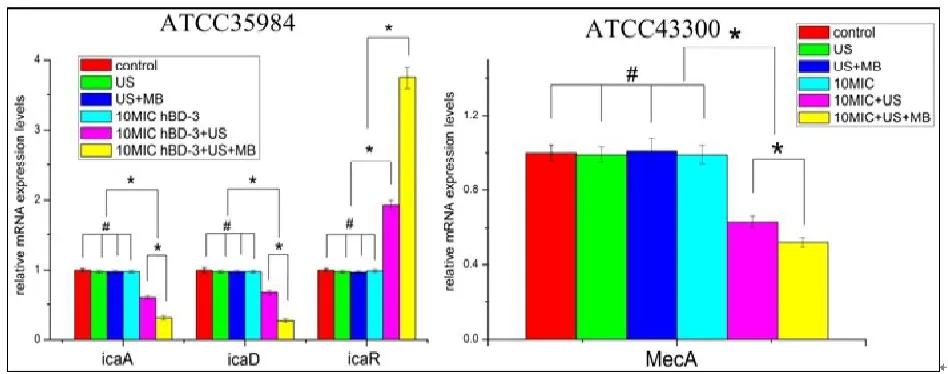
图6 Ica和MecA基因转录实时定量PCR分析。结果表示为 ±s。*显示两组间统计学有显著性差异,<0.05;#表示无显著差异,>0.05
3 讨论
细菌生物膜的形成首先是细菌在宿主组织或内植物表面粘附,其次是在粘附基础上细菌增殖聚集形成生物膜。生物膜形成与基因位点 ADBCR调控的胞间多糖黏附素密切相关,其中 A和 D的共表达是生物膜形成必需的[8]。此外, ADBC操纵子的表达受其上游抑制基因icaR的负调控[14]。本研究表明,10MIC HBD-3联合超声微泡处理组显著下调钛片表面生物膜内 AD表达并上调 R的表达。这种抑制 AD转录导致PIA产生的下调,从而降低了生物膜的形成。MRSA是甲氧西林敏感的金葡菌(MSSA)外源性获得SCCmec而产生,它不仅存在于金葡菌中,也存在于其它凝固酶阳性和凝固酶阴性葡萄球菌中[7]。MecA基因编码 PBP2,其可降低 -内酰胺类抗生素对致病菌的抗菌活性,是MRSA及MRSE产生耐药的机制之一[15]。研究表明,10MIC HBD-3联合超声微泡处理组可以明显下调生物膜内MecA基因的表达,这可能会增加MRSA和MRSE对苯唑西林敏感性。
超声增加 HBD-3的抗菌作用机制较为复杂。一方面,超声作为一种机械压力波,可在机体内产生高压及高剪切力,增强细胞间的微对流,增加细胞膜的通透性,促进HBD-3通过生物膜[16]。另一方面,增高辐照区域局部温度,并在组织内产生自由基,可能促进细菌细胞膜的通透性[17]。本研究发现,应用超声联合靶向微泡破坏处理后,生物膜上出现的微孔较单纯应用超声者显著增大,这大大提高了HBD-3在膜内和胞内运输,或许是因为微泡大大增强了超声的空化作用,有效降低了空化需要的阈值能量[3]。此外,多种因素影响超声微泡增强HBD-3抑制生物膜内的细菌。首先,超声的参数,包括声学强度、频率、占空比和持续时间[18]。相关研究表明,低频超声(<500KHZ)具有优良的杀菌作用,对生物膜比高频超声联合抗生素具有更好的抑菌效果。因为它衰减低、不产生热量、非侵入性且不易引起损伤[19]。第二,生物膜的成熟度也会影响抗菌作用。抗生素穿透生物膜的能力随生物膜成熟度的增加而明显下降。本实验中,超声微泡结合HBD-3明显抑制已孵育24小时的MRSE和MRSA生物膜。因此,本研究对今后的临床应用有可行性意义。最后,超声微泡介导对细菌生物膜的抗菌活性不仅与超声参数条件有关,而且对HBD-3的浓度也有很高的要求[20]。因为HBD-3在体内会逐渐降解,高浓度HBD-3是联合超声微泡抑制体内生物膜形成的必要条件。因此,在体内优化超声微泡的参数条件并联合有效浓度的 HBD-3是治疗 MRSA和MRSE生物膜感染的基本条件。
本研究结果提供了令人鼓舞的证据,即超声微泡可以提高HBD-3对抗生素耐药菌生物膜形成的抗菌活性,并提供了一种对耐抗生素生物膜感染的非侵入性的和有针对性的方法。
[1] Montanaro L,Speziale P,Campoccia D,et al.Scenery of Staphylococcus implant infections in orthopedics[J].Future Microbiol, 2011,6:1329-1349.
[2] PatelZM,HwangPH,ChernomorskyA,etal.Low-frequencypulsed ultrasound in the nasal cavity and paranasal sinuses:a feasibility and distribution study[J].Int Forum Allergy Rhinol,2012,2:303-308.
[3] He N,Hu J,Liu H,et al.Enhancement of vancomycin activity against biofilms by using ultrasound-targeted microbubble destruction[J].Antimicrob Agents Chemother,2011,55:5331-5337.
[4] Harder J,Bartels J,Christophers E,et al.Isolation and characterization of human beta-defensin-3,a novel human inducible peptide antibiotic[J].J Biol Chem,2001,276:5707-5713.
[5] Zhu C,Tan H,Cheng T,et al.Human -defensin 3 inhibits antibiotic-resistant Staphylococcus biofilm formation[J].J Surg Res, 2012,183:204-213.
[6] Zhu C,He N,Cheng T,et al.Ultrasound-targeted microbubble destruction enhances human -defensin 3 activity against antibioticresistant staphylococcus biofilms[J].Inflammation,2013,36:983-996.
[7] Nihonyanagi S,Kanoh Y,Okada K,et al.Clinical usefulness of multiplex PCRlateral flowinMRSA detection:a novel,rapid genetic testing method[J].Inflammation,2012,35:927-934.
[8] Arciola CR,Campoccia D,Baldassarri L,et al.Detection of biofilm formation in Staphylococcus epidermidis from implant infections: Comparison of a PCR method that recognizes the presence of ica genes with two classic phenotypic methods[J].J Biomed MaterRes A,2006,76:425-430.
[9] Maisetta G,Batoni G,Esin S,et al.In vitro bactericidal activity of human beta-defensin 3 against multidrug-resistant nosocomial strains[J].Antimicrob Agents Chemother,2006,50:806-809.
[10]Quaia E,Calliada F,Bertolotto M,et al.Characterization of focal liver lesions with contrast-specific US modes and a sulfur hexafluoride-filled microbubble contrast agent:Diagnostic performance and confidence[J].Radiology,2004,232:420-430.
[11]van der Plas MJ,Jukema GN,Wai SW,et al.Maggot excretions/ secretions are differentially effective against biofilms of Staphylococcus aureus and Pseudomonas aeruginosa[J].J Antimicrob Chemother,2008,61:117-122.
[12]Bjerkan G,Wits E,Bergh K.Sonication is superior to scraping for retrieval of bacteria in biofilm on titanium and steel surfaces in vitro[J].Acta Orthop,2009,80:245-250.
[13]Tan H,Peng Z,Li Q,et al.The use of quaternised chitosan-loaded PMMA to inhibit biofilm formation and downregulate the virulence-associated gene expression of antibiotic-resistant staphylococcus[J].Biomaterials,2012,33:365-377.
[14]Rohde H,Frankenberger SU,et al.Structure,function and contribution of polysaccharide intercellular adhesin(PIA)to Staphylococcus epidermidis biofilm formation and pathogenesis of biomaterial-associated infections[J].Eur J Cell Biol,2011,89: 103-111.
[15]Katayama Y,Ito T,Hiramatsu K.A new class of genetic element, staphylococcus cassette chromosome mec,encodes methicillin resistance in Staphylococcus aureus[J].Antimicrob Agents Chemother,2000,44:1549-1555.
[16]Runyan CM,Carmen JC,Beckstead BL,et al.Low-frequency ultrasound increases outer membrane permeability of Pseudomonas aeruginosa[J].J Gen Appl Microbiol,2006,52:295-301.
[17]Juffermans LJ,Dijkmans PA,Musters RJ,et al.Transient permeabilization of cell membranes by ultrasound-exposed microbubbles is related to formation of hydrogen peroxide[J].Am J Physiol Heart Circ Physiol,2006,291:1595-1601.
[18]Nishikawa T,Yoshida A,Khanal A,et al.A study of the efficacy of ultrasonic waves in removing biofilms[J].Gerodontology,2010, 27:199-206.
[19]Xu J,Bigelow TA,Halverson LJ,et al.Minimization of treatment time for in vitro 1.1 MHz destruction of Pseudomonas aeruginosa biofilms by high-intensity focused ultrasound[J].Ultrasonics, 2012,52:668-675.
[20]Yu H,Chen S,Cao P.Synergistic bactericidal effects and mechanisms of low intensity ultrasound and antibiotics against bacteria: a review[J].Ultrason Sonochem,2012,19:377-382.
Enhancement of human -defensin 3 activity against antibiotic-resistant staphylococcus biofilms in mice model by ultrasound-targeted microbubble destruction
Objectives To investigate the effect of Human -defensin-3(HBD-3),an endogenous antimicrobial peptide, combined withultrasound(US)-targeted microbubble(MB)destruction(UTMD)onantibiotic-resistantStaphylococcus biofilms invivo.Methods Two biofilm-infectedtitaniumplateswereimplantedsubcutaneously bilateraltothespine.Biofilms of the 2 antibiotic-resistant Staphylococcus strains from the plates in mice were treated under 6 different conditions: (a)untreated control,(b)USonly,(c)US+MB,(d)10MICHBD-3,(e)10 MICHBD-3+USand(f)10MIC HBD-3+ US+MB.At 3 days after the surgery,the six treatments were completed,the mice were euthanized and the implants were takenout.Theamountofbacteriain the biofilms wereobservedbythe spread plate method,confocal laser scanning microscopy and scanning electron microscopes under different experiment conditions.Biofilm-associated and drug-resistant genes were quantitatively analyzed by real-time polymerase chain reaction, then statistical analysis was carried out.ResultsInthestudy,we demonstratedthatthepercentageoflivecells,andtheviablecounts of 2testedStaphylococcus recovered from the biofilms on the titanium surface in vivo were significantly decreased in the highest concentrations of HBD-3combinedwithUTMDcomparedwiththoseof anyother groups.Moremore,wefound thatUTMDcould enhance HBD-3 activity inhibiting the biofilm-associated genes expression of icaAD and the methicillin-resistance genes expressionofMecAbysimultaneously promoting the genesexpressionof icaR.ConclusionUTMDmayhavegreat potential for improving HBD-3 antibiotic activity against Staphylococcus biofilms infections in vivo.
Ultrasound;Microbubbles;Staphylococcus;Biofilm; -defensin
R378.1;R392.11
A
10.3969/j.issn.1672-5972.2015.05.003
swgk2015-06-00115

朱晨(1979-)男,博士,副主任医师。研究方向:关节、关节镜、创伤外科。
*[通讯作者]方诗元(1964-)男,硕士,主任医师,教授。研究方向:创伤、脊柱外科。
2015-06-06)
国家自然科学基金(No:81401815,81301571,81271594)
安徽医科大学附属省立医院骨一科,安徽合肥230001
