SCGN和CgA在胰腺神经内分泌肿瘤的表达*
2015-06-01李丹丹庞妩燕
薛 磊,李丹丹,庞妩燕
(河南大学淮河医院内分泌科,河南开封 475000)
论著·临床研究
SCGN和CgA在胰腺神经内分泌肿瘤的表达*
薛 磊,李丹丹,庞妩燕
(河南大学淮河医院内分泌科,河南开封 475000)
目的 考察促泌素(SCGN)和嗜铬粒蛋白A(CgA)在胰腺神经内分泌肿瘤的表达。方法 选择2007年10月至2013年10月到该院住院治疗并行手术的胰腺神经内分泌肿瘤(PNETs)患者共54例,采用免疫组织化学法检测肿瘤标本中SCGN、CgA的表达情况。结果 54例胰腺神经内分泌肿瘤标本均有SCGN和CgA表达。在非功能性PNETs、肿瘤体积大于30 cm3、有包膜、侵犯血管和淋巴结转移中,SCGN较CgA高(P<0.05)。在功能性PNETs、不同肿瘤部位、肿瘤体积小于或等于30 cm3、无包膜、无侵犯血管和淋巴结转移中SCGN和CgA表达差异无统计学意义(P>0.05)。结论 将PNETs形态学改变,肿瘤侵犯包膜、血管,局部组织浸润,淋巴结及脏器转移等病理参数,结合SCGN与CgA在肿瘤组织的表达可综合评估PNETs的恶性程度。
促泌素;嗜铬粒蛋白质A;胰腺神经内分泌肿瘤
胰腺神经内分泌肿瘤(panereatic neuroendoerine tumours,PNETs)是少见肿瘤,发病率为1/10万,约占胰腺肿瘤的4%。PNETs源于胃肠胰腺神经内分泌系统中的多能神经内分泌干细胞,主要分布在胃肠道黏膜和胰腺组织中的胰岛,手术切除是PNETs惟一根治性的手段,但预后差异较大[1],预后与PNETs的良恶性有关,对于PNETs良恶性的判断很难简单通过组织病理模式而明确。目前,对于敏感性和特异性供区分PNETs的良恶性指标仍然没有共识,本课题拟考察促泌素(secretagogin,SCGN)和嗜铬粒蛋白A(chromogranin A,CgA)在胰腺神经内分泌肿瘤的表达,以及表达与PNETs性质的关联。
1 资料与方法
1.1 一般资料 选择2007年10月至2013年10月,因消化道不适或神经系统障碍到本院入院治疗并行手术的PNETs患者共54例,经病理证实PNETs。其中男37例,女17例,年龄35~55岁,平均(45.4±10.4)岁,病程2~8年。功能性PNETs 21例,包括胰岛素瘤 17 例,血管活性肠肽瘤 2 例,低度恶性类癌2例;非功能性PNETs 33 例,其中胰岛细胞瘤10例,低度恶性神经内分泌肿瘤14 例,低中度恶性神经内分泌癌 5例,胰腺大细胞神经内分泌癌 4 例。54例PNETs接受手术后,51例术后无明显并发症,一般情况稳定,3例多部位转移,手术后1月出现多器官功能衰竭死亡。
1.2 方法
1.2.1 检测方法 采用免疫组织化学PV-9000二步法检测54例胰腺神经内分泌肿瘤标本中SCGN和CgA的表达情况。
1.2.2 结果判断 SCGN和CgA均以肿瘤细胞胞质出现棕黄色颗粒为阳性。两人双盲法分别观察切片,选择10个具有代表性的高倍视野(×400),评分后取平均值,若两人观察结果相差3分则重新评定。阳性细胞百分比评分:0分,无阳性细胞;1分,阳性细胞比例1%~10%;2分,阳性细胞比例11%~50%;3分,阳性细胞比例51%~80%;4分,阳性细胞比例81%~100%。阳性细胞染色强度评分:0分,阴性;1分,弱阳性;2分,中度阳性;3分,强阳性。SCGN和CgA的免疫组化检测评分=阳性细胞百分比评分-阳性细胞染色强度评分。
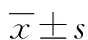
2 结果
54例胰腺神经内分泌肿瘤标本均有SCGN和CgA表达。与CgA比,SCGN在非功能性PNETs、肿瘤体积大于30 cm3、有包膜、侵犯血管和淋巴结转移中的表达较高(P<0.05)。在功能性PNETs、不同肿瘤部位、肿瘤体积小于或等于30 cm3、无包膜、无侵犯血管和淋巴结转移中SCGN和CgA表达差异无统计学意义(P>0.05),见表1。

表1 病理结果与SCGN、CgA的表达关系
3 讨论
3.1 PNETs的简介与治疗 PNETs是一种少见病,10万人中1~2人发病,可发生在任何年龄,但儿童病患少见,近年来发病率有上升趋势。PNETs高发年龄50~70岁,男性比女性发病率高,也有报道男女发病率相当。临床根据有无特征性的内分泌紊乱症状将PNETs划分为功能性和无功能性两类。其中功能性PNETs按起源细胞分为胰岛素瘤、血管活性肠肽瘤、胃泌素瘤、胰高血糖素瘤和生长抑素瘤,胰岛素瘤的发病率最高。功能性PNETs较早表现出临床症状,早期可及时手术治疗,多数病例手术治疗效果较好。但大多数无功能性PNETs临床较少出现典型内分泌症状,只有肿瘤长至一定大小,出现上腹部疼痛、梗阻性黄疸症状时才就诊。不论功能性或无功能性PNETs,手术治疗是的惟一手段,但除了胰岛素瘤,其他类型PNETs手术预后不佳,且仅有15%的病患可以完全手术切除,5年生存率仅为40%,化疗放疗、介入和分子靶向药物治疗的反应率不到50%,除此,患者还需要忍受诸多不良反应,预后效果与PNETs恶性程度密切相关[2]。
3.2 PNETs的恶性程度诊断 长期以来,临床对PNETs恶性程度的判断尚缺乏统一标准[3]。业内大致存在4种观点:(1)全面病理型,恶性PNETs特点在于体积大、局部浸润、侵犯血管、侵犯神经周围淋巴间隙、瘤细胞异型性与核分裂[4];(2)侵犯转移型,仅当出现脏器或淋巴结转移、侵犯血管则是诊断PNETs恶性的可靠依据[5-6];(3)非功能性PNETs型,因非功能性PNETs大多为恶性,即使未浸润血管或神经周围淋巴结,也不能排除潜在恶性行为,对于该观点,有学者认为将非功能性PNETs一致归为恶性有扩大恶性范围的嫌疑,致使部分非功能性PNETs病例存在“过度”治疗嫌疑,造成医疗资源的浪费和病患生活质量的降低,因为功能性与非功能性PNETs在形态学没有显著差异,两者在病理大小和包膜参数差异较小,非功能性PNETs中10%~40%为良性[7];(4)肿瘤大尺寸型,除肿瘤直径小于0.5 cm以外,其余PNETs的生物行为均存在恶性潜能。结合诸多学者的观点,根据本课题研究结果,作者认为将病理形态学改变,肿瘤侵犯包膜、血管,局部组织浸润,淋巴结及脏器转移等参数,结合SCGN与CgA的免疫组化结果,作为综合评估PNETs恶性的标准。
3.3 CgA和SCGN与PNETs CgA是兼有酸性与亲水性的分泌蛋白,属神经肽家族,广泛分布在神经内分泌组织和各种神经内分泌肿瘤中,不存在非神经内分泌细胞,因此CgA诊断PNETs的特异性较高,可高达95%[8-9],CgA已作为“通用”肿瘤标志物[10]。SCGN是一种新型的神经内分泌相关蛋白,由Wagner等[11]从人胰腺cDNA文库筛选的新基因并成功克隆,定位于染色体6p22.3~p22.1,转录翻译形成含276个氨基酸的六聚体左旋蛋白,由钙感受器和钙缓冲器两部分组成的钙结合蛋白。SCGN在胰腺、垂体和大肠均有表达,定位于细胞质[12]。体外实验显示转染SCGN的胰岛素瘤细胞,细胞生长速度明显减慢,提示SCGN蛋白具有控制细胞生长和分化的作用[13]。另外,与SCGN蛋白属同一家族的S100A4和S100A8等S100家族成员表达升高与肿瘤的分化和预后密切相关。SCGN水平变化与肿瘤的发生紧密相关,在肿瘤的作用机制存在以下几种可能[14-15]:(1) SCGN通过鳌合Ca2+,调节和控制增殖与分化,进而抑制细胞增殖;(2)SCGN过表达可间接控制细胞生长P物质,P物质是细胞自分泌的生长因子、分化和营养因子,表达于胰岛β细胞系和快速增殖的新生胰岛细胞,P物质下调可抑制细胞的生长和成熟;(3) SCGN可诱导细胞向神经内分泌细胞分化。
SCGN阳性细胞为“开放型”的内分泌细胞,CgA阳性细胞为 “封闭型”的内分泌细胞,CgA在某些分化差的神经内分泌肿瘤表达较弱时,SCGN在神经内分泌肿瘤可呈持续阳性表达,且SCGN的阳性率高于CgA表达率,如CgA在胃泌素瘤、胰高血糖素瘤和生长抑制素瘤的表达较弱,但SCGN的表达较高,说明SCGN诊断这些神经内分泌肿瘤具有较高的敏感度[16-18]。本课题结果显示,与CgA比,SCGN在非功能性PNETs、肿瘤体积大于30 cm3、有包膜、侵犯血管和淋巴结转移中的表达较高(P<0.05),说明与SCGN对PNETs的良性和恶性具有较强的鉴别力,与文献结果相似[19]。另外,本课题中3例死亡病例切除的组织病理均显示淋巴结转移,十二指肠和肠系膜上静脉侵犯,1例门静脉与下腔静脉粘连,2例侵犯胆总管和腹腔后静脉,3例的SCGN表达均大于10,但CgA的表达相对较低。
临床表现、影像学和病理形态难以区分胰腺实性假乳头状肿瘤与无功能性胰腺内分泌肿瘤,但SCGN和 CgA在胰腺实性假乳头状肿瘤表达均为阴性,在无功能性胰腺内分泌肿瘤可呈阳性,因此SCGN和 CgA联合检测可增加诊断胰腺实性假乳头状肿瘤的准确率。
综上所述,PNETs临床案例少见,但临床表现行为复杂,病理分类较多,PNETs胰腺及其他部位来源的神经内分泌癌对治疗的敏感性不同,在这种情况下,将病理形态学改变,肿瘤侵犯包膜、血管、局部组织浸润、淋巴结及脏器转移等参数结合SCGN与CgA在肿瘤组织的表达综合评估和诊断PNETs及PNETs的恶性程度,可为个体化治疗PNETs提供依据。
[1]Batcher E,Madaj P,Gianoukakis AG,et al.Pancreatic neuroendocrine tumors[J].Endocr Res,2011,36(1):35-43.
[2]Delaunoit T,Neczyporenko F,Rubin J,et al.Medical management of pancreatic neuroendocrine tumors[J].Am J Gastroenterol,2008,103(2):475-483.
[3]史玉振,王中秋,卢光明,等.胰腺神经内分泌肿瘤的影像学表现与临床病理对照分析[J].临床放射学杂志,2011,30(11):1618-1623.
[4]吴江,朱虹,王中秋,等.胰腺神经内分泌肿瘤的CT、MRI、18F-FDG PET/CT表现与鉴别诊断[J].中国医学影像学杂志,2009,17(5):325-328.
[5]Sheth S,Hruban RK,Fishman EK. Helical CT of islet cell tumors of the pancreas:typical and atypical manifestations[J].Am J Roentgenol,2002,179:725.
[6]陈原稼.胰腺内分泌肿瘤发病机理和预后[C].中华医学会消化病学分会——2005年全国胃肠激素学术研讨会论文集,2005:33.
[7]O′Grady H,Conlon K.Pancreatic neuroendocrine tumours[J]. Europ J Surg Oncol,2008,34:324.
[8]谢烨卿,陈瑞珍.嗜铬粒蛋白A的基础研究与临床意义[J].中国病理生理杂志,2010,26(7):1440-1443.
[9]杨晓鸥,李景南,钱家鸣,等.血浆嗜铬粒蛋白A对多种神经内分泌肿瘤的诊断价值[J].中华内科杂志,2011,50(2):124-127.
[10]乔新伟,陈原稼,邱玲,等.胰腺神经内分泌肿瘤病人手术前后以及术后复发时血清铬粒素A的变化[C].2012中国消化病学大会,2012:188-189.
[11]Wagner L,Oliyarnyk O,Gartner W,et al.Cloning and expression of secretagogin,a novel neuroendocrine-and pancreatic islet of Langerhans-specific Ca2+binding protein[J].J Biol Chem,2000,275(32):24740-24751.
[12]林东亮,李玉军,赵洁,等.Secretagogin在胃肠道类癌诊断中的作用[J].青岛大学医学院学报,2010,46(3):258-260.
[13]Gartner W,Koc F,Nabokikh A,et al.Long-term in vitro growth of human insulin-secreting insulinoma cells[J].Neuroendocrinology,2006,83(2):123-130.
[14]Maj M,Gartner W,Ilhan A,et al.Expression of TAU in insulin-secreting cells and its interaction with the calcium-binding protein secretagogin[J].J Endocrinol,2010,205(1):25-36.
[15]Lai M,Lu B,Xing X,et al.Novel insights into the distribution and functional aspects of the calcium binding protein secretagogin from studies on rat brain and primary neuronal cell culture[J].Front Mol Neurosci,2012,5:84.
[16]李晓青,钱家鸣.胃肠神经内分泌肿瘤和胰腺神经内分泌肿瘤的区别[J].临床肝胆病杂志,2013,29(7):492-495.
[17]王文军,张帆,何雷,等.促泌素在胃肠道神经内分泌肿瘤中的表达及其临床意义[J].中国组织化学与细胞化学杂志,2012,21(2):186-187.
[18]Secretagogin E.a novel neuroendocrine marker,has a distinct expression pattern from chromogranin[J].Virchows Arch,2006,449(4):402-409.
[19]Lai M,Lbb E,Xing X,et al.Secretagogin,a novel neuroendocrine marker,has a distinct expression pattern from chromogranin [J].Virchows Arch,2006,449(4):402-409.
Expression of SCGN and CgA in pancreatic neuroendocrine tumors*
XueLei,LiDandan,PangWuyan
(DepartmentofEndocrinology,theHuaiheHospitalofHenanUniversity,Kaifeng,Henan475000,China)
Objective To investigate the expression of secretagogin(SCGN) and chromogranin A(CgA) in pancreatic neuroendocrine tumors (PNETs).Methods Totally 54 cases of PNETs hospitalized in our hospital from October 2007 to October 2013 were enrolled in our study.Immunohistochemical detection was used to determine secretagogin and CgA.Results Secretagogin and CgA were highly expressed in all PNETs specimens.Compared with CgA,secretagogin were highly expressed in the non-functional PNETs,tumor volume>30 cm3,the enveloped,vascular invasion and lymph node metastasis (P<0.05).There were no statistically significant difference between SCGN and CgA in functional PNETs tumor volume ≤30 cm3,no enveloped,no vascular invasion and lymph node metastasis(P>0.05).Conclusion The expression of secretagogin and CgA in tumor combined with PNETs pathological characteristics can predict the severity of PNETs.
secretagogin;chromogranin A;panereatic neuroendoerine tumours
10.3969/j.issn.1671-8348.2015.05.021
河南科技攻关项目(112102310090)。 作者简介:薛磊(1975-),主治医师,硕士,主要从事内分泌及代谢性疾病研究。
R735.9
A
1671-8348(2015)05-0638-03
2014-11-08
2014-12-25)
