法舒地尔降低TLR4表达缓解蛛网膜下腔出血后血管痉挛的实验研究
2015-06-01潘巍巍孙霄云
张 力,李 非,潘巍巍,孙霄云△
(1.辽宁医学院附属第一医院康复医学科,辽宁锦州 121001;2.辽河油田第二职工医院外科,辽宁盘锦 124001;3.辽河油田总医院呼吸内科,辽宁盘锦 124001)
·论著·
法舒地尔降低TLR4表达缓解蛛网膜下腔出血后血管痉挛的实验研究
张 力1,李 非2,潘巍巍3,孙霄云1△
(1.辽宁医学院附属第一医院康复医学科,辽宁锦州 121001;2.辽河油田第二职工医院外科,辽宁盘锦 124001;3.辽河油田总医院呼吸内科,辽宁盘锦 124001)
目的 建立兔蛛网膜下腔出血(SAH)后迟发性脑血管痉挛(DCV)模型,探讨法舒地尔防治DCV的作用及相关信号通路。方法 60只新西兰大白兔分为3组,每组20只。实验组枕大池二次注血法建立SAH模型,对照组枕大池内注入生理盐水,治疗组SAH模型建立后,法舒地尔静脉给药。血管造影及经颇多普勒超声(TCD)评估血管痉挛情况,造模后第7天取材井行苏木素-伊红染色观察基底动脉痉挛情况。免疫组织化学和Mestern blot方法检测基底动脉Toll受体4(TLR4)的表达。结果 SAH后血管痉挛模型造模成功,实验组与对照组比较基底动脉直径明显降低(P<0.01);治疗组基底动脉直径较实验组明显增加(P<0.01);免疫组织化学及Mestern blot显示治疗组基底动脉TLR4表达较实验组明显减少(P<0.05)。结论 SAH后DCV可能与TLR4信号通路有关,法舒地尔能显著降低SAH后基底动脉TLR4表达,缓解SAH后DCV。
蛛网膜下腔出血;Toll样受体4;白细胞介素10;迟发型脑血管痉挛;法舒地尔
蛛网膜下腔出血(SAH)是神经外科较为常见的疾病,SAH的致残率、病死率均较高,迟发性脑血管痉挛(DCV)是SAH引起患者预后较差的主要原因[1]。当前,尚缺少行之有效的方案控制SAH,其引起脑血管痉挛的机制较为复杂,发生SAH后产生脑血管痉挛的病理生理机制还不明确,尚需要深入地进行研究,有报道指出炎性反应有可能是SAH后出现DCV的关键环节之一[2-3]。SAH的药物治疗,除扩容、升压、血液稀释、血管扩张剂的应用外,尼莫地平是常用于预防血管痉挛的药物之一,而近年出现的Rho激酶抑制剂法舒地尔在脑血管痉挛(CVS)防治方面的作用正受到越来越多的重视。有研究指出Rho信号通路与炎性信号因子Toll样受体(TLRs)的表达密切相关,作为发现最早的TLR亚型之一,TLR4在炎性反应相关的疾病中被给予极高的关注,原因是在识别细菌脂多糖及介导的炎性反应信号传导中,TLR4发挥了较为重要的作用[4-5]。目前对于法舒地尔通过Rho信号通路而影响TLR4表达的研究报道较少,本研究通过复制兔 SAH 模型,观察法舒地尔对兔 SAH 后DCV的影响及TLR4的表达情况,以探讨法舒地尔在 SAH后DCV防治中的效果。
1 材料与方法
1.1 实验动物 健康纯种新西兰大白兔60只(清洁级),雌雄不限,月龄4~6个月,体质量2.5~3.0 kg。分为对照组(枕大池注入生理盐水0.5 mL/kg,n=20)、实验组(制备SAH模型,n=20)、治疗组(SAH模型制备后法舒地尔静脉注射,n=20)。所有实验动物由辽宁医学院实验动物中心提供。
1.2 DCV模型的制备 使用枕大池二次注血方式制备SAH模型。耳缘静脉注射3%戊巴比妥钠(1 mg/kg)进行麻醉,后将兔俯卧于兔台,电推去兔枕部体毛,显露枕部穿刺处。局部皮肤碘附消毒,铺无菌孔巾,取头皮针末端连接1 mL注射器,向枕大池方向缓慢刺入,有落空感后继续缓慢进针1~2 mm,轻轻回抽可见清亮脑脊液流出,缓慢抽取脑脊液约1 mL,兔耳中央动脉抽取动脉血立即缓慢注入枕大池(0.18 mL/kg),3 min内注射完成。注意观察兔呼气情况,注射后兔俯卧位,头低30°放置约0.5 h,以保证血液积聚在基底动脉周围。使用庆大霉素溶液擦拭穿刺口后无菌包扎。48 h后重复二次注血。对照组枕大池及静脉注入等量0.9%氯化钠注射液。治疗组在枕大池注血后给予静脉注射法舒地尔1 mg/kg。
1.3 神经功能测评 在制备模型后,7 d内的神经缺损症状进行评分。按照Endo的评分标准[6],评分分为4级。1级(0 分):为无神经功能缺损;2级(1分):为轻度或可疑神经功能缺损(嗜睡活动减少);3级(2分):为中度神经功能缺损(肢体无力跛行);4级(3分):为重度神经功能缺损(划圈运动或行走困难)。
1.4 经颅多普勒超声(TCD)检测 在造模后第3天,进行脑血管造影前,使用TCD查看基底动脉痉挛情况。探头为4 MHz,寻找适合的角度置于兔枕部,调整深度和方向至观察到清晰稳定的血流信号。记录显示屏的平均血流速度(MFV)和收缩期峰值流速(PSV)。
1.5 基底动脉血管造影分析 将兔给予10%水合氯醛腹腔注射麻醉,仰卧位于数字减影血管造影(DSA)操作台,术区消毒后,显微解剖下分离股动脉,套管式穿刺针穿刺股动脉,连接三通,以神经介入常用的Echelon10微导管通过股动脉插入到主动脉弓。进入椎动脉后手推造影。使用DSA自带软件处理影像,选取5个测量点(基底动脉纵向中点,距中点上下各1 mm处,距离中点上下各2 mm处)测量基底动脉直径,两名测量者使用背靠背方式测量,计算平均直径。DSA在制备SAH模型前(T1),制备后第3 d(T2)和第7天(T3)进行。
1.6 标本的收集 在制备模型后7 d,麻醉后处死动物,原位灌注固定脑血管及脑组织,显微解剖留取基底动脉,取基底动脉 1/2 段,苏木素-伊红(HE)染色,观察基底动脉管径情况。
1.7 免疫组织化学检测 基底动脉固定后制备蜡块,横断位切片,脱蜡,微波修复,5%山羊血清封闭,PBS稀释的一抗(兔抗TLR4和IL-10,1∶100稀释)适量,-4 ℃冰箱过夜。滴加生物素化山羊抗兔IgG,37 ℃恒温箱孵育20 min,DAB显色。切片放显微镜下观察,细胞质或细胞核显现棕黄色为阳性,未显现棕黄色为阴性。阴性反应组用DPS缓冲液代替一抗。观察和分析使用IPP软件,随机视野为每个组织5个点。染色范围分4级,+:染色范围小于1/4视野;++:染色范围在1/4~1/2视野;+++:染色范围在1/2~3/4视野;++++:染色范围大于3/4视野。分为4个染色等级,阴性(-)、弱阳性(+)、中等阳性(++)、强阳性(+++)。染色范围和染色等级被转换成染色指数。染色指数=染色范围×染色等级。其中-为0分,+为1分,++为2分,+++为3分,++++为4分。
1.8 Western blot检测 将留取的基底动脉组织制备成匀浆,应用蛋白裂解液,行凝胶电泳,转膜至硝酸纤维素薄膜,TBST浸洗,封闭液封闭,与稀释的一抗混合孵育。TBST浸洗后在室温下同二抗混合孵育。再次TBST浸洗后加入发光显色剂进行显色。应用图像分析系统分析条带光的密度。
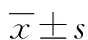
2 结果
2.1 神经功能评分 对照组0分,无神经功能障碍。实验组(2.2±0.73)分、治疗组(1.3±0.22)分,治疗组与实验组比较差异有统计意义(P<0.05)。
2.2 基底动脉血流速度 与对照组比较,实验组基底动脉的脑血流平均流速(MFV)和最大峰流速(PSV)明显升高(P<0.05)。治疗组与实验组比较,MFV和PSV明显降低(P< 0.05)。蛛网膜下腔出血3 d后对照组、实验组、治疗组动物出现TCD典型表现。与对照组比较,蛛网膜下腔出血后MFV和PSV明显增加。与实验组比较,治疗组血流速度(MFV、PSV)明显降低,见图1。

A:MFV;B:PSV。
图1 TCD测量基底动脉脑血流速
2.3 基底动脉直径 DSA显示不同组别基底动脉直径痉挛的情况。对照组血基底动脉无痉挛,实验组血管痉挛明显,基底动脉纤细,治疗组血管痉挛明显缓解,DSA图未呈现。在T2和T3时间,实验组和治疗组中基底动脉的管径较对照组基底动脉管径减小,实验组基底动脉平均直径明显小于治疗组的直径,差异有统计学意义(P<0.01),见表1。

表1 基底动脉直径
a:P<0.01,与 T1时间比较;b:P<0.01,与对照组比较;c:P<0.01,与实验组比较。
2.4 基底动脉HE染色 基底动脉HE染色图像中:实验组可见明显血管痉挛,管壁内膜皱褶,增厚,可见炎性细胞浸润,对照组和治疗组中基底动脉痉挛和周围的炎性反应均较轻,无明显痉挛,见图2。

A:对照组;B:实验组;C:治疗组。
图2 HE染色观察基底动脉血管痉挛改变
2.5 免疫组织化学表达 软件分析各组基底动脉的免疫组化表达结果,实验组中TLR4及IL-10表达与对照组相比显著升高,差异有统计学意义(P<0.05)。治疗组基底动脉TLR4及IL-10与实验组比较表达显著减少,差异有统计学意义(P<0.05),见表2。

表2 TLR4和IL-10的免疫组织化学检测
a:P<0.05,b:P<0.01,与对照组比较;c:P<0.05,与实验组比较。
2.6 Western blot检测结果 Western blot检测基底动脉中TLR4和IL-10表达,结果显示实验组TLR4和IL-10表达与对照组比较显著升高(P<0.05);与实验组相比,治疗组基底动脉TLR4和IL-10表达显著减少(P<0.05),见图3、4,表3。
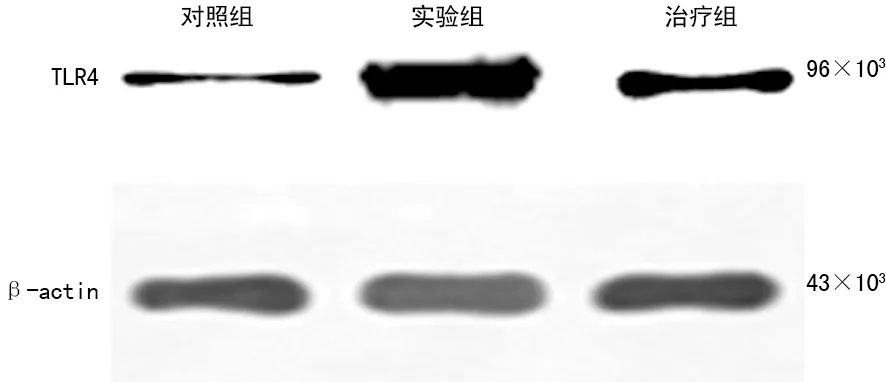
图3 TLR4的Western blot检测

图4 IL-10的Western blot检测

表3 基底动脉TLR4和IL-10蛋白表达
a:P<0.05,b:P<0.01,与对照组比较;c:P<0.05,与实验组比较。
3 讨论
本研究中采用枕大池二次注血方式制备SAH模型,该制模方式是目前研究脑血管痉挛机制实验中较为常用的方法[7-8],基底动脉痉挛程度可以通过DSA检测证实,此外在形态学改变上和人类较为相似。本研究中,枕大池初次注血7 d后处死实验动物,发现实验组和治疗组中均可观察到基底动脉周围及基底动脉池内有血块聚集,而且实验组基底动脉血管管径明显痉挛、减小,证明模型的反应良好,适合本实验的需求。
TLRs是一种模式识别受体,在炎性反应以及固有免疫中都发挥关键作用。目前,已经发现13种哺乳动物的TLRs,这些受体能够识别各种器官的病原分子模式[9]。此外,TLRs能够识别破坏相关的分子模式,而且还能够为主要的损伤性炎性反应作中介。从本研究实验组基底动脉中TLR4的表达显著提高,此结果表明TLR4有可能介导了DCV的发生。有研究指出,在鼠的颅内出血模型内,一些内在的配体能够激活TLR4,使之表达上调,包括亚铁血红素以及纤维蛋白原等,TLR4的上调则进一步导致严重后果[10]。本研究中,实验组基底动脉TLR4和IL-10表达均高于对照组,提示SAH后出现某种配体,其可以同TLR4结合进一步介导炎性反应的发生,从而通过信号传导系统,促使IL-10表达上调,IL-10又进一步参与CVS发生、发展。
相关研究报道提示[11],在SAH后DCV发生的过程中,Rho/Rho激酶途径可能发挥了重要的作用。盐酸法舒地尔注射液,是一种新型Rho(丝氨酸/苏氨酸蛋白)激酶抑制药,是一种新型异喹啉磺胺衍生物,其主要通过阻断血管收缩过程的最终阶段——肌球蛋白轻链磷酸化来扩张血管,抑制血管痉挛,从而保护缺血脑组织,进而达到防治脑血管痉挛的目的,保护了脑神经细胞,改善患者临床预后。法舒地尔具备双重的抑制磷酸化作用[12],主要表现为3个方面:(1)抑制激酶,增加生成,发挥保护损伤组织的作用[13];(2)拮抗激酶,抑制炎性细胞,降低炎症介质数量及减少炎性反应,发挥抑制蛋白水解和细胞凋亡的作用;(3)阻断激酶抑制肌球蛋白轻链激酶,抑制钙敏化的效应,发挥舒张平滑肌,扩张血管的作用[14]。
有研究指出Rho/Rho激酶途径由TLR介导的信号通路发挥作用[15],本研究结果显示法舒地尔可以显著减少TLR4表达,其机制与其抑制激酶的作用密切相关。很多研究报道指出,脑血管痉挛引起炎症渗出,脑水肿加重和细胞凋亡,最后导致血脑屏障的破坏以及脑细胞的大量死亡[14,16]。本研究使用静脉注射法舒地尔观察其防治DCV的效果,结果提示给药后第5天其抑制痉挛效果最显著,随后的效果并不明显,这可能与SAH后血脑屏障的自我修复以及脑启动的某种血管保护机制有关系。研究还发现在治疗组基底动脉的IL-10表达水平显著降低,主要是因为法舒地尔抑制了TLR4受体表达后,进一步减少了其下游IL-10的表达,这提示TLR4信号通路在SAH后DCV的发生、发展中具有重要的地位。
综上所述,静脉注射法舒地尔能够在动物模型中有效地抑制蛛网膜下腔出血后的血管痉挛反应,作为 Rho/Rho激酶途径的抑制剂,法舒地尔能够减少血管组织中TLR4的表达从而降低炎性反应,最终缓解血管痉挛。
[1]Connolly ES Jr,Rabinstein AA,Carhuapoma JR,et al.Guidelines for the management of aneurysmal subarachnoid hemorrhage:a guideline for healthcare professionals from the american heart association/american stroke association [J].Stroke,2012,43(6):1711-1137.
[2]Chang CZ,Wu SC,Lin CL,et al.Purine anti-metabolite attenuates nuclear factor kappab and related pro-inflammatory cytokines in experimental vasospasm[J].Acta Neurochir(Wien),2012,154(10):1877-1885.
[3]Chang CZ,Lin CL,Kassel NF,et al.6-mercaptopurine attenuates adhesive molecules in experimental vasospasm[J].Acta Neurochir(Wien),2010,152(5):861-867.
[4]BellMT,PuskasF,AgostonVA,etal.Toll-likereceptor4-dependentmicroglialactivationmediatesspinalcordischemia-reperfusioninjury[J].Circulation,2013,128(26Suppl1):S152-156.
[5]王超,杨智勇,路华,等.Toll 样受体 4 信号通路在蛛网膜下腔出血后早期脑损伤中的机制研究[J].国际神经病学神经外科学杂志,2012,39(1):25-28.
[6]Yu JM,Mo YC,Liang DD,et al.Effects of nimodipine on rabbits with symptomatic cerebral vasospasm[J].Zhonghua Yi Xue Za Zhi,2011,91(5):345-349.
[7]Titova E,Ostrowski RP,Zhang JH,et al.Experimental models of subarachnoid hemorrhage for studies of cerebral vasospasm[J].Neurol Res,2009,31(6):568-581.
[8]易帅,霍晓川,甄为,等.Toll样受体4拮抗剂防治兔蛛网膜下腔出血后迟发型血管痉挛[J].解放军医学院学报,2014,35(2):157-160.
[9]Frazão JB,Errante PR,Condino-Neto A.Toll-Like receptors′ pathway disturbances are associated with increased susceptibility to infections in humans[J].Arch Immunol Ther Exp(Warsz),2013,61(6):427-443.
[10]Shao Z,Li J,Zhao Z,et al.Effects of tetramethylpyrazine on nitric oxide/cGMP signaling after cerebral vasospasm in rabbits[J].Brain Res,2010,1361:67-75.
[11]Shibuya M,Asano T,Sasaki Y.Effect of Fasudil HCl,a protein kinase inhibitor,on cerebral vasospasm[J].Acta Neurochir Suppl,2001,77:201-204.
[12]Rikitake Y,Kim HH,Huang Z,et al.Inhibition of Rho kinase(ROCK) leads to increased cerebral blood flow and stroke protection[J].Stroke,2005,36(10):2251-2257.
[13]Wettschureck N,Offermanns S.Rho/Rho-kinase mediated signaling in physiology and pathophysiology[J].J Mol Med(Berl),2002,80(10):629-638.
[14]Carr KR,Zuckerman SL,Mocco J.Inflammation,cerebral vasospasm,and evolving theories of delayed cerebral ixschemia[J].Neurol Res Int,2013,2013:506584.
[15]Chen Q,Gupta S,Pernis AB.Regulation of TLR4-mediated signaling by IBP/Def6,a novel activator of Rho GTPases[J].J Leukoc Biol,2009,85(3):539-543.
[16]Aminmansour B,Ghorbani A,Sharifi D,et al.Cerebral vasospasm following traumatic subarachnoid hemorrhage[J].J Res Med Sci,2009,14(6):343-348.
Fasudil relives cerebral vasospasm following subarachnoid hemorrhage by inhibiting TLR4 expression
ZhangLi1,LiFei2,PanWeiwei3,SunXiaoyun1△
(1.DepartmentofRehabilitationMedicine,theFirstAffiliatedHospitalofLiaoningMedicaluniversity,Jinzhou,Liaoning121001,China;2.DepartmentofSurgery,No.2Workers′HospitalofLiaoheOilfield,Panjin,Liaoning124001,China;3.DepartmentofRespiratoryMedicine,GeneralHospitalofLiaoheOilfield,Panjin,Liaoning124001,China)
Objective To study the effect of Toll-like receptor 4 inhibitor Fasudil on cerebral vasospasm after SAH.Methods A total of 60 New Zealand rabbits were randomly divided into three groups,20 rabbits for each group,SAH group:SAH model was established by autologous blood injection into the cisterna magna.Control group:saline was injected into cisterna magna.Fasudil group:Fasudil was injected into vein after SAH model.Vasospasm was valued by DSA and TCD.Seven days after operation basilar artery were collected.HE stain was used to observe vasospasm.TLR4 were observed by immunohistochemistry and western blotting.Results Vasospasm model after SAH was successfully established.The basilar artery diameters were significantly shorter in the model group compared with the normal group (P<0.01).The artery diameter in Fasudil group increased significantly compared with SAH group(P<0.01).The expression of TLR4 decreased significantly in the Fasudil group compared with the model group(P<0.05).Conclusion Toll-like receptor 4 pathway may be associated with cerebral vasospasm (DCV).Fasudil could inhibit TLR-4 expression and prevent cerebral vasospasm following subarachnoid hemorrhage.
subarachnoid hemorrhage;Toll-like receptor 4;interleukin 10;cerebral vasospasm;Fasudil
张力(1982-),护师,本科,主要从事康复医学研究。△
,E-mail:sunxiaoyun1983@126.com。
10.3969/j.issn.1671-8348.2015.05.003
R743.35
A
1671-8348(2015)05-0583-03
2014-10-18
2014-12-10)
