菊粉和金玉兰对2型糖尿病患者血糖控制和血脂代谢的影响
2015-06-01刘鹏举马方李明卢洁
刘鹏举,马方,李明,卢洁
中国医学科学院北京协和医学院北京协和医院1营养科2检验科,北京100730
菊粉和金玉兰对2型糖尿病患者血糖控制和血脂代谢的影响
刘鹏举1,马方1,李明2,卢洁2
中国医学科学院北京协和医学院北京协和医院1营养科2检验科,北京100730
目的研究菊粉和金玉兰对2型糖尿病患者血糖控制和血脂代谢的影响。方法 75例2型糖尿病患者按照性别和体重指数匹配的方法分为菊粉组 (n=25)、金玉兰组 (n=25)和对照组 (n=25),3组患者均给予普通糖尿病膳食,在此基础上菊粉组每天给予菊粉15 g,金玉兰组每天给予金玉兰120 g。分别于基线期、4和8周时观察3组患者的空腹血糖 (fasting blood glucose,FBG)、胰岛素抵抗指数 (homeostasis model assessment of insulin resistance index,HOMA-IR)、糖化血红蛋白 (glycated hemoglobin,HbA1c)、血脂、转氨酶和肌酐等指标的变化并进行比较。结果菊粉组、金玉兰组及对照组分别有23、22和23例完成研究。基线期各项观察指标3组之间差异均无统计学意义 (P>0.05)。4周时,菊粉组FBG、HbA1c、HOMA-IR、总胆固醇 (total cholesterol,TC)、低密度脂蛋白胆固醇 (low-density lipoprotein cholesterol,LDL-c)的变化同对照组相比有降低的趋势;8周时,菊粉组FBG、HbA1c、HOMA-IR、TC、LDL-c的降低同对照组相比差异具有统计学意义 (P<0.05),其余观察指标变化的差异无统计学意义 (P>0.05)。4周和8周时,金玉兰组各项指标变化同对照组相比差异无统计学意义 (P>0.05)。结论菊粉有益于2型糖尿病患者的血糖控制和血脂代谢,并且对肝、肾功能无影响。金玉兰对2型糖尿病患者血糖控制和血脂代谢无显著影响。
菊粉;金玉兰;2型糖尿病;糖化血红蛋白;血脂
菊粉是在自然界分布极广的一种碳水化合物,主要存在于植物中作为能量储备和冷冻保护剂,菊粉是用热水从菊苣根中提取制成,称为天然菊苣菊粉,是链状果聚糖 (fructan),用酶进行部分水解后可产生低聚果糖,属于膳食纤维成分。金玉兰学名为芽球菊苣,是由菊苣根经软化栽培在根顶部长出的一种功能性蔬菜,富含膳食纤维和矿物质。因此,国外把摄入菊粉和金玉兰作为膳食纤维的一种补充方法。膳食纤维在上消化道不被消化降解而完整地进入大肠,在大肠可以被分解或部分分解为短链脂肪酸 (short-chain fatty acids,SCFAs),进而影响循环中游离脂肪酸的浓度和具有调节血糖作用的胃肠激素的浓度,从而改善血糖水平[1]。此外,国外文献报道还显示菊粉和金玉兰能促进肠道益生菌的生长,从而改善肠道功能[2]。目前,国外一些动物实验显示来自于菊粉和金玉兰的低聚果糖具有改善血糖控制和血脂代谢的作用[3-4],近期一项研究显示健康人群对菊粉和金玉兰具有良好的耐受性[5],但其能否改善人体的血糖控制和血脂代谢尚需进一步探讨。本研究旨在观察菊粉和金玉兰对2型糖尿病患者血糖控制和血脂代谢的影响。
对象和方法
对象
采取广告招募的形式召集2型糖尿病患者,所有患者均采取口服降糖药治疗,未接受任何抗肿瘤治疗及激素治疗。研究对象纳入标准:(1)符合糖尿病1999年WHO标准;(2)年龄≥18岁;(3)理解此次研究目的并签署知情同意。排除标准: (1)合并其他内分泌疾病如甲亢、库欣综合征等; (2)严重肝、肾功能异常者;(3)使用胰岛素治疗者;(4)严重心、肺、脑疾病患者;(5)不能正常进食者;(6)未完成膳食记录或记录的膳食日记不符合糖尿病膳食原则者;(7)未按照研究要求食用菊粉和金玉兰者。
研究方案
患者完成知情同意后按照性别和体重指数匹配的方法分成菊粉组、金玉兰组和对照组。3组在研究前进行1次集体糖尿病相关知识宣教和糖尿病饮食教育,并给每位患者发放糖尿病营养知识手册和膳食记录表,在研究期间3组均记录膳食日记,每周记录3 d(其中1 d为周末)。菊粉组采取普通糖尿病膳食+菊粉15 g/d、金玉兰组采取普通糖尿病膳食+金玉兰120 g/d、对照组单纯采取普通糖尿病膳食干预方法,分别观察基线期、干预4周和8周时3组患者空腹血糖、胰岛素抵抗指数 (homeostasis model assessment of insulin resistance index,HOMA-IR)、糖化血红蛋白 (glycated hemoglobin,HbA1c)、血脂、转氨酶和肌酐等指标的变化。研究人员每周进行1次电话随访,受试者如有相关问题,可及时得到沟通和解决。研究方案经中国医学科学院北京协和医院伦理委员会同意并批准。
观察指标
血液指标测定:所有受试者空腹8 h以上,取前臂静脉血,采用全自动生化仪 (Olympus AU 5400,日本)检测血清总胆固醇 (total cholesterol,TC)、甘油三酯 (triglyceride,TG)、高密度脂蛋白胆固醇 (highdensity lipoprotein cholesterol,HDL-c)、低密度脂蛋白胆固醇 (low-density lipoprotein cholesterol,LDL-c)、空腹血糖 (fasting blood glucose,FBG)水平;HbA1c测定采用高压液相色谱法,空腹血胰岛素测定采用放射免疫测定法,HOMA-IR计算公式为HOMA-IR=空腹血糖 (mmol/L)×空腹血胰岛素 (mU/L)/22.5。
人体测量学指标:研究对象禁食8 h以上,排空大小便,着轻薄衣裤测定。应用标准身高测定尺由专人测定身高,采用经标定的RGZ120型体重计 (感量0.1 kg,最大量度120 kg)由专人测定体重,体重指数计算公式为:体重指数=体重 (kg)/身高 (m)2。
统计学处理
采用SPSS 11.5统计学软件,计量资料采用均值±标准差描述,采用非参数分析进行假设检验,组间定量资料比较采用独立样本t检验,不符合正态分布的采用秩和检验;分类资料采用卡方检验。P<0.05为差异具有统计学意义。
结果
研究对象基线情况
3组患者平均年龄为 (63.0±8.0)岁 (40~78岁),基线期的各项观察指标 (包括FBG、HbA1c、HOMA-IR、TC、TG、HDL-c、LDL-c、肌酐、谷丙转氨酶、谷草转氨酶)3组之间差异均无统计学意义(P均>0.05),3组年龄和性别比差异无统计学意义(P>0.05)(表1)。
4周时3组各项观察指标的差值比较
4周时,菊粉组 (1例未规律服用菊粉、1例自动退出)、金玉兰组 (1例未按要求记录饮食日记、2例更换降糖药物)及对照组 (1例自动退出、1例服用了保健品)完成研究的例数分别为23、22和23例。菊粉组FBG、HbA1c、HOMA-IR、TC、LDL-c的变化同对照组相比有降低趋势,但差异无统计学意义 (P>0.05),其余指标差异无统计学意义;金玉兰组各项指标变化与对照组相比差异无统计学意义 (P>0.05)(表2)。
8周时3组各项观察指标的差值比较
8周时,各组受试者数量无变化。菊粉组患者的FBG、HbA1c、HOMA-IR、TC、LDL-c的降低同对照组相比差异具有统计学意义 (P<0.05),其余指标差异无统计学意义 (P>0.05);金玉兰组各项指标变化与对照组相比差异无统计学意义 (P>0.05)(表3)。
讨论
本研究中,菊粉组和金玉兰组的受试者对菊粉和金玉兰耐受性较好,未出现明显的不良反应,并且菊粉和金玉兰对转氨酶和血肌酐的变化无影响 (P>0.05),显示其良好的安全性,与国外的报道相一致[4]。
表1 基线期3组各项观察指标情况 (±s)
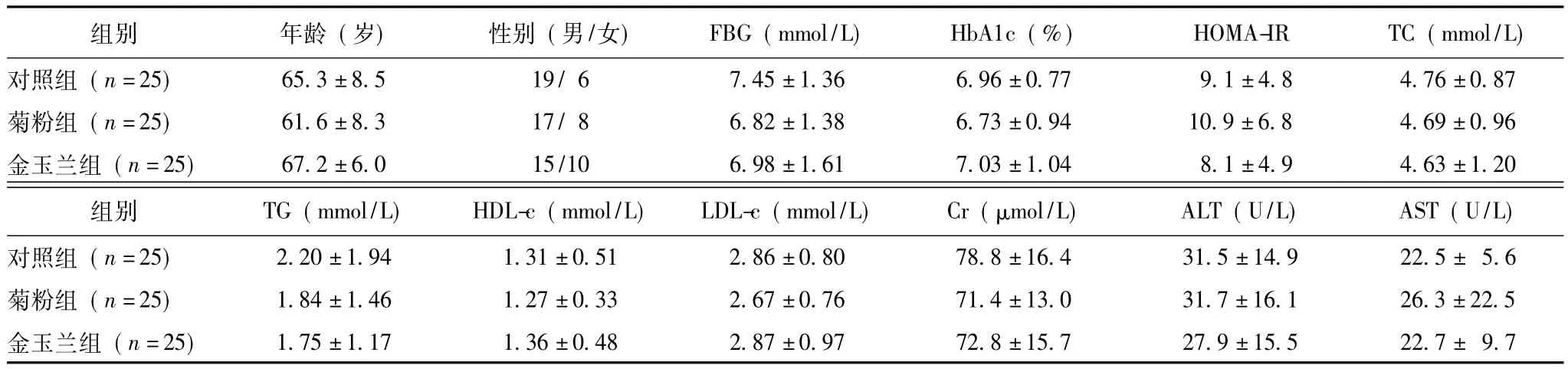
表1 基线期3组各项观察指标情况 (±s)
FBG:空腹血糖;HbA1c;糖化血红蛋白;HOMA-IR:胰岛素抵抗指数;TC:总胆固醇;TG:甘油三酯;HDL-c:高密度脂蛋白胆固醇;LDL-c:低密度脂蛋白胆固醇;Cr:肌酐;ALT:谷丙转氨酶;AST:谷草转氨酶
组别年龄 (岁)性别 (男/女) FBG(mmol/L) HbA1c(%) HOMA-IR TC(mmol/L)对照组 (n=25) 65.3±8.5 19/6 7.45±1.36 6.96±0.77 9.1±4.8 4.76±0.87菊粉组 (n=25) 61.6±8.3 17/8 6.82±1.38 6.73±0.94 10.9±6.8 4.69±0.96金玉兰组 (n=25) 67.2±6.0 15/10 6.98±1.61 7.03±1.04 8.1±4.9 4.63±1.20组别 TG(mmol/L) HDL-c(mmol/L) LDL-c(mmol/L) Cr(μmol/L) ALT(U/L) AST(U/L)对照组 (n=25) 2.20±1.94 1.31±0.51 2.86±0.80 78.8±16.4 31.5±14.9 22.5± 5.6菊粉组 (n=25) 1.84±1.46 1.27±0.33 2.67±0.76 71.4±13.0 31.7±16.1 26.3±22.5金玉兰组 (n=25) 1.75±1.17 1.36±0.48 2.87±0.97 72.8±15.7 27.9±15.5 22.7± 9.7
表2 4周后3组各项观察指标较基线期变化情况比较 (±s)
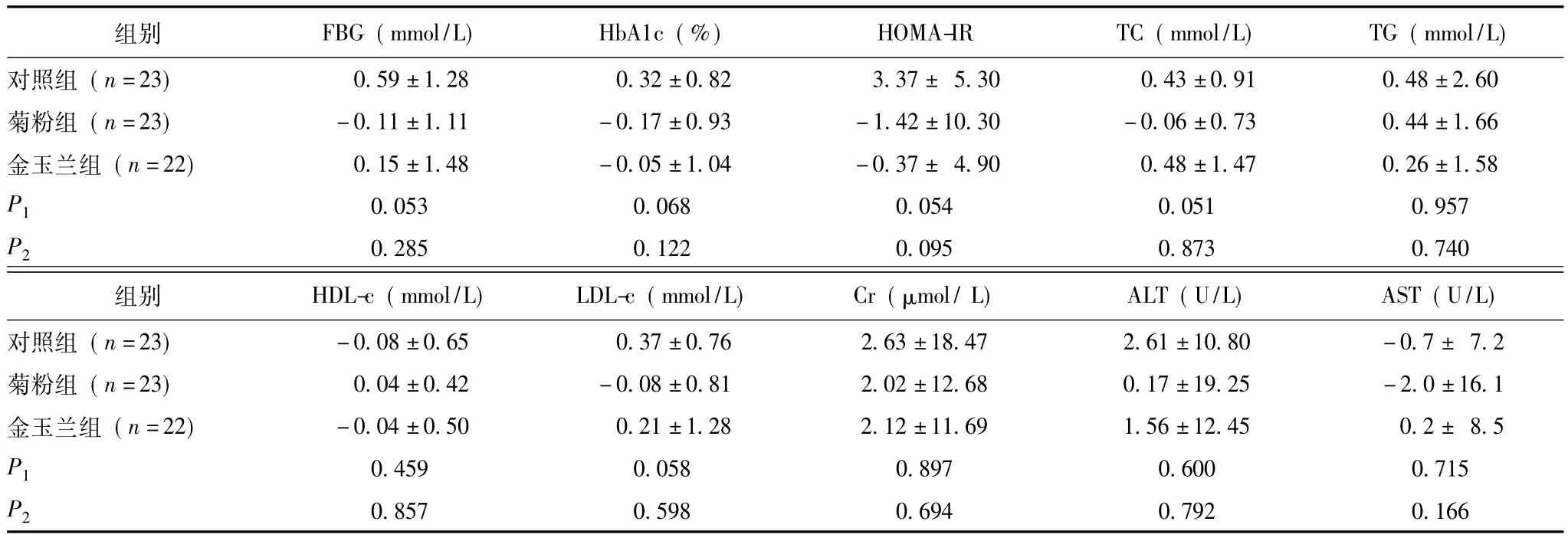
表2 4周后3组各项观察指标较基线期变化情况比较 (±s)
FBG、HbA1c、HOMA-IR、TC、TG、HDL-c、LDL-c、Cr、ALT、AST:同表1;P1:菊粉组与对照组比较的P值;P2:金玉兰组与对照组比较的P值
组别 FBG(mmol/L) HbA1c(%) HOMA-IR TC(mmol/L) TG(mmol/L)对照组 (n=23) 0.59±1.28 0.32±0.82 3.37± 5.30 0.43±0.910.48±2.60菊粉组 (n=23)-0.11±1.11-0.17±0.93-1.42±10.30-0.06±0.73 0.44±1.66金玉兰组 (n=22) 0.15±1.48-0.05±1.04-0.37± 4.90 0.48±1.47 0.26±1.58 P1 0.053 0.068 0.054 0.051 0.957 P2 0.285 0.122 0.095 0.873 0.740组别 HDL-c(mmol/L) LDL-c(mmol/L) Cr(μmol/L) ALT(U/L) AST(U/L)对照组 (n=23)-0.08±0.65 0.37±0.76 2.63±18.47 2.61±10.80-0.7± 7.2菊粉组 (n=23) 0.04±0.42-0.08±0.81 2.02±12.68 0.17±19.25-2.0±16.1金玉兰组 (n=22)-0.04±0.50 0.21±1.28 2.12±11.69 1.56±12.45 0.2± 8.5 P1 0.459 0.058 0.897 0.600 0.715 P20.857 0.598 0.694 0.792 0.166
表3 8周后3组各项观察指标较基线期变化情况比较 (±s)
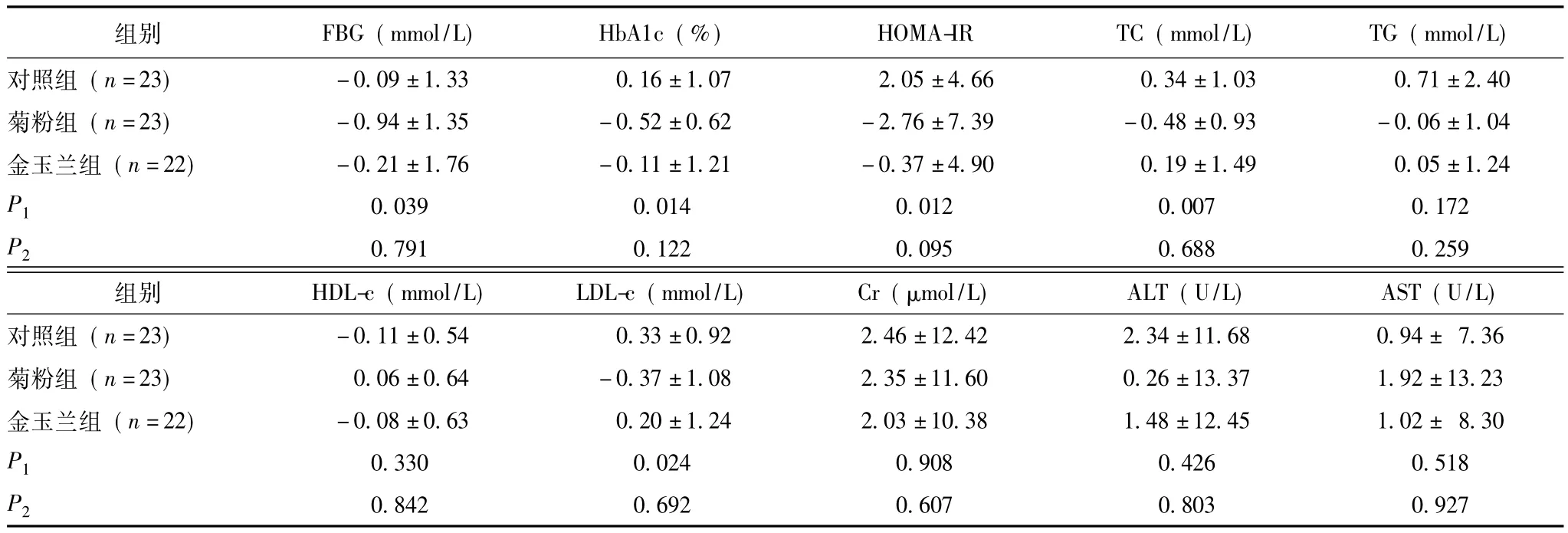
表3 8周后3组各项观察指标较基线期变化情况比较 (±s)
FBG、HbA1c、HOMA-IR、TC、TG、HDL-c、LDL-c、Cr、ALT、AST:同表1;P1:菊粉组与对照组比较的P值;P2:金玉兰组与对照组比较的P值
组别 FBG(mmol/L) HbA1c(%) HOMA-IR TC(mmol/L) TG(mmol/L)对照组 (n=23)-0.09±1.33 0.16±1.07 2.05±4.66 0.34±1.030.71±2.40菊粉组 (n=23)-0.94±1.35-0.52±0.62-2.76±7.39-0.48±0.93-0.06±1.04金玉兰组 (n=22)-0.21±1.76-0.11±1.21-0.37±4.90 0.19±1.49 0.05±1.24 P1 0.039 0.014 0.012 0.007 0.172 P2 0.791 0.122 0.095 0.688 0.259组别 HDL-c(mmol/L) LDL-c(mmol/L) Cr(μmol/L) ALT(U/L) AST(U/L)对照组 (n=23)-0.11±0.54 0.33±0.92 2.46±12.42 2.34±11.680.94± 7.36菊粉组 (n=23) 0.06±0.64-0.37±1.08 2.35±11.60 0.26±13.37 1.92±13.23金玉兰组 (n=22)-0.08±0.63 0.20±1.24 2.03±10.38 1.48±12.45 1.02± 8.30 P1 0.330 0.024 0.908 0.426 0.518 P20.842 0.692 0.607 0.803 0.927
胰岛素抵抗是2型糖尿病发病机制中的一个重要因素,低胰岛素敏感性是代谢综合征的基础[6],脂肪酸的代谢是决定组织胰岛素敏感性的一个主要因素,脂肪的异常堆积以及脂肪溶解作用的异常会增加脂肪酸由脂肪组织向非脂肪组织如骨骼肌的流动,这在胰岛素抵抗的发生和发展中起非常重要的作用[7]。流行病学资料显示胰岛素抵抗可能与膳食纤维摄入量减少及高热量的饮食模式相关,而国外有研究证实膳食纤维摄入量的增加能改善胰岛素的敏感性[8]。膳食纤维是指来源于植物的不被小肠中消化酶水解而直接进入大肠的多糖 (非淀粉多糖)和极少量木质素的总和,在大肠可以被分解或部分分解为SCFAs进而影响循环中游离脂肪酸的浓度和具有调节血糖作用的胃肠激素的浓度,从而改善血糖水平[1]。
2型糖尿病患者多数存在血脂代谢异常,其中血液中TC和HDL-c的增高是心血管疾病及动脉粥样硬化重要危险因素,而包括饮食治疗在内的生活方式改变是预防和治疗高胆固醇血症的一线治疗方法。本研究中,菊粉组患者在4周时FBG、HbA1c、HOMA-IR等水平的变化同对照组相比显示出降低趋势,而8周后这些指标的降低同对照组相比差异具有统计学意义 (P<0.05),可能与菊粉中膳食纤维改善胰岛素敏感性的作用相关。此外,在菊粉组还显示每天15 g菊粉的补充还能显著降低2型糖尿病患者的TC和LDL-c。在金玉兰组并未显示改善血糖控制和血脂代谢的作用,分析原因可能是由于补充剂量较小、观察时间较短及观察样本数量较少,还需大样本的人群研究进一步验证。
综上,对2型糖尿病患者补充适当剂量的菊粉等膳食纤维成分,可能使患者获益。
[1]Tarini J,Wolever TM.The fermentable fibre inulin increases postprandial serum short-chain fatty acids and reduces free-fatty acids and ghrelin in healthy subjects[J].Appl Physiol Nutr Metab,2010,35:9-16.
[2]Samanta AK,Jayapal N,Senani S,et al.Prebiotic inulin: useful dietary adjuncts to manipulate the livestock gut microflora[J].Braz J Microbiol,2013,44:1-14.
[3]Jurgoński A,Jus'kiewicz J,Zduńczyk Z,et al.Caffeoylquinic acid-rich extract from chicory seeds improves glycemia,atherogenic index,and antioxidant status in rats[J].Nutrition,2012,28:300-306.
[4]Jus'kiewicz J,Zduńczyk Z,Zary-Sikorska E,et al.Effect of the dietary polyphenolic fraction of chicory root,peel,seed and leaf extracts on caecal fermentation and blood parameters in rats fed diets containing prebiotic fructans[J].Br J Nutr,2011,105:710-720.
[5]Bonnema AL,Kolberg LW,Thomas W,et al.Gastrointestinal tolerance of chicory inulin products[J].J Am Diet Assoc,2010,110:865-888.
[6]DeFronzo RA,Ferrannini E.Insulin resistance:a multifaceted syndrome responsible for NIDDM,obesity,hypertension,dyslipidemia,and atherosclerotic cardiovascular disease[J].Diabetes Care,1991,14:173-194.
[7]McGarry JD.Banting Lecture 2001:dysregulation of fatty acid metabolism in the etiology of type 2 diabetes[J].Diabetes,2002,51:7-18.
[8]Martin O,Hannah V,Matthias M,et al.Cereal fiber improves whole-body insulin sensitivity in overweight and obese women[J].Diabetes Care,2006,29:775-780.
Effects of Inulin and Chicory on Glucose Control and Lipid Profiles in Patients with Type 2 Diabetes
LIU Peng-ju1,MA Fang1,LI Ming2,LU Jie2
1Department of Clinical Nutrition,2Department of Clinical Laboratory,Peking Union Medical College Hospital,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100730,China
ObjectiveTo investigate the effects of inulin and chicory on glucose control and lipid profiles in patients with type 2 diabetes.MethodsSeventy-five patients with type 2 diabetes were assigned to inulin group(n=25),chicory group(n=25),and control group(n=25)with matching gender and body mass index.The three groups were all given diabetes diets,in addition,15 g inulin and 120 g chicory daily were added in the inulin group and the chicory group,respectively.All the patients'fasting blood glucose(FBG),homeostasis model assessment of insulin resistance index(HOMA-IR),glycated hemoglobin(HbA1c),lipid profiles,aminotransferase,and creatinine were observed at baseline,4 weeks,and 8 weeks,and the changes of all those parameters were compared.ResultsThe numbers of patients finishing this study in the inulin,chicory,and control groups were 23,22,and 23,respectively.At baseline,none of the parameters showed significant difference among the three groups(P>0.05).At 4 weeks,the changes of FBG,HbA1c,HOMA-IR,total cholesterol(TC),and low-density lipoprotein cholesterol(LDL-c)in the inulin group showed a decreasing trend com-pared with the control group;and the differences in changes of FBG,HbA1c,HOMA-IR,TC,and LDL-c were significant at 8 weeks(P<0.05),while the changes of other parameters showed no significant difference(P>0.05).The changes of all the parameters showed no significant difference between the chicory group and the control group at 4 weeks and 8 weeks(P>0.05).ConclusionsInulin is conducive to blood glucose control and lipid profiles in type 2 diabetes,and does not affect liver and renal functions.In contrast,chicory has no significant effect on glucose control or lipid profiles in type 2 diabetes.
inulin;chicory;type 2 diabetes mellitus;glycated hemoglobin;blood lipids Med J PUMCH,2015,6(4):251-254
MA Fang Tel:010-69155551,E-mail:mafang219@126.com
R587.1;R151.3
A
1674-9081(2015)04-0251-04
10.3969/j.issn.1674-9081.2015.04.003
2015-05-29)
马方电话:010-69155551,E-mail:mafang219@126.com
