18β-甘草次酸长期灌胃对大鼠肝功能及肝脏组织形态的影响 *
2015-06-01张小兵王有虎张福宏刘翔毅杨贵军
桂 岩,张小兵,江 英,王有虎,张福宏,刘翔毅,马 毅,董 明,杨贵军
(1.兰州大学第一医院耳鼻咽喉头颈外科,甘肃 兰州 730000;2.甘肃中医学院附属医院耳鼻咽喉头颈外科,甘肃 兰州 730000)
·实验研究·
18β-甘草次酸长期灌胃对大鼠肝功能及肝脏组织形态的影响*
桂 岩1,张小兵1,江 英1,王有虎1,张福宏1,刘翔毅2,马 毅1,董 明1,杨贵军1
(1.兰州大学第一医院耳鼻咽喉头颈外科,甘肃 兰州 730000;2.甘肃中医学院附属医院耳鼻咽喉头颈外科,甘肃 兰州 730000)
目的:观察18β-甘草次酸长期灌胃对正常大鼠肝脏功能及组织形态的影响。方法:将120只大鼠(雌雄各半)随机分成正常对照组和甘草次酸低剂量(25μg/g )、中剂量(50 μg/g)、高剂量组(100μg/g) 4组。每组分别以相应剂量甘草次酸灌胃,于给药6周、14周、22周、30周及停药4周检测大鼠丙氨酸氨基转移酶(ALT)、天门冬甘酸氨基转移酶(AST)、清蛋白、球蛋白、总蛋白、胆红素及碱性磷酸酶等指标,以及肝脏脏器指数和组织形态学改变。结果:干预6周、14周、22周、30周及停药4周,甘草次酸低、中、高剂量组与正常对照组转氨酶、清蛋白、胆红素及碱性磷酸酶对比,差别无统计学意义(P>0.05);而球蛋白和总蛋白在给药30周及停药4周时均低于正常对照组,差别有统计学意义(P<0.05),但3个剂量组之间对比,差别无统计学意义(P>0.05)。在各观测时间点,各组间大鼠肝脏组织形态未见明显改变,肝小叶结构完整、肝索排列整齐、肝细胞以中央静脉为中心呈放射状排列。结论:不同剂量甘草次酸长期灌胃对大鼠肝功能及肝脏组织形态无显著影响,但长期用药可因其免疫抑制作用而致球蛋白降低。
18β-甘草次酸;肝功能;肝脏组织形态;动物;大鼠
甘草属豆科植物,性平味甘,有祛痰止咳、补脾益气、清热解毒、调和诸药之功效,可与金银花、连翘等配伍用于痈疽疮疡、咽喉肿痛;与白术、党参等配伍成理中丸,用于脾气虚;与黄精、白芷等配伍成黄白甘草汤,用于脾虚血燥型剥脱性唇炎[1];与芍药等配伍,用于风热型过敏性紫癜等[2];与黄芪、党参及白术等药物配伍制成加味玉屏风散,用于脾肺虚寒型变应性鼻炎等[3]。此外,甘草还具有调和之效,能缓解大黄、芒硝等烈性药对胃肠道的强烈刺激。甘草的有效成分甘草酸在体内水解掉2分子葡萄糖醛酸后形成甘草次酸[4]。甘草次酸有良好的生理活性、生物相容性和较低的不良反应,具有抗炎、抗过敏、抗病毒、抗溃疡、抗氧化、降血脂、镇咳、改善胰岛素抵抗以及免疫调节等多种药理作用[5-9]。随着临床推广和研究深入,甘草次酸的不良反应也得到重视。这方面的报道多见于长期或大量服用甘草酸制剂产生的肾上腺盐皮质样副作用如水钠潴留、高血压等,而长期大剂量甘草次酸灌胃对正常大鼠肝功能以及对肝脏组织形态的影响尚未见报道。本研究通过不同剂量甘草次酸长期灌胃,观察其对大鼠肝脏形态及功能的影响,为甘草次酸的安全剂量及用药周期提供实验依据。
1 材料与方法
1.1 动 物
健康Wistar大鼠120只,体质量180~220 g,由甘肃中医学院SPF动物中心提供,动物质量编号:SCXK(甘)2011-0001。
1.2 试剂与仪器
18β-甘草次酸,500 g/袋,AR级,甘肃泛植生物科技有限公司产品,批号12081603。OLYMPUS AU2700全自动生化分析仪,产地日本。
1.3 动物分组
将大鼠随机分为正常对照组、甘草次酸低剂量组(25 μg/g)、中剂量组(50 μg/g)和高剂量组(100 μg/g)4组,每组30只。
1.4 给药干预
按照动物体表面积转换计算公式[10]计算给药量。本实验中,大鼠体质量在180~220 g,按平均值200 g计算。甘草次酸组参照复方甘草酸苷片临床用量(每片含甘草酸25 mg,3片/次,3次/日,每日甘草酸总用量225 mg)。低、中、高剂量组每日给药剂量分别为25,50,100 μg/g ,混于2 mL生理盐水灌胃;正常对照组以等量生理盐水替代。
1.5 检测指标
分别于给药6周、14周、22周、30周及停药4周,每组随机取6只大鼠,100 g/L 水合氯醛(3 μL/g)腹腔注射麻醉,剪毛、打开胸腔;心脏采血后立即以40 g/L多聚甲醛50 mL快速心脏灌注;随即打开腹腔, 取出肝脏,称量质量并计算脏器指数;以100 g/L 甲醛4 ℃固定24 h,梯度乙醇脱水、浸蜡、包埋、切片行HE染色;光镜下观察组织的病理形态学变化。
采用兰州大学第一医院检验科OLYMPUS AU2700全自动生化分析仪检测不同时间点各组大鼠血清天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、清蛋白、球蛋白、总蛋白、总胆红素及碱性磷酸酶等肝功能相关指标的变化。
1.6 统计学方法
2 结 果
2.1 各组大鼠AST、ALT含量对比
2.1.1 血清AST
给药6周时,甘草次酸低、中、高剂量组AST含量与正常对照组对比差别无统计学意义(P>0.05),3个剂量组之间的差别亦无统计学意义(P>0.05)。此后,随着干预时间的延长,在14周、22周、30周时间点,甘草次酸低、中、高剂量组AST含量有升高趋势,但较正常对照组仍无统计学意义(P>0.05)。停药4周,3个剂量组AST含量较同组30周时有下降趋势,但无统计学意义,各组间差别亦无统计学意义。见表1。
表1 各组大鼠血清AST含量对比
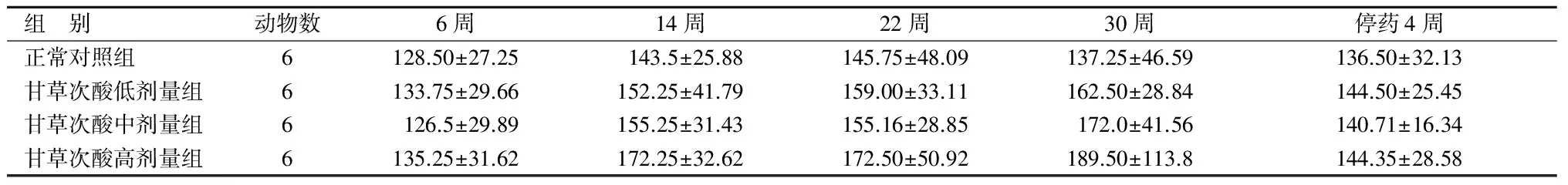
表1 各组大鼠血清AST含量对比
组 别动物数6周14周22周30周停药4周正常对照组6128.50±27.25143.5±25.88145.75±48.09137.25±46.59136.50±32.13甘草次酸低剂量组6133.75±29.66152.25±41.79159.00±33.11162.50±28.84144.50±25.45甘草次酸中剂量组6126.5±29.89155.25±31.43155.16±28.85172.0±41.56140.71±16.34甘草次酸高剂量组6135.25±31.62172.25±32.62172.50±50.92189.50±113.8144.35±28.58
2.1.2 血清ALT
在各时间点,甘草次酸低、中、高剂量组血清ALT含量组间对比,差别均无统计学意义(P>0.05);甘草次酸3个剂量组分别与相应时间点的正常对照组对比,差别亦无统计学意义(P>0.05)。见表2。
表2 各组大鼠血清ALT含量对比

表2 各组大鼠血清ALT含量对比
组 别动物数6周14周22周30周停药4周正常对照组646.17±12.3450.50±16.4353.5±15.7850.25±18.82 47.0±17.19甘草次酸低剂量组641.0±14.7852.0±24.5958.17±29.5751.50±37.5045.50±10.03甘草次酸中剂量组643.33±10.8651.33±14.9856.67±14.6758.50±21.9255.43±7.09甘草次酸高剂量组644.20±16.2754.17±20.4559.33±17.5259.0±13.0257.83±14.91
2.2 各组大鼠血清蛋白含量对比
2.2.1 血清总蛋白
在6周、14周、22周各时间点,甘草次酸低、中、高剂量组组间血清总蛋白含量对比,差别均无统计学意义(P>0.05)。给药30周,甘草次酸3个剂量组血清总蛋白均低于正常对照组(P<0.05)。停药4周后,3个剂量组总蛋白有所回升、但仍低于正常对照组,差别有统计学意义(P<0.05);3个剂量组之间对比,差别无统计学意义(P>0.05)。见表3。
表3 各组大鼠血清总蛋白含量对比

表3 各组大鼠血清总蛋白含量对比
组 别动物数6周14周22周30周停药4周正常对照组671.90±5.6473.73±4.2470.93±4.7771.2±6.4172.8±2.24甘草次酸低剂量组670.40±3.7770.55±2.4568.24±4.2060.20±3.83∗64.65±5.06∗甘草次酸中剂量组670.85±1.3871.42±4.1270.02±6.8663.05±4.25∗65.70±5.16∗甘草次酸高剂量组669.58±3.4170.45±3.7870.11±4.8462.27±2.67∗62.57±2.96∗
注:与正常对照组对比,*P<0.05。
2.2.2 血清清蛋白
在各个观测时间点,各组间血清清蛋白含量对比,差别均无统计学意义(P>0.05)。见表4。
表4 各组大鼠血清清蛋白含量对比

表4 各组大鼠血清清蛋白含量对比
组 别动物数6周14周22周30周停药4周正常对照组635.78±5.9837.60±3.1436.27±2.7835.70±5.2436.40±1.12甘草次酸低剂量组635.33±2.7636.47±1.5935.98±3.6434.28±1.8434.77±0.96甘草次酸中剂量组634.13±1.3036.85±1.3536.55±3.0934.98±2.0135.76±2.74甘草次酸高剂量组635.18±1.6236.37±0.8437.32±1.3534.68±1.4434.52±0.43
2.2.3 血清球蛋白
在给药6周、14周及22周,各组间血清球蛋白含量对比,差别均无统计学意义(P>0.05)。 给药30周,甘草次酸低、中、高剂量组血清球蛋白含量均低于正常对照组,差别有统计学意义(P<0.05)。在停药4周,3个剂量组血清球蛋白较前无显著变化、仍低于正常对照组;3组之间差别无统计学意义(P>0.05)。见表5。
表5 各组大鼠血清球蛋白含量对比

表5 各组大鼠血清球蛋白含量对比
组 别动物数6周14周22周30周停药4周正常对照组636.13±1.8335.27±3.7234.67±2.4935.5±2.8036.40±1.12低剂量组635.07±1.9234.08±3.8436.86±1.4327.43±2.78∗29.88±4.85∗中剂量组636.72±2.6134.58±3.7836.47±2.5528.07±2.41∗29.94±4.45∗高剂量组634.40±3.4134.08±3.0835.46±2.3227.58±2.0∗28.05±2.78∗
注:与正常对照组对比,*P<0.05。
2.3 各组大鼠血清总胆红素和碱性磷酸酶含量对比
2.3.1 血清总胆红素
在各时间点,各组间血清总胆红素对比,差别均无统计学意义(P>0.05)。同一个剂量组在不同时间点的对比亦无统计学意义(P>0.05)。见表6。
表6 各组大鼠血清总胆红素含量对比

表6 各组大鼠血清总胆红素含量对比
组 别动物数6周14周22周30周停药4周正常对照组61.37±0.761.28±0.671.16±0.921.45±0.791.55±0.56甘草次酸低剂量组61.54±10.591.23±0.991.92±0.801.98±0.551.75±0.80甘草次酸中剂量组61.31±0.451.35±1.241.38±0.721.80±1.241.73±0.61甘草次酸高剂量组61.46±1.071.14±0.432.03±0.682.08±0.471.96±0.43
2.3.2 血清碱性磷酸酶
在各时间点,各组间碱性磷酸酶对比,差别均无统计学意义(P>0.05)。同一个剂量组在不同时间点的对比亦无统计学意义(P>0.05)。见表7。
表7 各组大鼠血清碱性磷酸酶含量对比
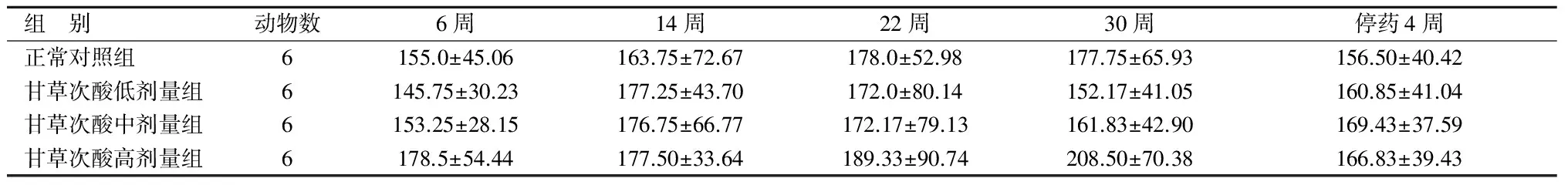
表7 各组大鼠血清碱性磷酸酶含量对比
组 别动物数6周14周22周30周停药4周正常对照组6155.0±45.06163.75±72.67178.0±52.98177.75±65.93156.50±40.42甘草次酸低剂量组6145.75±30.23177.25±43.70172.0±80.14152.17±41.05160.85±41.04甘草次酸中剂量组6153.25±28.15176.75±66.77172.17±79.13161.83±42.90169.43±37.59甘草次酸高剂量组6178.5±54.44177.50±33.64189.33±90.74208.50±70.38166.83±39.43
2.4 各组大鼠肝脏脏器指数变化对比
在各时间点,甘草次酸3个剂量组大鼠肝脏组织肉眼观察未见明显改变,肝脏脏器指数与正常对照组对比,差别无统计学意义(P>0.05)。在同一观测时间点上,低、中、高3个剂量组之间两两比较,差别亦无统计学意义(P>0.05)。见表8。
表8 各组大鼠肝脏脏器指数变化对比

表8 各组大鼠肝脏脏器指数变化对比
组 别动物数6周14周22周30周停药4周正常对照组64.91±0.454.94±0.585.10±0.565.25±0.975.17±0.89甘草次酸低剂量组65.42±1.045.57±1.025.72±0.676.03±0.795.91±1.13甘草次酸中剂量组65.44±0.665.36±0.765.84±0.366.21±1.035.89±0.69甘草次酸高剂量组65.75±1.125.65±0.875.98±0.796.11±0.796.14±0.86
2.5 各组大鼠肝脏组织形态学改变
正常对照组大鼠肝脏切片HE染色光镜下可见:肝细胞以中央静脉为中心向周围呈放射状排列,肝小叶结构完整,肝窦清晰,肝索排列整齐,肝细胞完整、排列规则(图1)。给药6周时,甘草次酸低、中、高剂量组肝脏组织HE染色见肝小叶结构清晰完整,肝索排列整齐,无炎性细胞浸润,无纤维增生,无细胞水肿,门管区小叶间动脉、小叶间静脉及小叶间胆管结构完整无扩张(图2a~2c)。此后,随着甘草次酸的持续干预,在14周及22周时间点,3个剂量组大鼠肝脏组织形态无明显变化(图3a~3c,图4a~4c)。直至给药终点(第30周),低、中、高剂量组肝脏未见显著病理改变,肝小叶结构完整清晰,肝索排列整齐,肝细胞以中央静脉为中心呈放射状排列,门管区内小叶间动脉,小叶间静脉和小叶间胆管规则(图5a~5c)。停药4周后,低、中、高剂量组肝脏组织形态学观察与正常对照组无显著差异:肝小叶完整,肝索排列整齐,肝细胞形态完整、以中央静脉为中心呈放射状排列(图6a~6c)。

图1 肝脏组织(HE,×200)
3 讨 论
18β-甘草次酸的五环三萜结构使其具有糖皮质激素样作用而无严重不良反应,因此被广泛应用于临床,如用于各种急慢性肝炎、肝纤维化、肝癌等疾病。此外,它还具有防癌、抗癌、诱导干扰素、调节细胞免疫等作用[11]。甘草次酸的类激素样作用通过两个途径实现:甘草次酸作为甾体激素代谢失活酶抑制剂,可抑制Ⅰ型11β-羟化甾体脱氢酶(Ⅰ型11β-HSD)、Ⅱ型11β-HSD、3HSD及17HSD等,使体内皮质激素代谢减少从而提高内源性和外源性皮质激素的含量[5,12-13];此外,由于甘草次酸具有类似于甾体激素的化学结构,故可作为配体直接与皮质激素受体结合[5,14-15]。
机体内多个脏器组织均存在甘草次酸的特异性结合位点,肝脏的甘草次酸结合位点活性最高,甘草次酸与肝细胞膜上该位点的结合具有高度特异性及可饱和性[16],此是甘草次酸用于临床多种肝脏疾病治疗的结构基础。Rahman[17]以醋酸铅诱导建立肝癌大鼠模型,发现甘草酸可显著降低AST和ALT等转氨酶水平,并提高还原型谷胱甘肽及其相关酶类的水平。Kazuk等[18]报道了甘草酸可显著抑制LPS和D-半乳糖苷两种小鼠肝损伤模型中ALT和AST的增加。Lee等[19]发现在小鼠四氯化碳肝损伤模型中,甘草次酸可显著降低血清转氨酶、TNF-α及丙二醛水平。
在肝脏疾病治疗中,甘草次酸改善肝功能、降低转氨酶及升高清蛋白的疗效已得到大量的实验验证及临床病例证实。基于甘草次酸的肝脏靶向特点,可以推测甘草次酸对正常大鼠肝细胞也可能产生保护作用或不良反应,甚至毒副作用。本实验给正常大鼠以甘草次酸灌胃,在加大甘草次酸剂量(正常剂量的5倍、10倍、20倍)及延长用药时间(30周)双因素作用下,血清转氨酶、清蛋白、碱性磷酸酶及胆红素未见显著升高;用药至30周时,各组间ALT水平差别仍无统计学意义,AST有小幅度上升(最高值:30周时高剂量组为189.50±113.88 U/L),但与正常对照组(137.25±46.59U/L)对比,差别无统计学意义,尚可认为转氨酶无显著升高。而 AST的升高趋势,推测是由于甘草次酸促进了肝细胞线粒体的渗透转运,线粒体中的AST释放至胞质。Salvi[20]报道甘草次酸可导致肝细胞线粒体肿胀、渗透性转变,线粒体内细胞色素c及凋亡诱导因子释放;此后该作者还报道了甘草次酸的衍生物甘珀酸同样具有类似作用[21]。Cristina等人通过大鼠肝细胞线粒体体外干预试验发现:甘草次酸通过与线粒体呼吸链相互作用、产生过氧化氢并氧化硫醇基和内源性嘧啶核苷酸,从而导致线粒体过渡孔开放,推测是甘草次酸C-11位上的羧基与线粒体复合物I的F/S中心相结合,形成一个以氧为中心的自由基而产生促氧化反应。
本实验结果显示:血清清蛋白未见明显变化,但血清球蛋白具有降低趋势,即在6周、14周及22周时,均可观察到甘草次酸干预组较正常对照组减低,但差别尚无统计学意义;而在用药30周后干预组球蛋白水平显著低于正常对照组;即使停药4周后,这种差异仍然显著、具有统计学意义。血清总蛋白的变化与球蛋白相一致。球蛋白由淋巴细胞产生,包括免疫球蛋白和补体、多种糖蛋白、金属结合蛋白、多种脂蛋白及酶类,一般可分为α1、α2、β、γ 4种成分。球蛋白与机体免疫功能、血浆黏度密切相关。Haggag[22]发现甘草的提取物甘草酸可显著抑制小鼠哮喘模型中IgE的表达、减少组胺释放。Kimura[23]报道了β-甘草次酸对补体活化的直接抑制作用并降低循环免疫复合物水平。在本研究中,给药至22周时球蛋白尚无显著降低,直至给药30周时才明显低于正常对照组,这与长期应用肾上腺皮质激素所导致的球蛋白合成减少一致,也侧面显示了甘草次酸的类肾上腺皮质激素样作用,提示在长期的治疗过程中应注意其免疫抑制作用可能会导致球蛋白低于正常值而影响机体的免疫功能。
本实验中,各组间大鼠肝脏组织未见明显的形态学差异,至用药30周时,甘草次酸低、中、高剂量组肝索排列整齐规则,肝小叶结构尚清晰,肝细胞完整、无水肿及坏死,门管区小叶间动脉、小叶间静脉和小叶间胆管管腔无扩张或狭窄,管壁无水肿。结合肝脏组织形态及肝功能指标的表现,可以认为在30周给药时间内给予较大剂量(25 μg/g,50 μg/g,100 μg/g)甘草次酸灌胃对大鼠肝功能及肝脏组织形态无显著毒副作用,提示甘草次酸的用药剂量及用药时间有较大的安全空间可供选择。但需要重视的是:个体对甘草次酸的敏感性差异很大。Stφrmer[24]报道:在健康人群中,对甘草次酸敏感性高者每日口服100 mg甘草次酸即可出现不良反应,而大多数人每日口服量达400 mg仍无明显异常表现。
虽然本实验尚未发现甘草次酸对正常大鼠肝脏的明显毒副作用,但大剂量甘草次酸引起全身其他脏器损害的报道较多见,如肾损害、高血压、水钠潴留及低钾血症等[25-26]。为进一步了解甘草次酸的不良反应,需结合个体敏感性、全身各脏器组织形态及功能进行综合评估,为临床用药提供更详实、可靠的数据支持,以期充分发挥祖国传统医药的优势,开发其巨大的药用潜质。
[1]段渠,李俊仪,程宏斌.黄白甘草汤外用治疗脾虚血燥型剥脱性唇炎疗效观察[J].四川中医,2013,31(1): 113-115.
[2]周继福.加味芍药甘草汤辨证治疗过敏性紫癜[J].现代中西医结合杂志,2010,19(30): 3266-3267.
[3]雒焕文.加味玉屏风散治疗脾肺虚寒型变应性鼻炎 60 例[J].中医研究,2012,25(5): 35-36.
[4]Ploeger B,Mensinga T,Sips A,et al.The pharmacokinetics of glycyrrhizic acid evaluated by physiologically based pharmacokinetic modeling[J].Drug Metab Rev,2001,33(2):125-147.
[5]Asl MN,Hosseinzadeh H.Review of pharmacological effects of Glycyrrhiza sp.and its bioactive compounds[J].Phytotherapy Research,2008,22(6): 709-724.
[6]Dzubak P,Hajduch M,Vydra D,et al.Pharmacological activities of natural triterpenoids and their therapeutic implications[J].Natural product reports,2006,23(3): 394-411.
[7]Ploeger BA,Meulenbelt J,Dejongh J.Physiologically based pharmacokinetic modeling of glycyrrhizic acid,a compound subject to presystemic metabolism and enterohepatic cycling[J].Toxicology and applied pharmacology,2000,162(3): 177-188.
[8]Eu CH,Lim WY,Ton SH,et al.Glycyrrhizic acid improved lipoprotein lipase expression,insulin sensitivity,serum lipid and lipid deposition in high-fat diet-induced obese rats[J].Lipids Health Dis,2010(9): 81.
[9]Ming LJ,Yin AC.Therapeutic effects of glycyrrhizic acid[J].Natural product communications,2013,8(3): 415-418.
[10]徐平,实验动物管理与使用操作技术规程[M].上海: 上海科学技术出版社,2007.
[11]Arjumand W,Sultana S.Glycyrrhizic acid: A phytochemical with a protective role against cisplatin-induced genotoxicity and nephrotoxicity[J].Life Sci,2011,89(13/14): 422-429.
[12]Baker ME.Licorice and enzymes other than 11β-hydroxysteroid dehydrogenase: an evolutionary perspective[J].Steroids,1994,59(2):136-141.
[13]Shibata S.A drug over the millennia: pharmacognosy,chemistry,and pharmacology of licorice[J].Yakugaku Zasshi,2000,120(10): 849-862.
[14]Satko SG,Burkart JM.Hypokalemia associated with herbal tea ingestion[J].Nephron,2001,87(1): 97-98.
[15]Baker ME.Endocrine activity of plant-derived compounds: an evolutionary perspective[J].Proc Soc Exp Biol Med,1995,208(1): 131-138.
[16]Negishi M,Irie A,Nagata N,et al.Specific binding of glycyrrhetinic acid to the rat liver membrane[J].Biochimica et Biophysica Acta (BBA)-Biomembranes,1991,1066(1): 77-82.
[17]Rahman S,Sultana S.Chemopreventive activity of glycyrrhizin on lead acetate mediated hepatic oxidative stress and its hyperproliferative activity in Wistar rats[J].Chem Biol Interact,2006,160(1): 61-69.
[18]Abe K,Ikeda T,Wake K,et al.Glycyrrhizin prevents of lipopolysaccharide/D-galactosamine‐induced liver injury through down-regulation of matrix metalloproteinase-9 in mice[J].Journal of Pharmacy and Pharmacology,2008,60(1): 91-97.
[19]Lee CH,Park SW,Kim YS,et al.Protective mechanism of glycyrrhizin on acute liver injury induced by carbon tetrachloride in mice[J].Biological and Pharmaceutical Bulletin,2007,30(10): 1898-1904.
[20]Salvi M,Fiore C,Armanini D,et al.Glycyrrhetinic acid-induced permeability transition in rat liver mitochondria[J].Biochemical pharmacology,2003,66(12): 2375-2379.
[21]Salvi M,Fiore C,Battaglia V,et al.Carbenoxolone induces oxidative stress in liver mitochondria,which is responsible for transition pore opening[J].Endocrinology,2005,146(5): 2306-2312.
[22]Haggag EG,Abou-Moustafa MA,Boucher W,et al.The effect of a herbal water-extract on histamine release from mast cells and on allergic asthma[J].Journal of Herbal Pharmacotherapy,2003,3(4): 41-54.
[23]Kimura M,Inoue H,Hirabayashi K,et al.Glycyrrhizin and some analogues induce growth of primary cultured adult rat hepatocytes via epidermal growth factor receptors[J].Eur J Pharmacol,2001,431(2): 151-161.
[24]Stφrmer FC,Reistad R,Alexander J.Glycyrrhizic acid in liquorice-evaluation of health hazard[J].Food and Chemical Toxicology,1993,31(4): 303-312.
[25]Sontia B,Mooney J,Gaudet L,et al.Pseudohyperaldosteronism,liquorice,and hypertension[J].The Journal of Clinical Hypertension,2008,10(2): 153-157.
[26]Francini-Pesenti F,Puato M,Piccoli A,et al.Liquorice‐induced hypokalaemia and water retention in the absence of hypertension[J].Phytotherapy Research,2008,22(4): 563-565.
(编辑 陶 珠)
1001-6910(2015)01-0062-06
R285.5
B
10.3969/j.issn.1001-6910.2015.01.32
张小兵,教授,主任医师,790736924@qq.com
国家自然科学基金项目(81160449)
2014-09-01;
2014-11-24
