甲状腺癌胸腺样分化1例并文献复习
2015-06-01刘晓航周良平
刘 伟,刘晓航,周良平
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
·晓航读片窗·
甲状腺癌胸腺样分化1例并文献复习
刘 伟,刘晓航,周良平
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
资料
患者,男性,33岁。1月余前体检于甲状腺下极触及一软组织肿块,当地医院穿刺提示左侧甲状腺癌可能,建议手术治疗,遂至我院就诊。查体发现:患者一般情况尚可,左侧甲状腺下极可及3 cm左右、质地中等偏硬肿块,肿块底部未能触及,右侧甲状腺及双侧颈部未触及明显肿大淋巴结。遂行超声、CT和MRI检查。
超声检查结果:左侧甲状腺、左侧气管食管沟巨大肿块约5.0 cm×5.0 cm,无完整包膜,侵犯食管和左侧气管软骨部和膜部,左侧喉返神经完全被肿瘤包绕,无法分离,侵犯左侧甲状腺。肿块与左甲状腺下极及食管分界不清。
CT检查结果(图1):气管旁左侧甲状腺后方可见软组织密度影,由气管旁左侧甲状腺下极延伸至气管食管沟,病变与左侧甲状腺分界不清,上胸段食管腔及气管明显受压变窄,增强后可见中度强化。
MRI检查结果(图2):左侧下颈部甲状腺后下方可见异常信号占位,向下延伸至上纵隔内,为35 mm×38 mm×53 mm,呈T1WI等信号,T2WI略高信号,信号尚均匀,增强后可见不均匀强化征象。相邻气管可见受压推移,肿块与食管和左侧甲状腺分界不清。左侧颈内动脉可见推移。
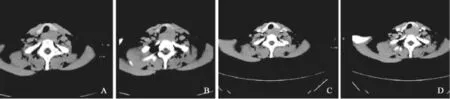
图1 甲状腺癌胸腺样分化CT表现A、B:平扫,可见气管旁左侧甲状腺后方软组织密度肿块,延伸至气管后方,病变与左侧甲状腺分界不清,CT值约48 HU;C、D:病变增强扫描,CT值约78 HU,明显低于正常甲状腺组织
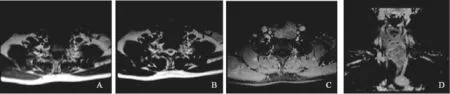
图2 甲状腺癌胸腺样分化MRI表现A、B:T1WI及T2WI图像,示左侧气管食管沟及左侧甲状腺后方肿块,向右压迫气管,病变在T1WI呈等信号,T2WI呈略高信号;C:横断位早期图像,显示病变中度强化;D:冠状位增强延迟期,病变可见延迟强化
手术及病理结果:患者于我院行甲状腺癌根治术并颈部淋巴结清扫。病理结果:左甲腺叶、胸骨后肿块伴有胸腺样分化的甲状腺癌,肿瘤大小分别为5.0 cm×4.0 cm×3.7 cm、2.2 cm× 1.7 cm×1.0 cm。送检淋巴结见癌累及(3/35),其中左Ⅵ区淋巴结见癌转移(2/2)、带状肌胸锁乳突肌间淋巴结未见癌转移(0/1)、颈上淋巴结未见癌转移(0/20)、颈中淋巴结未见癌转移(0/3)、颈下淋巴结见癌转移(1/9)。
讨论
甲状腺内上皮样胸腺瘤(intrathyroidal epithelial thymoma,ITET)亦称甲状腺呈胸腺样分化癌(carcinoma showing thymus-like differentiation,CASTLE),是发生于甲状腺内类似胸腺淋巴上皮样和鳞状细胞样癌的恶性肿瘤。于1985年由Miyauchi 等首次报道,并描述为甲状腺内的上皮样胸腺瘤[1]。2004版世界卫生组织(World Health Organization,WHO)将CASTLE作为甲状腺独立肿瘤纳入分类,并定义为类似于胸腺上皮性肿瘤结构的甲状腺癌。CASTLE比较罕见,发病率低,占所有甲状腺癌的0.1%~0.15%。迄今为止,国内外文献报道少于100例,其中约半数在中国[2]。对其组织学发生,越来越多的研究支持来自异位胸腺和腮囊残余组织。即从下颌骨至胸骨柄均可遗留异位胸腺组织,导致CASTLE的发生[3],但以甲状腺内较为常见,尤其是甲状腺的下极。目前研究认为,CASTLE是一种低度恶性并具有惰性生物学行为和良好预后的肿瘤[4]。
临床上,CASTLE多累及中年人,女性发病率稍高(男女比为1∶1.3)。大多数患者以颈部无痛性肿块就诊,质地中等偏硬,常呈分叶状,大多界限清楚,通常为逐渐性或缓慢性增大。病灶通常累及单侧甲状腺,且多位于甲状腺的下极,可向甲状腺外周组织及周围 淋巴结侵犯[5-6],导致部分患者伴有声音嘶哑(多由于肿块侵犯喉返神经所致)、干咳、局部不适或略有隐痛感,少见吞咽困难及呼吸困难症状。
在影像学检查中,超声检查提示病灶为分叶状实体的非钙化肿块,内部回声不均匀,中等血流信号。CT检查多显示甲状腺下极分叶状软组织密度样肿块,边界相对清晰。MRI上,病灶多为T1WI低或等信号,T2WI高信号,CT与MRI增强检查显示轻至中度强化。发射型计算机断层扫描(emission computed tomography,ECT)为冷结节。尽管影像学表现也不具特征性,但影像诊断医师对于一个位于甲状腺下极的实性结节或肿块,需考虑是否有CASTLE的可能性[7-8]。CASTLE临床症状不典型,影像学检查特异性低,术前较难作出正确诊断,其细胞学检查常被误诊为甲状腺其他类型的恶性肿瘤[3]。目前,根据Ito等[5]及Nakagawa等[9]报道,CD5是CASTLE诊断与鉴别诊断中最常用的免疫标记,CD117亦有一定的特异性,p63在CASTLE中也有广泛表达,因此联合检查CD5、CD117及p63可提高对CASTLE的诊断准确率[10]。此外,CASTLE还不同程度表达角蛋白19(cytokeratin 19,CK19)、CK(H)、癌胚抗原(carcinoembryonic antigen,CEA)、突触素(synaptophysin,Syn)等,而甲状腺转录因子1(thyroid transcription factor 1,TTF-1)、甲状腺球蛋白(thyroglobulin,TG)、降钙素(calcitonin,CT)、S-100等常呈阴性表达。肿瘤组织学特点多呈膨胀性生长,也可浸润性生长,被厚薄不一的纤维组织分割成大小及形状不一的细胞索或细胞巢;肿瘤细胞呈梭形或多边形,多形性不明显,细胞境界不清,排列紧密,呈合体细胞样,胞质淡染;间质内有淋巴细胞、浆细胞浸润,胞核较大,淡染空泡状,核仁易见,胞核呈轻中度异型,核分裂象较少见。
CASTLE的诊断主要依靠病理和免疫组化,但影像学手段对CASTLE的诊断仍有一定的提示价值。复习相关文献[7,11],结合本例,笔者认为CASTLE影像学表现通常为发生在甲状腺下极的低密度软组织肿块影,T1WI呈现低或等信号,T2WI高信号,多为单发,常呈分叶状,边界清晰,可向下延伸至纵隔后,侵犯周围组织,包绕气管、颈部血管神经,累及颈部淋巴结;增强显示轻至中度强化。若发生在甲状腺左叶下极,则提示为本病的可能性更高。本病在影像学上需与其他发生于软组织的常见良恶性肿瘤相鉴别:①甲状腺腺瘤:CT表现为圆形、类圆形较均匀的低密度影,境界清晰,增强显示不强化或轻度强化;在MRI上表现为T1WI上呈境界清楚的低、等或高信号结节,滤泡型腺瘤因胶样物质多而呈现高信号,T2WI上病灶显示为高信号。② 甲状腺癌:单发多见,约半数CT表现为形态不规则的不均匀低密度影,边缘不光整,其内可见散在钙化和更低密度囊变坏死区,病灶与周围组织分界不清晰,常有颈部淋巴结肿大,增强显示不均匀明显强化;在MRI上表现为T1WI境界不清的不规则低、中等信号,T2WI上病灶显示为高信号。
CASTLE预后相对较好,治疗主要以手术切除为主,术式建议全切或次全切。如术后见残余甲状腺组织显影,可采取常规保守的131I清除残余甲状腺组织治疗。但需要注意的是,CASTLE对化疗不敏感。CASTLE的诊断以病理结果为标准,主要采用免疫组化检查与甲状腺其他疾病进行鉴别,影像学的表现对其定性无帮助,但CT、MRI可清晰显示肿瘤的部位、大小、轮廓、范围、信号特点及与周围组织结构的关系,对病灶的定位、分级及分期有一定的价值。此外,影像学检查还作为其术后常规随访的首要手段[11]。综上所述,在CASTLE诊断过程中,影像学检查起到提示的作用,免疫组化用于鉴别诊断,病理切片确诊。
[1]MIYAUCHI A, KUMA K, MATSUZUKA F, et al. Intrathyroidal epithelial thymoma: an entity distinct from squamous cell carcinoma of the thyroid [J]. World J Surg, 1985, 9(1): 128-135.
[2]HUANG C, WANG L, WANG Y, et al. Carcinoma showing thymus-like differentiation of the thyroid (CASTLE) [J]. Pathol Res Pract, 2013, 209(10): 662-665.
[3]达小萍, 申健, 葛丽艳. 甲状腺显示胸腺样分化癌临床病理观察 [J]. 诊断病理学杂志, 2015, 21(5): 48-50.
[4]LIU Z, TENG X Y, SUN D X, et al. Clinical analysis of thyroid carcinoma showing thymus-like differentiation: report of 8 cases [J]. Int Surg, 2013, 98(2): 95-100.
[5]ITO Y, MIYAUCHI A, NAKAMURA Y,et al. Clinicopathologic significance of intrathyroidal epithelial thymoma/carcinoma showing thymus-like differentiation: a collaborative study with Member Institutes of The Japanese Society of Thyroid Surgery [J]. Am J Clin Pathol, 2007, 127(2): 230-236.
[6]SUN T, WANG Z, WANG J, et al. Outcome of radical resection and postoperative radiotherapy for thyroid carcinoma showing thymus-like differentiation [J]. World J Surg, 2011, 35(8): 1840-1846.
[7]YONEDA K, MATSUI O, KOBAYASHI T, et al. CT and MRI findings of carcinoma showing thymus-like differentiation [J]. Radiat Med, 2005, 23(6): 451-455.
[8]AHUJA A T, CHAN E S, ALLEN P W, et al. Carcinoma showing thymus-like differentiation (CASTLE tumor) [J]. AJNR Am J Neuroradiol, 1998, 19(7): 1225-1228.
[9]NAKAGAWA K, MATSUNO Y, KUNITOH H, et al. Immunohistochemical KIT (CD117) expression in thymic epithelial tumors [J]. Chest, 2005, 128(1): 140-144.
[10]HUANG C, WANG L, WANG Y, et al. Carcinoma showing thymus-like differentiation of the thyroid (CASTLE) [J]. Pathol Res Pract, 2013, 209(10): 662-665.
[11]巴雅, 郭勇, 秦永德, 等. 胸腺样分化甲状腺癌的循证诊断与治疗 [J]. 中国循证医学杂志, 2011, 11(3): 350-353.
R445.2; R445.3
A
1008-617X(2015)04-0271-03
2015-11-30)
