SPATA22基因多态性与中国汉族非梗阻性无精子症的易感性关联分析
2015-06-01贺小进杜卫东曹云霞
查 醒,贺小进,2,宋 兵,杜卫东,张 妍,阮 健,吴 欢,曹云霞,2
SPATA22基因多态性与中国汉族非梗阻性无精子症的易感性关联分析
查 醒1,贺小进1,2,宋 兵1,杜卫东3,张 妍3,阮 健3,吴 欢1,曹云霞1,2
目的探讨精子发生相关基因22(SPATA22)基因的7个标签单核苷酸多态性(SNP)位点多态性与中国汉族非梗阻性无精子症(NOA)的易感性的相关性。方法选取368例已生育的男性(对照组)和361例NOA患者(病例组),应用Sequenom MassArray质谱阵列技术检测对照组和病例组SPATA22基因7个标签SNPs的基因型。应用Plink 1.07软件及Haploview软件对数据资料进行统计分析,比较对照组与病例组SPATA22基因的最小等位基因频率(MAF)基因型及单体型的差异。结果SPATA22基因7个标签SNPs的MAF、基因型及单体型在对照组与病例组间差异无统计学意义(P>0.05)。结论SPATA22基因7个标签SNPs位点多态性与中国汉族男性NOA的易感性可能不相关。
不育症;非梗阻性无精子症;SPATA22基因;单核苷酸多态性
全球不孕症的患病率约为10%,其中男方因素约占一半[1]。目前多数男性不育发病机制尚不明确,称为特发性不育症[2]。非梗阻性无精子症(non -obstructive azoospermia,NOA)是临床上常见的、严重的不育症之一,虽然小部分NOA患者可通过卵细胞胞质内单精子注射(intracytoplasmic sperm injection,ICSI)获得自己的生物学后代,但ICSI绕过自然选择,一些遗传异常可能会传至子代[3-7]。因此,深入研究NOA的分子机制有利于子代人口健康。精子发生相关基因22(spermatogenesis associated 22,SPATA22)是在脊椎动物中新发现的一个保守基因,位于人类第17号染色体[8]。研究[8-10]证明,SPATA22基因是生殖细胞减数分裂早期的关键基因,其突变可导致不育症。SPATA22基因在精子发生过程中发挥重要作用,该研究探讨SPATA22基因多态性与中国汉族男性NOA发生的相关性。
1 材料与方法
1.1 病例资料选择2008年3月~2014年3月于安徽医科大学第一附属医院生殖医学中心男科门诊就诊的NOA患者361例作为病例组。入选标准:NOA患者均行≥3次精液离心检查,未见精子(参照第5版WHO人类精液分析技术手册)[11],行睾丸组织病理检查显示睾丸生精功能减退、阻滞或唯支持细胞综合征。排除标准:①染色体核型分析异常;②Y染色体微缺失;③附睾饱满或存在结节;④隐睾、睾丸炎、精索静脉曲张、腹股沟疝、输精管结扎等病史。选择同期有正常生育史,精液检查正常,排除生殖道疾病,因女方不孕因素就诊于我中心的男性共368例作为对照组。采集所有研究对象的外周静脉血3~4 ml,置于5 ml的EDTA抗凝管中,-80℃保存待统一测定。研究对象之间均无亲缘关系且均为汉族人。本研究获得安徽医科大学伦理委员会批准(2008035),且所有入选对象签署知情同意书。
1.2 实验方法
1.2.1 基因组DNA的提取和标准化 按照德国QIAGEN公司的基因组DNA提取试剂盒(51306)使用说明书进行操作,提取样本基因组DNA后电泳,检测浓度后,标准化至15~20 ng/μl,-80℃保存备用。
1.2.2 SNP点选择 本研究依据国际人类单倍体图计划网站(http://hapmap.ncbi.nlm.nih.gov/)提供的基因型,运用Haploview软件及前人研究筛选SPATA22基因7个标签SNPs,分别为:rs1488689、rs1488690、rs2171582、rs7209613、rs2291604、rs17822627、rs9901726。要求最小等位基因频率(minor allele frequency,MAF)≥0.05。PCR扩增及延伸产物由Sequenom MassArray Assay Designer 3.0软件设计并由Invitrogen(上海)基因技术有限公司合成,见表1。

表1 SPATA22基因7个SNPs位点引物序列
1.2.3 基因分型 利用Sequenom MassArray质谱阵列技术对7个标签SNPs位点进行基因分型。参考Han et al[12]报道的方法,具体步骤如下:利用多重PCR反应扩增DNA样本,进行单碱基延伸反应,将所得产物除去盐分,转移到384孔板的PCR仪上;采用基质辅助激光解吸质谱仪(MALDI-TOF MS)检测等位基因,用MassArray Typer软件分析质谱图[13-14]。
1.3 统计学处理应用Plink 1.07软件进行分析和质控,检测对照组和病例组数据是否符合Hardy-Weinberg平衡定律,7个标签SNPs位点的样本检测率均需>90%。比较病例组与对照组7个SNPs位点的等位基因频率,采用两独立样本t检验计算P值、95%可信区间(confidence interval,CI)、优势比(odds ratio,OR)以及分析7个标签SNPs位点的基因型。进一步利用Haploview软件分析7个标签SNPs位点的单体型。
2 结果
2.1 研究对象一般资料病例组双侧睾丸体积均显著小于对照组,差异有统计学意义(P<0.05),见表2。
表2 病例组与对照组一般临床资料(±s)

表2 病例组与对照组一般临床资料(±s)
项目对照组(n=368)病例组(n=361)P值体质量指数(kg/m2)23.01±3.1122.91±2.950.071右侧睾丸体积(ml)14.58±2.658.90±3.510.000左侧睾丸体积(ml)14.51±2.708.95±3.550.000精子浓度(×106/ml)85.84±53.45--前向运动精子(%)56.51±9.99--
2.2 SPATA22基因SNPs与NOA发病风险的关系SPATA22基因的7个标签SNPs位点的相关信息及MAF见表3,病例组与对照组间的各MAF分布差异无统计学意义(P>0.05)。进一步分析7个位点的基因型显示,病例组及对照组各位点基因型的分布差异亦无统计学意义(P>0.05),见表4。
2.3 SPATA22基因单体型分析分析7个标签SNPs位点的单体型,显示病例组和对照组之间差异无统计学意义(P>0.05),见表5。
3 讨论
至少有400种不同的基因参与男性精子发生过程。这些基因本身的变异或者其表达产物、功能的改变会影响男性正常精子生成,导致精子发生障碍[15]。研究[3-7]表明,基因突变或易感性在先天性男性不育中起着重要的作用,一些基因与男性精子发生障碍密切相关。减数分裂是配子形成过程的决定性事件,两性生殖细胞经过减数分裂形成单倍体配子细胞,才有胚胎的形成和发展。如果减数分裂过程受阻,常常会导致不孕或者非整倍体配子的出现[8]。同源染色体的配对、重组和联会是减数分裂的标志。研究[8-9]证明,SPATA22是减数分裂早期必不可少的关键基因,其突变可导致雄性和雌性生殖细胞中相应的转录物和蛋白的表达受限,两性生殖细胞的发育停滞在减数分裂早期并且逐渐丢失。从而致使减数分裂时期无法正常联会,DNA双螺旋的断裂修复受阻。La Salle et al[8]发现SPATA22基因调控的蛋白主要表达于精母细胞中,其转录物存在于整个睾丸发育过程中。使用N-乙基-N-亚硝基脲诱导SPATA22基因突变小鼠,显示雄性及雌性小鼠均出现了不孕不育的表型。雄性突变体小鼠表现为生精障碍以及完全的缺少精子细胞,突变小鼠减数分裂过程中染色体不联会情况增加,遗传重组位点减少。研究[9]显示,在SPATA22基因缺失的突变大鼠中,SPATA22蛋白调控着DNA断裂双链上RAD51蛋白参与的DNA修复过程受阻,其缺失引起了减数分裂重组的失败,导致了生精障碍。提示SPATA22基因突变可能与先天性雄性不育的发生相关。Aston et al[10]在2010年的一项对欧洲男性人群的全基因组SNP关联分析中检测了3个SPATA22基因的SNP位点(rs2291604、rs12602543、rs1488690),发现其变异可能与严重少精子症及NOA无关。但是在其他人群中尚无此研究。
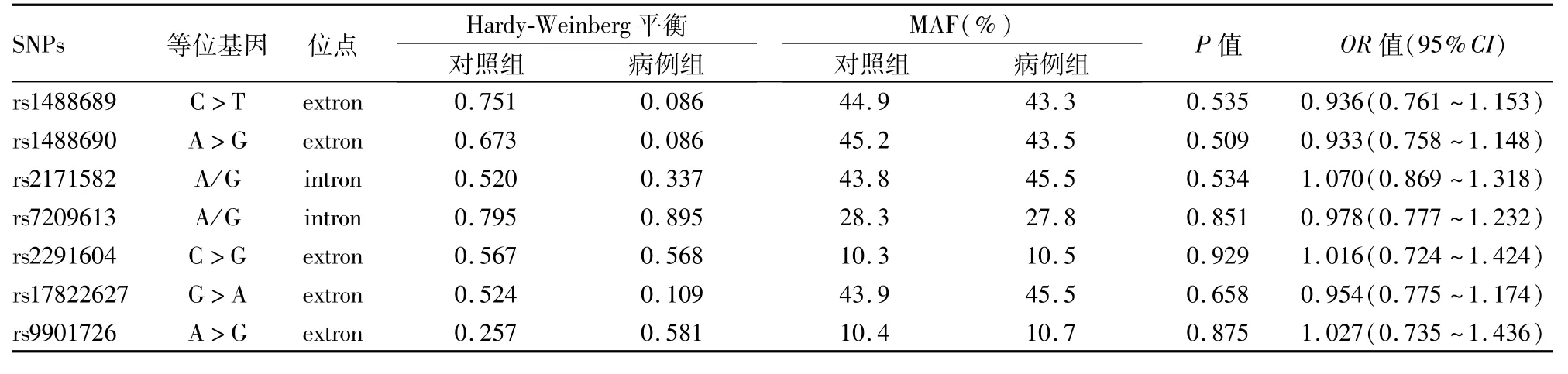
表3 SPATA22基因7个标签SNPs位点相关信息及MAF
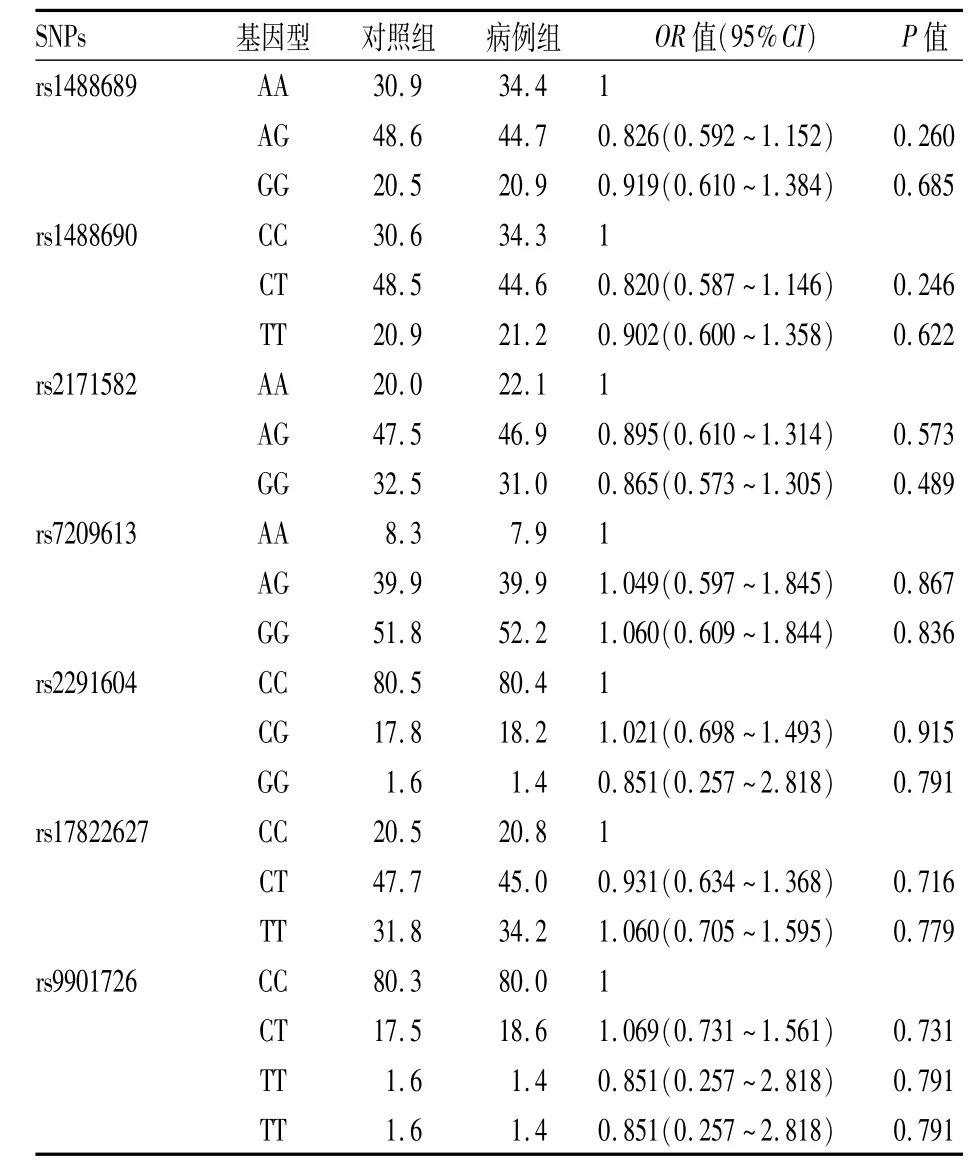
表4 病例组与对照组SPATA22基因7个标签SNPs位点基因型分析(%)
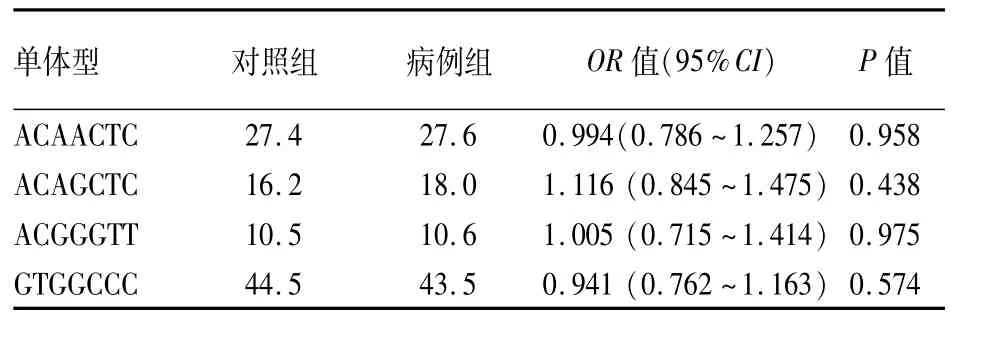
表5 SPATA22基因单体型分析(%)
本研究首次检测中国汉族NOA患者和正常生育对照者SPATA22基因7个标签SNPs(rs1488689、rs1488690、rs2171582、rs7209613、rs2291604、rs17822627、rs9901726)的基因型分布特点,结果显示所选取的7个标签SNPs与汉族男性NOA的易感性可能不相关。进一步的基因型及单体型分析也显示在病例组与对照组间差异无统计学意义,与研究[10]结果相似。推测可能的原因有:①NOA的发病机制十分复杂,SPATA22基因可能与本组实验的研究对象的发病无关;②本研究中选取的7个标签SNPs可能并没有覆盖到SPATA22基因真正易感的SNP位点;③在动物实验中可以获得诱导后的突变体,而在人类的研究中很难发现类似个体。
综上所述,SPATA22基因7个标签位点的多态性可能与中国汉族男性NOA的发生不相关。SPATA22基因与中国汉族男性NOA发生的关系以及发病中作用机制仍有待进行多中心、大样本、多种族的人群调查,以及长期前瞻性研究。可以研究SPATA22基因编码区和非编码区的直接测序、SPATA22表观遗传学特点以及深入的功能试验,进一步探索SPATA22在人类精子发生中的作用。
[1] Dyer S J.International estimates on infertility prevalence and treatment seeking:potential need and demand for medical care[J]. Hum Reprod,2009,24(9):2379-80.
[2] Nuti F,Krausz C.Gene polymorphisms/mutations relevant to abnormal spermatogenesis[J].Reprod Biomed Online,2008,16 (4):504-13.
[3] Hu Z,Xia Y,Guo X,et al.A genome-wide association study in Chinese men identifies three risk loci for non-obstructive azoospermia[J].Nat Genet,2011,44(2):183-6.
[4] He X J,Ruan J,Du W D,et al.PRM1 variant rs35576928(Arg >Ser)is associated with defective spermatogenesis in the Chinese Han population[J].Reprod Biomed Online,2012,25(6):627 -34.
[5] Ruan J,He X J,Du W D,et al.Genetic variants in TEX15 gene conferred susceptibility to spermatogenic failure in the Chinese Han population[J].Reprod Sci,2012,19(11):1190-6.
[6] He X J,Song B,Du W D,et al.CREM variants rs4934540 and rs2295415 conferred susceptibility to nonobstructive azoospermia risk in the Chinese population[J].Biol Reprod,2014,91(2):52.
[7] Song B,He X J,Du W D,et al.Genetic study of Hormad1 and Hormad2 with non-obstructive azoospermia patients in the male Chinese population[J].J Assist Reprod Genet,2014,31(7):873-9.
[8] La Salle S,Palmer K,O′Brien M,et al.SPATA22,a novel vertebrate-specific gene,is required for meiotic progress in mouse germ cells[J].Biol Reprod,2012,86(2):45.
[9] Ishishita S,Matsuda Y,Kitada K.Genetic evidence suggests that SPATA22 is required for the maintenance of Rad51 foci in mammalian meiosis[J].Sci Rep,2014,4:6148.
[10]Aston K I,Krausz C,Laface I,et al.Evaluation of 172 candidate polymorphisms for association with oligozoospermia or azoospermia in a large cohort of men of European descent[J].Hum Reprod,2010,25(6):1383-97.
[11]Cooper T G,Noonan E,von Eckardstein S,et al.World Health Organization reference values for human semen characteristics[S]. Hum Reprod Update,2010,16(3):231-45.
[12]Han J W,Zheng H F,Cui Y,et al.Genome-wide association study in a Chinese Han population identifies nine new susceptibility loci for systemic lupus erythematosus[J].Nat Genet,2009,41 (11):1234-7.
[13]彭玉婉,贺小进,阮 健,等.PRDM9基因多态性与汉族男性精子发生障碍相关性研究[J].生殖与避孕,2012,32(6):377.
[14]宋 兵,贺小进,姚嗣会,等.转录因子Ets差异基因(ETV5)基因多态性与非梗阻性无精子症相关性研究[J].生殖与避孕,2014,34(3):187.
[15]O′Bryan M K,de Kretser D.Mouse models for genes involved in impaired spermatogenesis[J].Int J Androl,2006,29(1):76-89.
Relationship of SPATA22 gene variants with non-obstructive azoospermia in Chinese Han population
Zha Xing1,He Xiaojin1,2,Song Bing1,et al
(1The Reproductive Medicine Center,The First Affiliated Hospital of Anhui Medical University,2Biopreservation and Artifical Organs Anhui Provinvial Engineering Research Center,Hefei 230022)
ObjectiveTo investigate the relationship of SPATA22 gene polymorphism with the risk of non-obstructive azoospermia(NOA)in Chinese Han population.MethodsA total of 361 cases with idiopathic NOA and 368 males with normal fertility were collected.The genotypes distribution of seven single nucleotide polymorphisms (SNPs)in SPATA22 were detected using Sequenom MassArray technique.Allele frequencies and genotype analysis between the control group and the case group were compared by using Plink 1.07 software.Haplotype analysis was studied by Haploview Software.ResultsBetween the case group and the control group,there was no significant difference in the allele frequencies of the seven SNPs(P>0.05)and no difference was observed between the case group and the control group in haplotype analysis(P>0.05).ConclusionThe seven SNPs of SPATA22 may not be associated with NOA in Chinese Han population.
stertility;non-obstructive azoospermia;SPATA22 gene;single nucleotide polymorphism
R 698.2
A
1000-1492(2015)07-0900-04
2015-03-13接收
国家自然基金(编号:81300538)
安徽医科大学1第一附属医院生殖医学中心、3省部共建重要遗传病基因资源利用重点实验室,2安徽省生命资源保存与人工器官工程技术研究中心,合肥 230022
查 醒,女,硕士研究生;曹云霞,女,教授,博士生导师,责任作者,E-mail:caoyunxia6@126.com;杜卫东,男,教授,硕士生导师,责任作者,E-mail:weidongdu@hotmail.com
