木荷组织培养技术研究
2015-05-30陈碧华张娟江斌邓永生肖玉梅张
陈碧华 张娟 江斌 邓永生 肖玉梅 张


摘要:对木荷外植体取材母株提前1周喷杀虫剂和杀菌剂,外植体污染率明显降低。加入Vc可以减少外植体褐化,并采用全暗培养。选择MS+BA 0.5 mg·L-1+NAA 0.1 mg·L-1+Vc 5mg·L-1作为木荷最佳外植体诱导培养基,MS+ BA 0.5 mg·L-1 +NAA 0.1 mg·L-1+Vc 5 mg·L-1+ B2 5 mg·L-1为木荷最佳增殖培养基,1/4MS+IBA 0.25 mg·L-1作为木荷最佳生根培养基。
关键词:木荷;组织培养;外植体诱导培养基;增殖培养基;生根培养基
中图分类号:Q813.1+2文献标识码:A文章编号:1004-3020(2015)01-0016-04
Tissue Culture Technique of Schima superba
Chen Bihua(1,2,3)Zhang Juan(1,2)Jiang Bin(3)Deng Yongsheng(3)Xiao Yumei(3)Zhang Cui(3)
(1.Fujian Academy of Forestry SciencesFuzhou350012; 2. Key Laboratory of Timber Forest Breeding
and Cultivation for Mountainous Areas in Southern China, China Forestry Bureau
Fuzhou350012; Qingliu County Forestry Bureau in Fujian ProvinceSanming365300)
Abstract: The contamination rate of the explants of Schima superba during the process of tissue culture was decreased evidently by pre-treating the stock plants using the pesticides and fungicides before one week in advance. The browning rate of the explants was decreased by adding the Vitamine C and being culured in dark. MS+BA 0.5 mg·L-1+NAA0.1 mg·L-1+Vc 5 mg·L-1 was adopted as the optimal explant induction medium, MS+ BA 0.5 mg·L-1 +NAA 0.1 mg·L-1+Vc 5 mg·L-1+ B2 5 mg·L-1 was adopted as the optimal proliferation medium, and 1/4MS+IBA 0.25 mg·L-1 was adopted as the optimal rooting medium.
Key words:Schima superba;tissue culture; explant induction medium; proliferation medium; rooting medium
木荷Schima superba山茶科木荷属常绿大乔木,为我国南方主要的速生珍贵用材树种与生物防火当家树种,木材用于制作木质家具、木质工艺品、人造板以及木地板。木荷不仅纯林生长与生态稳定性好,而且又是杉木、马尾松等针叶树种良好的混交树种。福建省木荷每年用种量很大,年种植面积达3万hm2以上,年用苗量7 000万株以上,是福建省造林面积最大的乡土树种。长期以来,木荷以实生苗造林,而且长期从福建省外调运种子,由于有性繁殖过程中后代容易性状分离,以致母树优良性状丢失,后代分化严重,个体差异大。组培技术可以弥补有性繁殖带来的缺陷,尤其是经过选育后的优良单株,采用组培快繁技术培育优质種苗,营造高质量用材林和高效防火林带,可以带来显著经济和社会生态效益。
国内仅见广东徐位力等一篇对防火树种木荷组培的简要报道,未见试验数据和统计分析[1]。未见国外有关木荷组培的报道。本研究采用初选的木荷优良单株基部萌芽条作为外植体,不仅可以保持母本优良性状得到遗传增益,而且将来可以为社会提供大量优良木荷苗木。
1材料与方法
1.1材料
供试材料为经过初选的优树基部萌芽条。取其顶芽或半木质化枝条作为外植体。
1.2方法
1.2.1 外植体灭菌
木荷顶芽或枝条作为外植体,很难消毒,尤其是雨季。①对母株不进行任何处理;②对外植体母株预先处理,用有效成分4.5%高效氯氰菊酯乳油1 000倍和40%乐果乳油800倍混合液对母株喷雾,次日用70%甲基托布津可湿性粉剂800倍和80%代森锰锌可湿性粉剂800倍混合液对母株喷雾,在喷药后1周之内见晴天采集外植体。观察外植体污染率。
外植体用自来水冲洗表面5~10 min,再用洗涤粉溶液浸泡15~20 min之后用自来水冲洗干净,然后0.1%新洁尔灭溶液浸泡15~20 min,自来水冲洗干净。在无菌超净工作台上,用70%~75%医用酒精浸泡30 s, 0.1%HgCl2消毒12~15 min, 无菌水冲洗4~5次。切去顶芽基部或茎段上下两端,保留长度约为1 cm左右的带腋芽茎段,接于各种外植体诱导培养基上[2]。
1.2.2培养条件
外植体诱导前2周进行全暗培养,以后光照强度500~1 000 lx;继代培养光照强度1 000~1 500 lx;生根培养光照强度从1 000~1 500 lx增加到炼苗光照3 000~6 000 lx。培养温度为26±2 ℃, 光照时间12 h·d-1。
1.3试验设计
1.3.1外植体诱导
外植体诱导培养基为:①MS+BA 3.0 mg·L-1 +NAA 0.1 mg·L-1+Vc (抗坏血酸) 5 mg·L-1;②1/2MS+BA 3.0 mg·L-1+NAA 0.1 mg·L-1+Vc 5 mg·L-1;③MS+BA1.0 mg·L-1+NAA0.1 mg·L-1+ Vc 5 mg·L-1;④MS+BA 0.5 mg·L-1+NAA0.1 mg·L-1+ Vc 5 mg·L-1[3-4]。以上均附加白糖30 g·L-1(“田趣”牌,下同)和卡拉胶(闽南琼胶有限公司出品,下同)6.0 g·L-1,pH6.0。每处理接种50瓶(200 mL广口瓶),每瓶1个芽或茎段,重复3次,培养30 d后统计污染和诱导启动情况。
1.3.2继代培养基
继代培养基为:⑤MS+ BA1.0 mg·L-1+NAA 0.1 mg·L-1+Vc 5mg·L-1+ B2(核黄素)5mg·L-1; ⑥ MS+ BA 0.5 mg·L-1+NAA 0.1 mg·L-1+Vc 5 mg·L-1+ B2 5 mg·L-1; ⑦MS+ BA0.1 mg·L-1+NAA 0.1 mg·L-1+Vc 5 mg·L-1+ B2 5 mg·L-1。以上基本均附加白糖30 g·L-1和卡拉胶6.0 g·L-1,pH6.0。每处理接种30瓶(200 mL广口瓶),每瓶3个茎芽,重复3次,培养30 d后统计增殖系数和茎芽高度。
1.3.3生根培养基
生根基本培养基采用:⑧1/4MS;⑨1/4MS+IBA 0.25 mg·L-1;⑩1/4MS+IBA 0.5 mg·L-1;最后一个1/4MS+ IBA 1.0 mg·L-1。以上基本均附加白糖20 g·L-1和卡拉胶7.0 g·L-1,pH6.0。每处理接种10瓶,每瓶3个茎芽,重复3次。
1.3.4炼苗
培养室培养25 d后的生根苗,移入玻璃温室炼苗约15 d。光照度2 000~6 000 lx。生根接种40 d后统计生根率、根数、根长和高度茎芽。
1.3.5移栽
以红心土做为栽培基质,装入黑色塑料营养袋,移入简易温室中,以0.1‰~0.5‰高锰酸钾消毒土壤。将炼苗后的木荷瓶苗,用自来水洗净植株根部的培养基,70%甲基托布津可湿性粉剂1 000倍液和80%代森锰锌可湿性粉剂1 000倍液混合浸泡10 min消毒后,移栽于营养袋中,覆盖薄膜保湿。每天向叶片喷水1次、浇透水,2周后揭开薄膜,并且每天喷1~3次,以后逐渐过渡到每天喷1次。
采用SPSS11.5软件对试验数据进行单因素方差分析,置信度0.05或0.01。
2结果与分析
2.1外植体灭菌
木荷外植体很难消毒,在外植体母株未预先处理情况下,采用酒精、升汞或次氯酸钠等消毒液进行消毒处理,污染率达到83.3%~100%。加上外植体容易褐化,很难得到无污染而且无褐化的外植体。经过观察分析发现:主要污染原因在于春夏季福州经常下雨,并且木荷苗木上面有很多蚜虫危害。蚜虫以刺吸式口器从苗中吸收汁液的同时,也把微生物带进植株体内,致使外植体内部携带细菌或真菌,外植体消毒时,消毒液难以进入外植体内杀灭细菌或真菌,导致外植体污染率很高。
采用对外植体母株预先处理,即方法(2),外植体污染率降为40.4%~80.0%,外植体无污染率明显提高。
2.2外植体诱导培养基的选择
木荷外植体诱导试验结果见表1。试验中发现外植体褐化严重,因此加入Vc 5 mg·L-1以减少褐化,并采用全暗培养。采用置信度0.05和0.01,分析结果表明:1号培养基平均诱导率为39.2%,2号培养基为13.8%,两者具有极显著差异。这两种培养基除了基本培养基不同,其余激素等添加物完全相同,所以选择1号培养基的MS为基本培养基,淘汰2号培养基。表1结果同时表明:3号培养基平均诱导率为66.3%,4号培养基為68.5%,两者没有显著差异,但3号培养基有愈伤组织产生,导致芽生长缓慢并且伸长困难;而4号培养基无愈伤组织产生,几乎全部芽抽高且生长正常,因此选择培养基④MS+BA 0.5 mg·L-1+NAA0.1 mg·L-1 + Vc 5mg·L-1为木荷外植体诱导培养基。
图1木荷增殖材料
图2木荷生根瓶苗
2.3增殖培养基的选择
在超净工作台上,对诱导成功的木荷外植体,切下新芽,剔除老枝,转接到增殖培养基,试验结果见表2。分析结果表明:5~7号培养基平均增殖率分别为4.3倍、3.2倍和0.7倍,三者之间具有显著差异,对于平均茎芽高度,3种培养基分别为0.8 cm、2.3 cm和3.4 cm,三者之间同样具有显著差异。由于7号培养基平均增殖率太低,5号培养基平均茎芽高度太小,不符合组培工厂化育苗的要求,只有6号培养基MS+ BA 0.5 mg·L-1 +NAA 0.1 mg·L-1+Vc 5 mg·L-1+ B2 5 mg·L-1,在增殖率和茎芽高度方面同时符合组培工厂化育苗技术要求,所以选择该培养基作为木荷增殖培养基。(图1)
2.4生根培养基的选择
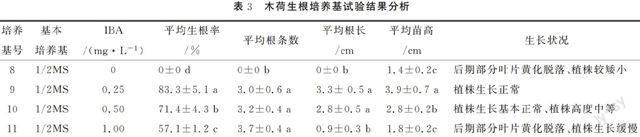
将增殖培养获得的木荷有效生根茎芽转接到1/2MS为基本培养基上,经培养室培养25 d,随后炼苗15 ,统计其生根状况,结果(表3)。结果表明:没有添加IBA的8号培养基,没有生根,不能作为生根培养基;9号和10号培养基的平均生根率、平均根条数、平均根长、平均苗高均较理想、而且植株生长正常,但10号培养基的平均苗高为2.8 cm,9号培养基为3.9 cm;11号培养基的平均苗高太低,仅为1.8 m,且生根率较低,仅为57.1%。综上所述,选择9号培养基 1/4MS+IBA 0.25 mg·L-1作为木荷生根培养基(图2)。
2.5组培苗木移栽
木荷组培瓶苗经过15 d炼苗后,洗净培养基后移栽到简易温室,移栽基质为红心土,基质经0.3‰~0.5‰高锰酸钾消毒,移栽后经过覆盖薄膜保湿和注意防治病虫害,30 d后观察成活率达到90%以上。经过表型观察,苗木未见发生变异。
3结论和讨论
(1)确定最佳木荷外植体诱导培养基为:MS+BA 0.5 mg·L-1+NAA 0.1 mg·L-1 + Vc 5 mg·L-1;增殖培养基为:MS+ BA 0.5 mg·L-1 +NAA 0.1 mg·L-1+Vc 5 mg·L-1+ B2 5 mg·L-1;生根培养基为:1/4MS+IBA 0.25 mg·L-1。
(2)木荷外植体很难消毒,必须对母株进行预处理,用有效成分4.5%高效氯氰菊酯乳油1 000倍和40%乐果乳油800倍混合液对母株喷雾,次日用70%甲基托布津可湿性粉剂800倍和80%代森锰锌可湿性粉剂800倍混合液对母株喷雾,在喷药后一周之内见晴天采集外植体。外植体污染率降为40.4%~80.0%,外植體无污染率明显提高。试验中发现外植体褐化严重,因此加入Vc 5 mg·L-1以减少褐化,并采用全暗培养。
参考文献
[1]徐位力,苏开君,王伟平,等.防火树种木荷和红木荷的组织培养及植株再生[J].植物生理学通讯,2006,42(2):55.
[2]谭文澄,戴策刚. 观赏植物组织培养技术[M]. 北京:中国林业出版社,1991,40-44.
[3] 陈碧华.杂交马褂木组织培养技术研究[J].湖北林业科技,2012,(3):10-13.
[4]Chen B H.In vitro propagation of a medicinal plant: Tripterygium wilfordii Hook f.[J].Forestry studies in China,2009,11(3):174-178.
[5]Chen B H, Trueman S J, Li J M, et al.Micropropagation of the Endangered Medicinal Orchid,Dendrobium officinale[J].Life Science Journal,2014,11(9):526-530.
[6] Trueman S J,Hung C D .Cytokinin concentrations for optimal micropropagation of Corymbia torelliana × C. citriodora[J].Australian Forestry,2012,75(1): 233-237.
[7]陈碧华,李乾振,吴丽君,等.巨桉组织培养及工厂化育苗技术的研究[J].福建林业科技,2006,33(1):61-63,79.
(责任编辑:郑京津)
基金项目:福建省属公益类科研院所基本科研专项(闽林研〔2012〕25号);福建省林业厅科研项目“木荷优良单株选择与组培技术研究”(闽林科〔2012〕 3号)。
作者简介:陈碧华(1967~),男,福建龙海人,博士,教授级高级工程师,主要从事林业生物技术研究工作。
