专题十六 化学实验方案的设计
2015-05-30张海洋
张海洋

高考动向
在全国高考新课标化学大纲中,对于化学实验方案设计的要求是“能根据实验试题要求,做到设计、评价或改进实验方案”。纵观当前的高考化学试题,对化学实验方案设计的考查越来越关注,逐渐在呈现上升的趋势。
能根据实验试题绘制和识别典型的实验仪器装置图。
考点分析
考点1. 化学实验方案设计的基本环节
化学实验方案设计包括实验目的、实验原理、实验用品以及装置、实验操作及规程、实验结果处理、实验程序等六个要素,这些要素之间存在紧密的逻辑关系。
(1)实验目的。实验目的要求是实验的出发点和归宿,因此在实验设计前,必须对实验的目的要求相当明确。
(2)实验原理。只有明确实验原理和方法,才能对实验设计作出合理的规划。在明确实验目的的基础上,综合运用学过的知识,通过类比、迁移、分析,从而确定(选择或拟出)实验原理。
(3)实验用品。根据实验的目的和原理,以及实验需要控制的条件等,合理选择实验所需要的仪器和药品。
(4)实验装置与步骤。根据实验目的和原理,以及选用的实验仪器和用品,设计合理的实验装置和实验操作步骤,能绘制或识别相应的实验装置图。
(5)预测实验现象与数据。根据实验目的、原理和过程,预测实验将观察到的现象,以及实现实验目的将要记录那些数据等。
(6)预测实验结论。预测根据实验观察的现象和数据,通过分析、计算、图表、推理等处理,得出正确的实验结论。
考点2. 化学实验方案设计的基本思路
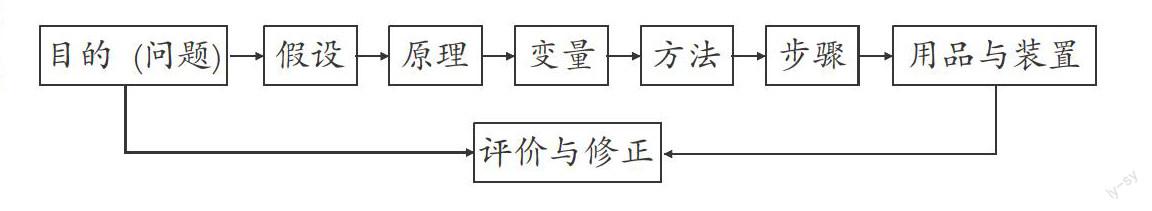
化学实验方案设计是在准确理解实验目的和要求,熟练掌握常见实验仪器使用,融会贯通各部分化学知识,敏锐把握实验手段优劣的基础上,按照一定的实验思路对实验的原理、仪器、装置、步骤和方法等进行合理安排与规划。一般的思路是:
(1)发现问题(明确实验目标)。设计实验前,一定要知道解决的是什么问题,通过实验要达到什么样的目的,为实验设计明确清晰的方向。
(2)提出实验假设。根据实验目的和要求,结合已有的化学知识与技能,尊重当前已有的实验条件,对实验整体设计提出初步的设想。
(3)确定实验原理。根据前面提出的实验假设,遵循有关实验要求和基本原则,结合已有的知识经验和实验经历,确定合适的实验原理。
(4)控制实验变量。围绕实验假设和实验原理确定被试和变量,通过分析影响实验进行的各种变量,对其中的有关变量进行合理控制和安排,以达到实验目的。
(5)选择实验方法。要对实验变量进行合理的控制,就需要利用最基础的化学实验知识,选择本实验最合适的实验方法。
(6)制订实验步骤。按照实验变量的控制和安排,依据所选择的实验原理和方法,遵循一定的实验逻辑顺序,依次制订实验步骤。
(7)选择用品和设计装置。根据实验步骤的要求选择适合的实验用品,并按照实验要求将实验仪器设计成实验装置。
(8)评价与修正实验方案。回顾实验方案设计,反思实验过程,修正检验假设,对结果评价。
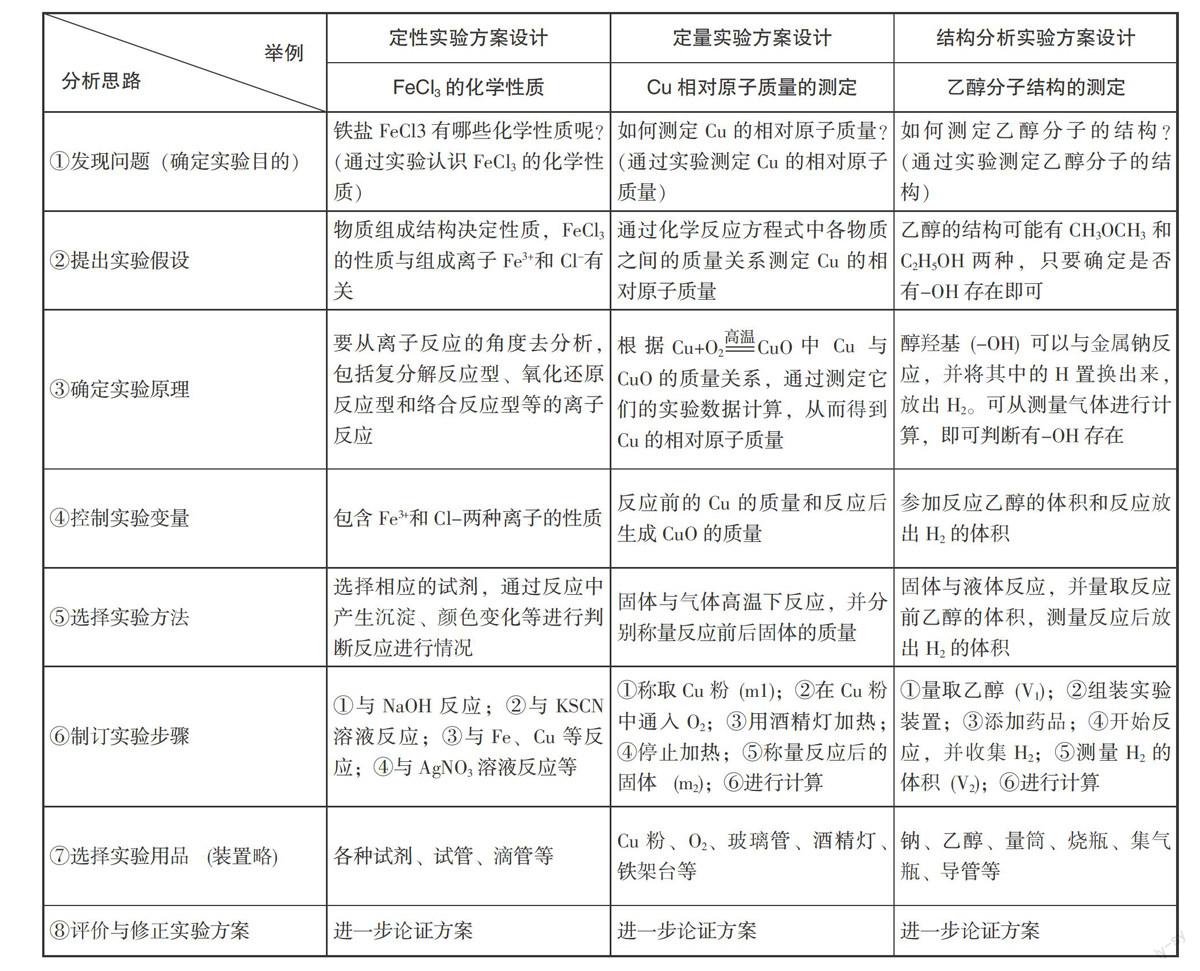
考点3. 化学实验方案设计的基本类型
从实验研究的侧重点和中学化学实验实际来看,化学实验方案设计的类型主要包括:
(1)定性实验方案设计:①制取某种物质的实验;②物质性质的实验;③物质检验实验;④分离混合物或从混合物中提取某物质的实验;⑤验证化学原理、化学概念或化学反应的实验。
(2)定量实验方案设计:①测定某些中学化学常用计量(某元素的相对原子质量、阿伏加德罗常数)的实验;②确定物质组成(混合物各组分质量分数、某化合物的定量组成)的实验;③测定化学反应中能量变化(如反应热、中和热)的实验。
(3)结构分析实验方案设计:用以测定物质微观结构的实验,包含测定分子结构和晶体结构的实验等。
考点突破
综合分析化学实验设计考查的高考题型,可从设问的形式将题型分为三类,包括实验步骤型方案设计题、实验装置型方案设计题和实验变量型方案设计题。尽管它们设问的形式不同,但解题的思路是一样的。
1. 实验步骤型方案设计题。
化学实验方案设计题型多以实验步骤设计的形式进行考查,以前高考只要求学生完成部分实验步骤的设计,现在比较多地要求学生完成全部实验步骤的设计,说明考查的要求在不断地提高。
【例1】(2015·上海)甲醛和新制氢氧化铜的反应显示了甲醛的还原性,发生反应的化学方程式通常表示如下:
若向足量新制氢氧化铜中加入少量甲醛,充分反应,甲醛的氧化产物不是甲酸或甲酸盐,设计一个简单实验验证这一判断。
①主要仪器:试管、酒精灯。
②可供选用的试剂:硫酸铜溶液、甲醛、甲酸、氢氧化钠溶液
【解析】按照化学实验方案设计的基本思路进行解题。
(1)确定实验目的:通过实验证明醛的氧化产物不是甲酸或甲酸盐。
(2)提出初步假设:甲酸和甲酸盐都含有醛基,通过检验是否存在醛基进行验证。
(3)确定实验原理:检验醛基的存在常用银氨溶液或新制氢氧化铜等试剂,根据本题所给条件,应选择新制氢氧化铜。
(4)控制实验变量:对醛基进行检验。
(5)选择实验方法:采用物质检验的方法,通过判断是否有砖红色沉淀产生进行判断。
(6)制订实验步骤:第一步要新制氢氧化铜悬浊液,第二步是将反应后的溶液与新制氢氧化铜反应。
……
【答案】向试管中加入2ml10%的NaOH溶液,然后向其中滴加2%的硫酸铜溶液CuSO4溶液4-6滴,产生Cu(OH)2蓝色絮状沉淀;取少量反应后的溶液,加入到新制Cu(OH)2悬浊液中,加热煮沸,观察有无砖红色沉淀产生,若有证明含有甲酸或甲酸盐,否则不含有甲酸或甲酸盐。
2. 实验装置型方案设计题。
实验装置的设计也是化学实验方案设计考查的常见形式,有时候是考查一组仪器或装置的链接,有时候是考查部分装置的作图,都比较有利于考查化学实验方案设计的能力。
【例2】(2015·北京)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用如下方法:
①气提、吸收CO2。用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下)。将虚线框中的装置补充完整并标出所用试剂。
②滴定。将吸收液吸收后的无机碳转化为NaHCO3,再用x mol/L HCl溶液滴定,消耗y mL HCl 溶液,海水中溶解无机碳的浓度= mol/L。
【解析】按照化学实验方案设计的基本思路进行解题——
(1)明确实验目的:通过实验测定海水中溶解无机碳的含量。
(2)提出初步假设:将海水中的无机碳转化为CO2,将CO2用NaOH吸收,并转化为NaHCO3,最后用盐酸滴定来计算溶解无机碳的浓度。
(3)确定实验原理:通过海水中HCO3-与酸反应、CO2与NaOH反应、NaHCO3与盐酸反应等三个反应来达到实验的目的。
(4)控制实验变量:海水中HCO3-的转化情况,CO2的吸收情况,NaHCO3滴定消耗盐酸的情况。
(5)选择实验方法:采用物质转化和分离、滴定等实验方法。
(6)制订实验步骤:①组装无机碳转化装置和CO2吸收装置;②检验气密性;③添加药品;④开始无机碳转化实验;⑤滴定(略);⑥计算。
(7)选择实验用品和装置:要用硫酸来酸化海水,不能用盐酸等挥发性的酸,否则会影响后续的滴定;无机碳转化装置中的导管要“长进短出”,还需要添加硫酸的分液漏斗。(其它略)
……
【答案】①见右图。②xy/z。
3. 实验变量型实验方案设计题。
构建实验设计中的变量控制,也能整体反映实验的设计。以实验变量控制的形式命题,已经成为化学实验方案设计的新方向。
【例5】(2015·广东)NH3及其盐都是重要的化工原料。设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响。
限制试剂与仪器:固体NH4Cl,蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度)。
①实验目的:探究 对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中V(溶液)表示所配制溶液的体积)。
③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应得平衡转化率为 (只列出算式,忽略水自身电离的影响)。
(本题只选取了高考原题的一部分)
【解析】按照化学实验方案设计的基本思路进行解题。
(1)明确实验目的:探究温度(或浓度)对溶液中NH4Cl水解程度的影响。
(2)提出初步假设:盐类水解程度外部影响因素主要是温度、浓度及外加物质等。根据题目已给条件,可以选择从改变温度或改变浓度的角度进行探究,“外加物质”不作为研究变量。
(3)确定实验原理:温度会影响盐类的水解平衡常数,改变温度必然会影响盐的水解程度;浓度尽管不影响盐类的水解平衡常数,但改变浓度会引起平衡移动,故最后影响盐的水解程度。
(4)控制实验变量:实验变量包括浓度、温度和溶液pH(反应水解程度的变量),其中浓度和温度为控制变量,溶液pH为待测物理量。当研究温度的影响时,则要控制NH4Cl的浓度不变,通过改变温度来研究对NH4Cl水解程度的影响;当研究浓度的影响时,则要控制温度不变,通过改变NH4Cl的浓度来研究对自身水解程度的影响。
填写表格时,字母相同表示对应条件一样,字母不同表示对应条件不一样;本表没有直接表示浓度变量,但溶液体积V都是100mL,那么溶液中NH4Cl的质量情况即可反映浓度。
……
【答案】①温度或浓度(只选一种情况进行研究)。②见下表。
决胜高考
1.(2015·安徽)某研究小组将纯净的SO2气体通入0.1 mol/L的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组突出了如下假设:
假设一:溶液中的NO3-;假设二:溶液中溶解的O2。
(1)验证假设一
该小组涉及实验验证了假设一,请在下表空白处填写相关实验现象。
实验2:在盛有不含O2的25mL 0.1 mol/L的Ba(NO3)2溶液的烧杯中,缓慢通入纯净的SO2气体
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线入下图。
实验1中溶液pH变小的原因是
;
V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示
。
(3)验证假设二
请设计实验验证假设二,写出实验步骤,预期现象和结论。
(4)若假设二成立,请预测:在相同条件下,分别用足量的O2和KNO3,氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反应后两溶液的pH前者 (填大于或小于)后者,理由是 。
2.(2015·全国新课标Ⅰ卷)草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)甲组同学按照如图4所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是 ,由此可知草酸晶体分解的产物中有 。装置B的主要作用是 。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和图5所示的部分装置(可以重复选用)进行实验。
①乙组同学的实验装置中,依次连接的合理顺序为A、B、 。装置H反应管中盛有的物质是 。②能证明草酸晶体分解产物中有CO的现象是 。
(3)设计实验证明:①草酸的酸性比碳酸的强
;②草酸为二元酸
。
3.(2015·福建)某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一:制取氯酸钾和氯水
利用图6所示的实验装置进行实验。
(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有
。
(2)若对调B和C装置的位置, (填“能”或 “不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
①系列a实验的实验目的是 。
②设计1号试管实验的作用是 。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为
。
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用图7装置,加热15.0ml饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是
。(不考虑实验装置及操作失误导致不可行的原因)
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):
。
资料:ⅰ.次氯酸会破坏酸碱指示剂;
ⅱ.次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-。
4.(2014·广东)H2O2是一种绿色氧化还原试剂,在化学研究中应用广泛。
(1)某小组拟在同浓度Fe3+的催化下,探究H2O2浓度对H2O2分解反应速率的影响。
限选试剂与仪器:30% H2O2、0.1mol·L-1Fe2(SO4)3、蒸馏水、锥形瓶、双孔塞、水槽、胶管、玻璃导管、量筒、秒表、恒温水浴槽、注射器
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:
。
②设计实验方案:在不同H2O2浓度下,测定
(要求所测得的数据能直接体现反应速率大小)。
③设计实验装置,完成图8的装置示意图。
④参照下表格式,拟定实验表格,完整体现实验方案(列出所选试剂体积、需记录的待测物理量和所拟定的数据;数据用字母表示)。
(2)利用下图(a)和(b)中的信息,按(c)装置(连能的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),其原因是
。
答案点拨
1.(1)实验1:无现象;实验2:生产白色沉淀。(2)SO2溶于水后生成H2SO3;3SO2+2H2O+2NO3-=2NO+4H++3SO42-。(3)实验方案见下表。
(4)小于;反应的离子方程式表明,足量的O2和NO3-分别氧化相同的H2SO3,生成的H+的物质的量前者大于后者反应的离子方程式表明,足量的O2和NO3-分别氧化相同的H2SO3,生成的H+的物质的量前者大于后者。
解析:(1)根据强酸制取弱酸的原理,二氧化硫溶于水后生成H2SO3,亚硫酸是弱酸不能制备盐酸,故实验1无现象;二氧化硫溶于水后生成H2SO3,亚硫酸电离出氢离子(H2SO3·2H++SO32-),NO3-在酸性条件下具有强的氧化性,将SO32-氧化成SO42+,从而与Ba2+反应生成BaSO4白色沉淀。(2)实验1中,二氧化硫溶于水后生成H2SO3,H2SO3是一种弱酸,所以溶液的pH减小;实验2中,经过反应后生成H2SO4,H2SO4是一种强酸,与H2SO3相同浓度时,H2SO4溶液酸性更强,所以pH更小。(3)要设计实验验证假设二,同样要设计一组对比实验,即在有O2和无O2两种条件下,将SO2通入到BaCl2溶液中,若有白色沉淀生成,则假设二成立。(4)H2SO3分别与O2、KNO3反应的离子方程式为:2H2SO3+O2=4H++2SO42-和3H2SO3+2NO3-=2NO↑+4H++H2O+3SO42-,根据两个离子方程式可以判断,当参加反应的H2SO3相同时,与O2反应生成的H+要多,故溶液的pH要小。
2.(1)有气泡逸出、澄清石灰水变混浊;CO2;冷凝(水蒸气、草酸等),防止草酸进入装置C反应生成沉淀,干扰CO2的检验。(2)①F、D、G、H、D、I; CuO(氧化铜);②H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊。(3)① 向盛有少量NaHCO3的试管里滴加草酸溶液,有气泡产生;②用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量为草酸的2倍。
解析:(1)根据草酸晶体分子结构,结合碳元素化合价,并综合分析实验装置图设计意图,可以推断草酸受热分解会产生CO2,从而使烧杯中澄清石灰水变浑浊;由于草酸易升华,且其钙盐难溶于水,B装置温度较低,有冷凝作用,防止升华的草酸干扰C装置实验。(2)①要检验生成CO,在A、B装置之后,“用浓氢氧化钠除去CO2→用澄清石灰水检验CO2的除去情况→用碱石灰干燥CO→CO还原CuO得到CO2→再利用澄清石灰水检验生成的CO2→用排水法收集剩余的CO”,这样就有了装置连接的顺序了,H装置中盛放的物质就是CuO;②常用CuO来检验CO,现象就是黑色CuO变成红色的Cu,生成的气体能使澄清石灰水变浑浊。(3)①要证明草酸酸性大于碳酸,可以利用强酸制取弱酸;②利用酸碱中和滴定酸碱物质的量比确定草酸是二元酸。
3.(1)烧杯、漏斗、玻璃棒、胶头滴管。(2)能。(3)① 研究反应体系中硫酸浓度对反应产物的影响;② 硫酸浓度为0的对照实验;③ ClO3+6I-+6H+=Cl+3I2+3H2O。(4)因存在Cl2的重新溶解、HClO分解等,此方案无法测算试样含氯总量(或其他合理答案)。(5)量取一定量的试样,加入足量的H2O2溶液,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,称量沉淀质量(或其他合理答案)。
解析:(1)进行冷却结晶操作需要烧杯,进行过滤操作需要烧杯、漏斗和玻璃棒,进行洗涤操作需要胶头滴管,故答案为烧杯、漏斗、玻璃棒、胶头滴管。(2)二氧化锰与浓盐酸来制取氯气,制得的氯气常含有氯化氢,氯化氢能与KOH反应而降低B中的氯酸钾产率,若对调B和C装置,水能吸收氯化氢,从而除去氯化氢的影响,提高B中氯酸钾的产率。(3)①根据实验数据表,对比试管1、2、3、4中数据发现,KI和KClO3的量是系统的,混合后溶液的体积是相同的,但不同的是H2SO4的用量,所以H2SO4的浓度时要控制的变量,实验的目的就是研究反应体系中硫酸浓度对反应产物的影响;②1号试管中没有H2SO4,其作用就是当硫酸浓度为0的对照实验;③知道反应物和生成物即可写出离子反应方程式,本反应中的反应物是KI、KClO3和H2SO4,产物为I2、KCl,还有H2O。(4)氯水中存在Cl2、HClO和HCl,而且中间又会发生HClO分解和Cl2的再溶解,所以其中氯主要会以Cl2和HCl形式存在,此方案无法测算试样含氯总量。(5)根据题目所给信息,要测算氯的含量的思路就是,将氯全部转化为Cl,然后用AgNO3将Cl-转化为AgCl沉淀,再通过称取沉淀的质量来求算氯的含量。但在将氯全部转化为Cl-,如果选SO2,要考虑生成SO42-对后面转化为沉淀的干扰,如果选FeCl2又会引进Cl-而产生影响,故最好选择H2O2。
4.(1)① 。②同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少。③ 。④见下表:
(2)深;2NO2(红棕色)?葑N2O4(无色);△H<0,是放热反应,且双氧水的分解反应也是放热反应.当右边双氧水分解时放出的热量会使B瓶升温,使瓶中反应朝逆反应方向移动,即向生成NO2移动,故B瓶颜色更深。
解析:(1)①在过氧化氢分解反应中,过氧化氢既作氧化剂又做还原剂,发生化合价变化的只有氧元素,可以用“双线桥”法或“单线桥”法标明电子转移方向和数目。②可以通过氧气产生的速率来反映过氧化氢反应的速率,因此需要测定相同时间内产生氧气的体积多少,或生成相同体积的氧气所需时间的多少。③测量气体的体积情况,常用测量排出液体体积的法,根据题目已给出的仪器,可用盛满水的量筒倒立于盛水的水槽中,并用导管与气体发生装置连接。④实验探究的是H2O2浓度对H2O2分解反应速率的影响,控制的变量是H2O2的浓度,其它的变量要控制不变,不变的量包括Fe2(SO4)3的用量和混合后溶液的体积,混合后溶液的体积不变要通过加蒸馏水的方式来实现。因此,实验的数据就包括Fe2(SO4)3的用量、H2O2的用量、蒸馏水的用量、实验时间和氧气体积。(2)由图a和b可知,H2O2的分解反应和NO2转化为N2O4的反应都是放热反应,所以c装置中右侧烧杯的温度高于左侧,升高温度,2NO2(红棕色)?葑N2O4(无色); △H<0向逆反应方向移动,故B瓶颜色更深。
(作者单位:佛山市教育局教研室)
责任编校 李平安
