超声波辅助酶解制备猪血源抗氧化肽
2015-05-30唐雯倩
唐雯倩
摘 要:超声波处理可以提高胰蛋白酶溶液的酶活力和溶解度。实验利用超声波处理胰蛋白酶溶液,其酶活力和蛋白酶溶解度分别提高104.9%和2.4%。针对胰蛋白酶水解猪血血红蛋白酶解液,通过单因素试验和正交试验优化,以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)自由基清除率和胰蛋白酶水解度为指标,得到最佳抗氧化肽工艺优化条件为:超声频率20 kHz、超声时间8 min、超声功率540 W、胰蛋白酶添加量0.8%、反应体系pH 8.0,酶解2h即可达到常规酶解6 h的酶解度,此时DPPH自由基清除率为75.78%。应用超声波辅助处理可以提高酶解效率,缩短工作时间。
关键词:超声波;胰蛋白酶;猪血;抗氧化肽;1,1-二苯基-2-三硝基苯肼
Abstract: The activity and solubility of trypsin were found to be increased by 104.9% and 2.4% after ultrasonic treatment, respectively. Based on this result, we proposed an ultrasound-assisted enzymatic hydrolysis process for preparing antioxidant peptides from porcine blood. The optimal hydrolysis parameters that produced the same degree of hydrolysis as that obtained after 6 h hydrolysis by the routine procedure were determined by using single-factor and orthogonal array designs based on 1,1-diphenyl-2-picrylhydrazyl radical (DPPH) scavenging activity as follows: ultrasonic frequency, 20 kHz; ultrasonic time, 8 min; ultrasonic power, 540 W; addition of trypsin, 0.8%; and initial pH, 8.0. The resulting hydrolysate could scavenge 75.78% of DPPH radicals. To conclude, this study demonstrates that ultrasound treatment can increase the hydrolysis efficiency of porcine blood and shorten the hydrolysis time.
Key words: ultrasound; trypsin; porcine blood; antioxidant peptides; 1,1-diphenyl-2-picrylhydrazyl radical (DPPH)
中图分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2015)11-0010-05
doi: 10.15922/j.cnki.rlyj.2015.11.003
国内外学者利用现代蛋白质分析技术在动植物蛋白的酶解液中发现了一些具有生物活性的肽类,比如抗菌肽[1-2]、抗氧化肽[3-5]和抗血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制肽[6-7]等。抗氧化肽可以清除自由基,减轻自由基对机体的损伤;同时对紫外线引起的线粒体损伤和自由基诱导的脂质过氧化具有明显的保护能力[8-9]。
猪血蛋白质含量为18.9%,被誉为“液态肉”[10-12]。猪血是良好的功能性肽源,血液蛋白源的抗氧化肽是一种安全、无毒副作用的天然抗氧化肽[13]。方俊等[14]利用屠宰场分离的菌株A32,以猪血为唯一氮源进行发酵实验,得到的猪血多肽具有一定的抗氧化活性。潘晓倩等[15]用响应面法优化猪血红蛋白抗菌肽的制备工艺,酶解用时5.19 h;潘红梅等[16]采用蛋白酶和碱结合方式酶解猪血血浆蛋白总用时长达8 h;潘风光等[17]采用微波辅助酶解猪血制备活性肽仅需11 min。采用现代生物技术制备功能性肽可以大幅度缩短酶解时间,避免了因酶解时间过长而造成生物活性降低及原材料变质等问题。
本研究通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electropheresis,SDS-PAGE)分析超声前后胰蛋白酶的分布情况,探究超声波对胰蛋白酶活力的影响;以新鲜猪血为原料,添加胰蛋白酶,采用超声波辅助酶解,以1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)自由基清除率为指标,通过单因素试验和正交试验优化猪血源抗氧化肽制备技术,以期获得一种高效的酶解技术。
1 材料与方法
1.1 材料与试剂
鲜猪血 北京资源集团屠宰场。
胰蛋白酶 国药集团药业股份有限公司;DPPH 东京化成工业株式会社;其余所有试剂均为国产分析纯。
1.2 仪器与设备
GTR10-2离心机 赛默飞世尔科技(中国)有限公司;SHZ-28A恒温振荡摇床 太仓市豪成实验仪器制造有限公司;SCIENTZ-IID型超声波细胞破碎机 北京久润天诚科技发展有限公司;PB-10型数显酸度计 赛多
利斯科学仪器有限公司;KDY-9820凯氏定氮仪 北京
市通润源机电技术有限责任公司;Synergy H4酶标仪 美国BioTek公司;电泳槽 北京六一仪器厂。
1.3 方法
1.3.1 猪血血红蛋白制备
参考潘晓晴等[15]的方法,取鲜猪血,加质量分数5‰柠檬酸钠抗凝,4 ℃离心(5 000 r/min、10 min),收集下层血细胞。将收集的血细胞超声破碎(20 kHz、540W、2 s/2 s、10 min),得到猪血血红蛋白。血红蛋白溶液90℃水浴加热10 min,变性结块的血红蛋白和蒸馏水混合(7∶3,m/m),均质混匀(7 000 r/min),得到较为黏稠的血红蛋白。-20 ℃冻藏备用。
1.3.2 超声波对胰蛋白酶溶解度和活力的影响
称取200 g胰蛋白酶,配制5 g/100 mL胰蛋白酶溶液。超声波处理(20 kHz、540 W、2 s/2 s、10 min),4℃离心(5 000 r/min、5 min),收集超声波处理后溶液。通过凯氏定氮仪分别测定超声波处理前、后溶液中总氮含量,换算蛋白酶含量。参考GB/T 23527—2009《蛋白酶制剂》[18],采用紫外分光光度法测定蛋白酶活性,并进行SDS-PAGE分析。
1.3.3 超声辅助酶解对猪血血红蛋白水解度的影响
分别称取2 份200 g制备的猪血血红蛋白,按质量分数0.8%加入胰蛋白酶,一份37 ℃水浴振荡,另一份经超声处理(450 W、9 min、20 kHz、2 s/2 s)后37 ℃水浴振荡,调节pH 8.0,分别测定猪血血红蛋白水解度,其中,氨基酸态氮测定参照电位滴定法[19],总氮测定参照凯氏定氮法[20]。猪血血红蛋白水解度按照式(1)计算。
1.3.4 超声波辅助酶解工艺
1.3.4.1 单因素试验
按1.3.3节制备猪血红蛋白-胰蛋白酶溶液,超声后用2 mol/L NaOH调节体系pH 8.0,37 ℃水解2 h后,90℃水浴10 min终止酶解反应,待液体冷却后,4 ℃条件下10 000 r/min离心10 min,即得粗酶解液。以DPPH自由基清除率和水解度为指标,分别考察超声时间为3、6、9、12、15 min时,超声功率为180、360、540、720、891 W时,超声频率为15、20、25、30 kHz时,胰蛋白酶添加量为0.1%、0.3%、0.5%、0.7%、0.9%、1.2%时对酶解水解度的影响。
1.3.4.2 正交试验
选择超声时间、超声功率和酶用量为自变量,DPPH自由基清除率为因变量,按正交试验因素组合进行优化试验。
1.3.5 DPPH自由基清除率的测定
参考郭善广等[21]的方法,取100 μL粗酶解液与300 μL 6×10-5 mol/L DPPH无水乙醇溶液于离心管中,漩涡混匀。迅速吸取200 μL上述混合液于96 孔酶标板中,反应25 min后,用酶标仪于518 nm波长处测定吸光度。按式(2)计算DPPH自由基清除率。
式中:A0为蒸馏水吸光度;A1为6×10-5 mol/L DPPH无水乙醇溶液吸光度;A2为粗酶解液和无水乙醇吸光度;A3为混合液吸光度。
1.3.6 SDS-PAGE凝胶电泳
参考文献[22-23]方法,选择12%分离胶、5%堆积胶。5 g/100 mL胰蛋白酶溶液加入5×Tris-Glycine缓冲液,沸水浴加热3 min后离心混匀。每孔上样量为10 μL,先60 V运行10 min,再恒定90 V运行约90 min结束实验。考马斯亮蓝R-250染色10 min,洗脱液(水∶甲醇∶乙酸=
6∶3∶1,V/V)洗脱,洗脱完全后拍照分析。
1.4 数据分析
采用SPSS 17.0进行数据分析,采用方差分析(Analysis of Variance,ANVOA)进行单因素显著性分析,采用Duncans多重比较检验法对正交试验进行显著性分析(P<0.05),采用Excel 2013进行图表的制作。所有实验均测3 次平行。
2 结果与分析
2.1 超声波对胰蛋白酶活性的影响
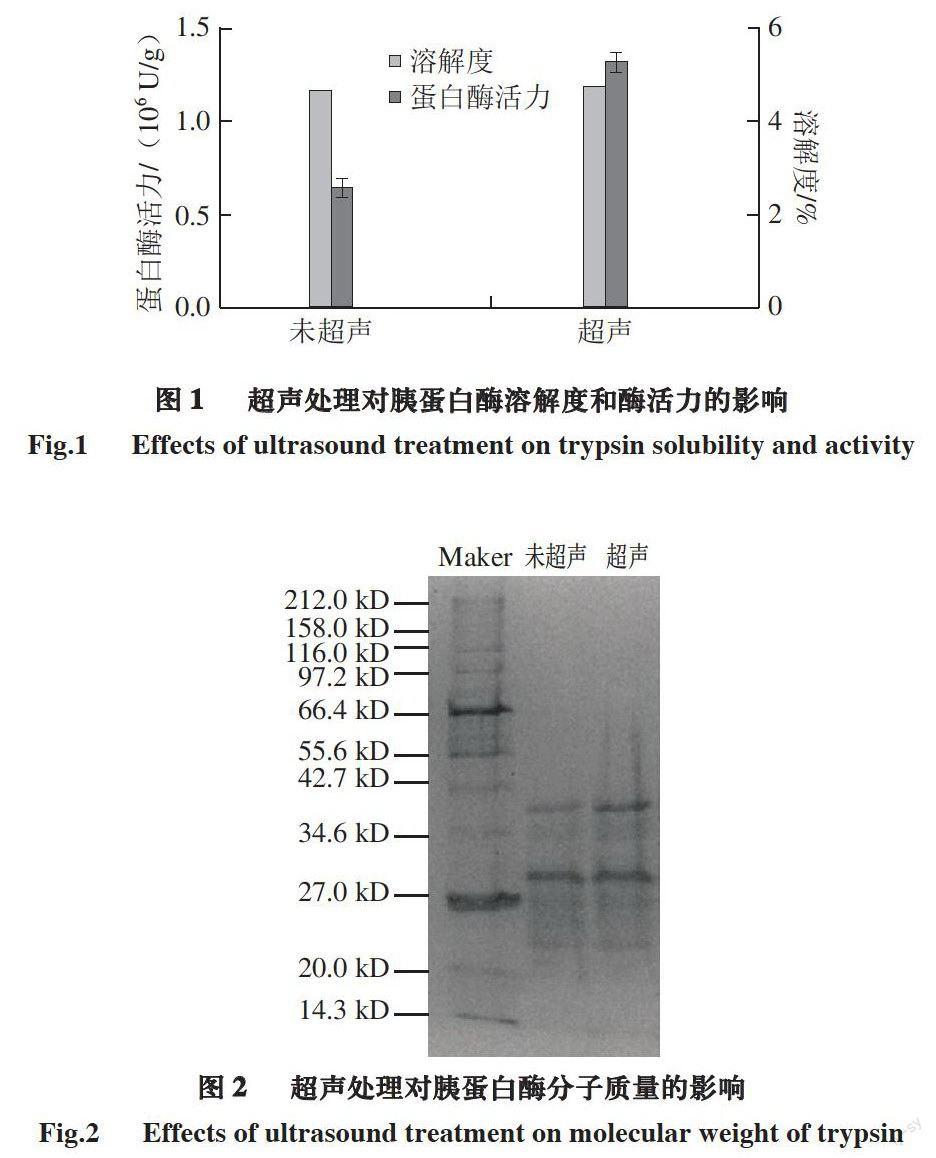
由图1可知,经超声波处理后,胰蛋白酶活力由6.55×105 U/g增加到1.34×106 U/g,提高了104.9%;溶解度从4.67%增加到4.78%,提高了2.36%。由图2可知,超声前后胰蛋白酶分子亚基种类分布一致,分子质量27~42.7 kD范围内有2 条较为明显的条带,且超声处理的胰蛋白酶条带颜色比未处理的深,说明超声可以增加胰蛋白酶在溶液中的溶解度。超声处理可以提高酶活性,并不是因为破坏了胰蛋白酶的分子结构,而是因为适宜的超声作用产生空化、机械及热效应,这些效应使胰蛋白酶的分子构象趋于合理化,以及使更多的催化部位暴露,从而提高了酶与底物反应效率[24]。
2.2 超声波处理对胰蛋白酶水解度的影响
由图3可知,经超声处理后,胰蛋白酶水解度显著提高,超声处理酶解液2 h左右就可以达到常规酶解6 h的水解程度。超声辅助处理可以极大地缩短酶解时间,避免血红蛋白因长时间放置而引起营养物质的损失和变质,极好地保证了其功能活性;类似的研究也证实了这一结论[17]。超声波通过供给体系能量使酶活性得到增强,增加酶与底物的反应几率。有研究显示超声波作用功率、时间对酶活性影响显著[25],可能因为超声波对酶官能团和微观结构产生影响,从而影响其活性[26]。超声作用能够提高酶解的效率,但是否对酶解液中的所提取生物活性物质有影响,还需要进一步地研究。
2.3 超声条件对DPPH自由基清除率和水解度的影响
2.3.1 超声时间对DPPH自由基清除率和水解度的影响
由图4可知,酶解液中猪血血红蛋白水解度和DPPH自由基清除率无线性相关性,且各水平间存在显著性差异(P<0.05)。超声6 min时,猪血血红蛋白水解度为11.43%,达到最高;9~15 min水解度趋于平缓,平均水解度为9.12%。总体而言,超声时间的变化对酶解液猪血血红蛋白水解度影响不大。超声6 min时,DPPH自由基清除率在为25.72%;9 min时达到最高,为57.53%;9 min后DPPH自由基清除率降低到40.69%左右。
超声产生的热效应在一定程度上可通过降低酶解所需的活化能促进体系的酶解,同时提高血红细胞的破碎率,增加体系反应的接触面,加速酶解反应的进行。当超声处理时间大于9 min时,猪血血红蛋白水解度反而降低,可能是由于在碱性条件下发生了成肽反应,使得已经被水解的游离态氨基酸缩合形成小肽或者多肽。超声处理9 min时的酶解液的抗氧活性最强,说明此时体系中所产生的氨基酸和肽的抗氧化能力最强。所以,选择7~9 min进入正交试验。
2.3.2 超声频率对DPPH自由基清除率和水解度的影响
由图5可知,超声频率对猪血血红蛋白水解度影响不显著(P≥0.05),但不同超声频率条件下所得DPPH自由基清除率有显著性差异(P<0.05)。超声频率在15~35 kHz范围内时,猪血血红蛋白平均水解度为9.12%。同一功率下,超声频率越小,空化作用越容易,所以实际运用中超声频率一般控制在20~40 kHz[27],超声的空化作用引起介质中产生的小气泡急速爆裂,从而增加体系能量。20~30 kHz范围内DPPH自由基清除率维持一个较高的水平,可能是由于在此频率范围内有利于抗氧化肽的产生或有利于抗氧化肽抗氧化能力的显现。所以,综合考虑,固定超声频率为20 kHz。
2.3.3 超声功率对DPPH自由基清除率和水解度的影响
由图6可知,超声功率在180~891 W范围内猪血血红蛋白水解度波动不大,540 W时水解度达到最高值11.15%,DPPH自由基清除率达到最大。一般而言,超声波强度增加,则空化强度随之增大,但达到一定强度后,空化趋于饱和,此时再增加超声波强度则会产生大量无用的气泡,从而增加散射衰减,降低空化强度。对于胰蛋白酶酶解猪血血红蛋白而言,180~891 W超声功率范围内均能促进酶解;不同超声功率条件下DPPH自由基清除率有显著性差异(P<0.05),所以选择超声功率在540 W附近范围内进入正交试验。
2.3.4 胰蛋白酶添加量对DPPH自由基清除率和水解度的影响
由图7可知,当胰蛋白酶添加量小于0.5%时,猪血血红蛋白水解度和DPPH自由基清除率总体随添加量的增加而增加;当大于0.5%时二者增加不显著,但各添加量水平间有显著性差异(P<0.05)。酶水解一定质量的样品,其水解能力是固定的,选择合适的胰蛋白酶添加量可以节约成本,因此综合考虑选择胰蛋白酶添加量0.6%~0.8%进入正交试验。
2.4 超声波辅助酶解制备猪血源抗氧化肽
在单因素试验基础上,超声频率为20 kHz,以DPPH自由基清除率为指标,利用三因素三水平正交试验优化超声波辅助酶解制备猪血源抗氧化肽,试验结果见表1,方差分析见表2。
由表1 R值可知,各因素对超声波辅助提取猪血源抗氧化肽的影响程度依次为:超声时间>酶添加量>超声功率。由表2可知,超声时间对提取抗氧化肽影响显著(P<0.05),而酶添加量和超声功率对其影响不显著。综合比较可得,超声频率为20 kHz时,最佳理论试验条件为超声时间8 min、胰蛋白酶添加量0.8%、超声功率540 W。对理论条件进行验证得到DPPH自由基清除率为75.78%,验证结果优于正交试验表中的结果,说明优化得到的效果较好。
3 结 论
在适宜的超声条件下,超声波辅助酶解显著提高了胰蛋白酶的酶活力,超声波辅助酶解2 h即可达到常规酶解6 h的程度,此时DPPH自由基清除率为75.78%;由SDS-PAGE分析中电泳条带可知,超声波对胰蛋白酶分子亚基的质量分布没有影响。通过单因素试验和正交试验得出,DPPH自由基清除率最佳时,制备抗氧化肽的酶解条件为:超声频率20 kHz、超声时间8 min、超声功率540 W、胰蛋白酶添加量0.8%、体系维持pH 8.0。
参考文献:
[1] 张艳梅, 佘锐萍, 刘天龙, 等. 猪血中抗菌肽类物质的分离纯化和抗菌活性研究[J]. 科技导报, 2008, 26(2): 33-37.
[2] PATA S, YARAKSA N, DADUANG S, et al. Characterization of the novel antibacterial peptide Leucrocin from crocodile (Crocodylus siamensis) white blood cell extracts[J]. Developmental & Comparative Immunology, 2011, 35(5): 545-553.
[3] 张凤英. 猪血红蛋白的酶解及其产物抗氧化活性研究[D]. 雅安: 四川农业大学, 2009: 8-14.
[4] 王加豪, 贾睿, 刘英娟, 等. 猪血多肽对建鲤抗氧化能力和免疫功能的影响[J]. 动物营养学报, 2014, 26(12): 3689-3697.
[5] CHANG C Y, WU K C, CHIANG S H. Antioxidant properties and protein compositions of porcine haemoglobin hydrolysates[J]. Food Chemistry, 2007, 100(4): 1537-1543.
[6] 宋华曾, 毕琳, 吕顺, 等. 鮰鱼皮明胶ACE抑制肽降血压活性的研究[J]. 现代食品科技, 2014, 30(2): 78-83.
[7] 姜莉, 徐怀德, 李艳伏. 酶解核桃蛋白制备ACE抑制肽及其功能特性研究[J]. 中国食品学报, 2015, 15(2): 79-85.
[8] 郑召君, 武如娟, 张日俊. 动物源性抗氧化肽的生物学功能及与其结构的关系[J]. 动物营养学报, 2015, 27(4): 1034-1040.
[9] JOHANSEN J S, HARRIS A K, RYCHLY D J, et al. Oxidative stress and the use of antioxidants in diabetes: linking basic science to clinical practice[J]. Cardiovascular Diabetology, 2005, 4(1): 5.
[10] 王赟, 李爱彬, 陈湘来, 等. 猪血的开发和利用[J]. 食品与机械, 2012, 27(1): 272-274.
[11] 易美华. 生物资源开发与加工技术[M]. 北京: 化学工业出版社, 2009: 77-81.
[12] ASGAR M, FAZILAH A, NURUL H, et al.Nonmeat protein alternatives as meat extenders and meat analogs[J]. Comprehensive Reviews in Food Science and Food Safety, 2010, 9: 513-529.
[13] SARMADI B H, ISMAIL A. Antioxidative peptides from food proteins:a review[J]. Peptides, 2010, 31(10): 1949-1956.
[14] 方俊, 卢向阳, 邱业先. 猪血多肽的制备及其生物活性研究[C]//中国农业生物技术学会第三届会员代表大会暨学术交流会论文摘要集. 北京: 中国农业生物技术学会, 2006: 1.
[15] 潘晓倩, 成晓瑜, 张顺亮, 等. 响应面法优化猪血红蛋白抗菌肽的制备工艺[J]. 肉类研究, 2013, 27(11): 1-5.
[16] 潘红梅, 游敬刚, 孙刚, 等. 蛋白酶-碱水解猪血血浆蛋白的条件优化研究[J]. 食品与发酵科技, 2010, 46(1): 51-55.
[17] 潘风光, 李洪山, 刘静波, 等. 超声预处理微波辅助酶解生产猪血活性肽工艺优化[J]. 农业工程学报, 2011, 27(增刊2): 282-287.
[18] 国家质量监督检验检疫总局. GB/T 23527—2009 蛋白酶制剂[S]. 北京: 中国标准出版社, 2009.
[19] 汪东风. 食品科学实验技术[M]. 北京: 中国轻工业出版社, 2006.
[20] 国家质量监督检验检疫总局. GB 5009.5—2010 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2010.
[21] 郭善广. 猪血血红蛋白酶解及其酶解产物抗氧化活性研究[D]. 广州: 华南理工大学, 2007: 20-34.
[22] 尧君. 蛋白质电泳实验技术[M]. 北京: 科学出版社, 1999.
[23] PE?TA-RAMOS E A, XIONG Y L. Antioxidant activity of soy protein hydrolysates in a liposomal system[J]. Journal of Food Science, 2002, 67(8): 2952-2956.
[24] 黄卓烈, 陈小丽, 巫光宏, 等. 超声波对胰蛋白酶活力影响的机理研究[J]. 中国生化药物杂志, 2009, 30(4): 230-234.
[25] 高大维, 于淑娟, 闵亚光. 超声波对纤维素酶活力的影响[J]. 华南理工大学学报: 自然科学版, 1997(11): 3.
[26] 赵凯. 超声波对麦冬多糖的提取率、结构及抗氧化活性的影响[D]. 西安: 陕西师范大学, 2011: 15-23.
[27] 张强, 孙昱东, 施宏虹, 等. 超声波技术及其在应用技术领域的机理研究[J]. 广东化工, 2013, 40(13): 90-91.