促血管生成素—2在肾细胞癌中的表达及其意义
2015-05-30杨文杰刘尚莹陈强王杰
杨文杰 刘尚莹 陈强 王杰
【摘要】 目的:研究促血管生成素-2(Angiopoietin-2,Ang-2)在肾细胞癌中的表达及其意义。方法:用免疫组化SP法检测50例肾细胞癌组织、配对癌旁组织以及6例正常肾组织中的Ang-2,并结合临床资料进行具体分析。结果:Ang-2在肾细胞癌组织、癌旁组织及正常肾组织中的阳性表达率分别为62.0%(31/50)、28.0%(14/50)和0(0/6),三者比较差异有统计学意义(P<0.05)。Ang-2在Ⅰ~Ⅱ期和Ⅲ~Ⅳ期的阳性表达率分别为51.4%(19/37)和92.3%(12/13);Ang-2在术前有血尿组和无血尿组的阳性表达率分别为85.7%(12/14)和52.8%(19/36),两者比较差异均有统计学意义(P<0.05)。结论:Ang-2在肾细胞癌组织表达明显高于非癌组织,表明其在肾细胞癌的发生发展中起重要作用,与肾细胞癌的分期、转移有关。
【关键词】 肾细胞癌; 促血管生成素-2; 免疫组化
【Abstract】 Objective:To study the expression and significance of Ang-2 in renal cell carcinoma. Method:The expression of Ang-2 was measured by immunohistochemistry in tissue sections from 6 cases of normal renal tissues, 50 cases of RCC and their pericarcinous tissues,their correlation with clinical data features were analyzed.Result:The positive rate for expression of Ang-2 in RCC, their pericarcinous and normal renal tissue were respectively 62.0%(31/50),28.0%(14/50) and 0(0/6),the expression of Ang-2 in RCC was significantly higher than those in pericarcinous tissue and normal renal tissue,the difference was statistically significant among them(P<0.05).The positive expression rates of Ang-2 in the stages of Ⅰ-Ⅱ and Ⅲ-Ⅳ were respectively 51.4%(19/37) and 92.3%(12/13),the positive expression rates of Ang-2 in the stages of Ⅲ-Ⅳ was higher than those in the stages of Ⅰ-Ⅱ;the positive expression rates of Ang-2 in patients with and without hematuresis were respectively 85.7%(12/14) and 52.8%(19/36),the positive expression rates of Ang-2 in RCC with hematuresis was higher than those without hematuresis,the differences were statistically significant(P<0.05).Conclusion:The expression of Ang-2 in the RCC is higher than those in the noncancerous renal tissue,which indicates that it may play an important role during the development of RCC.It has relationship to RCC angiogenesis, clinical stage and metastasis.
【Key words】 Renal cell carcinoma; Angiopoietin-2; Immunohistochemical stain
First-authors address:Shanxi Medical University,Taiyuan 030001,China
doi:10.3969/j.issn.1674-4985.2015.35.005
肾细胞癌(Renal cell carcinoma,RCC)是泌尿系统最常见的恶性肿瘤之一,又称肾腺癌,简称肾癌。在我国泌尿系统恶性肿瘤中发病率仅次于膀胱癌,约占成人恶性肿瘤的2%~3%[1]。RCC起源于肾实质泌尿小管上皮系统,是一类血管形成极为丰富的实性肿瘤,而新生血管形成在肿瘤的发生、发展及转移过程中起关键作用。近年来研究发现,促血管生成素(Angiopoietin,Ang)在肿瘤血管调控中起着重要作用。促血管生成素是血管内皮细胞的特异性酪氨酸激酶受体Tie-2的天然配体,目前发现的构型有4种,其中Ang-2是肿瘤性血管新生起始的强化因素,与肿瘤血管的生成关系密切[2]。本研究探讨Ang-2在肾细胞癌中的表达及其与患者性别、年龄、血尿及临床分期的关系。
1 资料与方法
1.1 一般资料 选取山西医科大学第一医院泌尿外科2013年1月-2014年12月间的50例肾癌手术切除标本,所有肾癌患者术前均未行放、化疗及免疫治疗,且均为单侧、单发,术后病理结果证实为肾细胞癌。其中男28例,女22例;年龄34~78岁,中位年龄61岁;术前有血尿者为14例,无血尿者为36例;根据美国癌症联合委员会(AJCC)肾癌临床分期标准分为:Ⅰ期20例,Ⅱ期17例,Ⅲ期9例,Ⅳ期4例。此外6例正常肾组织取自肾外伤及肾结石切除标本。
1.2 试剂 兔抗人Ang-2多克隆抗体及SP免疫组化试剂盒均购自博士德公司,一抗以1∶100稀释使用,步骤按说明书。DAB显色剂购自北京中杉金桥生物技术有限公司。其他试剂取自山西医科大学第一临床医学院病理教研室。
1.3 免疫组织化学染色方法 所有标本经甲醛固定,石蜡包埋,4 μm厚连续切片,经二甲苯脱蜡,梯度酒精脱水,H2O2阻断内源性过氧化物酶,枸橼酸盐微波高压抗原修复,滴加一抗置于37 ℃温箱孵育1 h,滴加二抗并于37 ℃温箱孵育30 min,PBS液洗涤3次,DAB底物显色,苏木素复染核,梯度酒精脱水,树脂胶封片,置于显微镜下观察,使用PBS液代替一抗作阴性对照。
1.4 判定标准 本研究在光镜下结合染色强度和阳性细胞百分比判断Ang-2在肾细胞癌中的阳性表达率。以肿瘤细胞胞浆或细胞膜上出现棕褐色颗粒为Ang-2阳性表达,染色愈浓代表阳性表达愈强。选取背景清晰的视野,在100倍显微镜下观察,按组织染色深浅分为:未染色记作0分;浅黄色记作1分;棕黄色记作2分;棕褐色记作3分。选取染色均匀的区域于400倍显微镜下观察,记录5个视野中阳性细胞的百分比,计算其平均值。按染色细胞的比例分为4分:0~25%记作0分;25%~50%记作1分;50%~75%记作2分;>75%记作3分。组织染色强度与染色细胞百分比级别之和3~6分为阳性,以上检测采用盲法独立检测。
1.5 统计学处理 使用SPSS 15.0统计软件进行分析,计数资料采用 字2检验,小样本(n<40)比较采用Fishers精确概率法检验,以P<0.05为差异有统计学意义。
2 结果
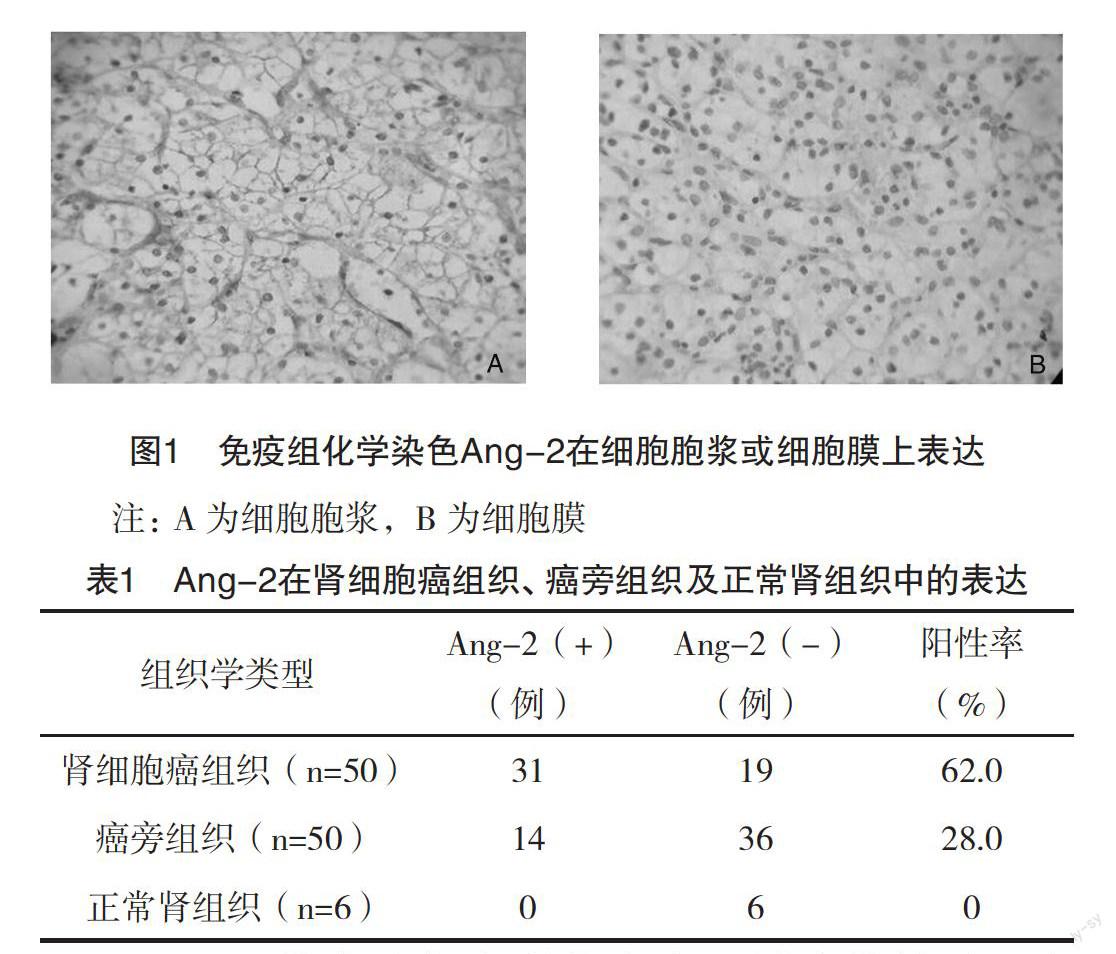
2.1 Ang-2在肾细胞癌组织、癌旁组织及正常肾组织中的表达 免疫组化学染色Ang-2主要表达于细胞胞浆或细胞膜上(图1),棕褐色颗粒状为阳性着色。50例RCC患者中Ang-2的阳性表达率为62.0%(31/50),癌旁组织中Ang-2的阳性表达率为28.0%(14/50),6例正常肾组织中Ang-2均无阳性表达。RCC中Ang-2阳性表达率明显高于癌旁组织及正常组织,差异均有统计学意义(P<0.05);Ang-2阳性表达率在癌旁组织与正常肾组织中比较差异无统计学意义(P>0.05),见表1。
2.2 Ang-2的表达与患者临床病理因素的关系 在50例RCC患者中,男性组Ang-2阳性表达率为60.7%(17/28),女性组Ang-2阳性表达率为63.6%(14/22),两组比较差异无统计学意义( 字2=0.01,P>0.05);60岁以下组Ang-2阳性表达率为70.8%(17/24),60岁以上组Ang-2阳性表达率为53.8%(14/26),两组比较差异无统计学意义( 字2=1.53,P>0.05);术前有血尿组Ang-2阳性表达率为85.7%(12/14),术前无血尿组Ang-2阳性表达率为52.8%(19/36),两组比较差异有统计学意义( 字2=4.64,P<0.05);临床分期为Ⅰ~Ⅱ期组Ang-2阳性表达率为51.4%(19/37),临床分期为Ⅲ~Ⅳ期组Ang-2阳性表达率为92.3%(12/13),两组比较差异有统计学意义( 字2=5.22,P<0.05)。
3 讨论
肿瘤的发生、发展、侵袭及转移都离不开新生血管的生成,新生血管网给肿瘤提供充足的血液供应、清除代谢产物的同时,在肿瘤的侵袭和转移过程中亦发挥着重要作用。研究发现,丰富的新生血管不仅使肿瘤细胞进入血液循环的机会增加,而且可以促进肿瘤细胞侵入邻近的淋巴管,从而发生淋巴转移,此外新生血管的基底膜容易渗漏,肿瘤细胞易穿透血管基底膜而发生远处转移[3]。辛华等[4]研究表明,肿瘤在缺乏新生血管的情况下,其发展、侵袭及转移的可能性均较小。肿瘤诱发血管的聚集和生成与肿瘤细胞本身释放的一类促血管生成因子密切相关。肿瘤新生血管的生成是一个多步骤、多因素的复杂过程,受多种血管生成因子及抑制因子的调控。促血管生成素(Angiopoietins,Ang)是新发现的一类具有受体促进剂及抑制剂的促进血管生成因子,主要由血管内皮细胞分泌产生,作用于Tie2受体,与其他血管生成促进因子共同发挥作用,其中Ang-1、Ang-2与肿瘤血管生成的关系最为密切,其分子结构相似,但生物学功能相反[5-6]。Ang-2基因位于8p23,编码496个氨基酸,与Ang-1有近60%的同源性,与Tie2受体结合而发挥作用[7]。Ang-2通过竞争性抑制Ang-1与Tie2相互作用而参与到血管的重塑,破坏血管的稳定性。在成人正常组织中,Ang-2分布于子宫、胎盘和卵巢等组织中,可能与上述组织生理过程中的血管重建有关[8]。但在病理情况下,Ang-2可表达于炎症、创伤以及肿瘤部位,参与上述部位的血管重建及组织修复过程,而在肿瘤组织中的表达,可能与肿瘤发生、发展、转移和侵袭等密切相关[9]。
目前有关肿瘤生长的研究认为,在早期肿瘤细胞形成所需要的血供和机体正常组织血供为同一来源,相互竞争,但由于肿瘤细胞的特点为高代谢、快速生长,所以其竞争血供的能力远强于机体正常组织,为阻止肿瘤细胞的生长,机体则分泌Ang-2使肿瘤占据的血管发生退化,起到自杀性防御的作用[10]。所以早期血管不随肿瘤的发生发展而增生,而是发生退化,此时Ang-2高表达,而VEGF的表达无明显变化[11]。后期由于肿瘤血管退化、血供减少,组织缺氧坏死,从而诱发VEGF的表达增加,同时Ang-2阻断Ang-1的血管稳定性作用,使血管内皮对生长因子的敏感性增强,促进血管重建。所以后期肿瘤血管增生显著,此时Ang-2及VEGF表达均明显增多。在肿瘤的发生发展过程中原有成熟血管发生了退化,肿瘤新生血管开始生成。Ang-2的表达增加可认为是肿瘤血管新生的标志,意味着肿瘤细胞的快速增长并易发生转移。
在人体正常组织中,Ang-2仅存在于女性生殖系统等部分血管重建部位,而其他正常成熟组织中呈无表达或轻微表达。病理情况下,Ang-2表达上调已在胃癌、食管癌及肝癌等多种肿瘤中得以证实。在细胞癌变过程的早期,Ang-2的表达增多,与肿瘤侵袭性及患者预后不良有关[12-13]。本研究结果显示,Ang-2在RCC组织中的表达率较癌旁组织及正常肾组织明显增高;Ang-2在血尿组中的阳性表达率高于无血尿组;Ang-2在临床分期Ⅲ~Ⅳ期组中的阳性表达率高于Ⅰ~Ⅱ期组,提示Ang-2的高表达可以诱导肿瘤血管的形成,进而参与了RCC的增殖、浸润及转移等恶性生物学行为的调节。
阻断肿瘤血管的形成,从而切断肿瘤细胞的血供来阻止其生长、转移,成为肿瘤研究和治疗的一个热点,由于肾细胞癌对放化疗均不敏感,以Ang-2及其受体作为一个治疗靶点在肾癌治疗领域开辟了一条新途径[14-15]。Ang-2在人体正常组织中低表达,作为抗肿瘤治疗的靶点使其对全身影响较小。肿瘤血管的生成是一个受多因素调控的复杂过程,Ang-2的表达与肿瘤新生血管的相互关系及其机制尚未完全清楚,将Ang-2作为靶点运用于肿瘤治疗任重而道远,需进一步深入研究。
参考文献
[1]那彦群,叶章群,孙颖浩.中国泌尿外科疾病诊断治疗指南2014版[M].北京:人民卫生出版社,2014:3-4.
[2] Ward E G,Grosios K,Markham A F,et al.Genomic structure of the Human angiopoietins show polymorphism in angiopoietin-2[J].Cytogenet Cell Genet,2001,94(3-4):147-154.
[3] Liotta L A,Steeg P S,Stetle-Stevenson W J,et al.Cancer metastasis and angiogenesis:an imblanance of positive and negative regulation[J].Cell,1989,64(2):327-336.
[4]辛华,郑雅娟,王维忠.肿瘤细胞侵袭及血行转移过程[J].中国肿瘤临床,2004,31(9):534-536.
[5] Deng P B,Hu C P,Xiong Z,et al.Treatment with EGCG in NSCLC leads to decreasing interstitial fluid pressure and hypoxia to improve chemotherapy efficacy through rebalance of Ang-1 and Ang-2[J].Chin J Nat Med,2013,11(3):245.
[6] Fiedler U,Krissl T,Koidl S,et al.Angiopoietin-1 and Angiopoietin-2 share the same binding domains in the Tie-2 receptor involving the first Ig-likeloop and the epidermal growth factor-like repeats[J].Bid Chem,2003,278(3):1721.
[7] Lai T,Li M,Zheng L,et al.Over-expression of VEGF in marrow stromal cells promotes angiogenesis in rats with cerebral infarction via the synergistic effects of VEGF and Ang-2 [J].J Huazhong Univ Sci Technolog Med Sci,2012,32(5):724.
[8] Rennel E S,Regula J T,Harper S J,et al.A human neutralizing antibody specific to Ang-2 inhibits ocular angiogenesis[J].Microcirculation,2011,18(7):598.
[9] Dellinger M,Hunter R,Bernas M,et al.Defective remodeling and maturation of the lymphatic vasculature in Angiopoietin-2 deficient mice[J].Dev Boil,2008,319(2):309.
[10] Holash J,Wiegand S J,Yancopoulos G D,et al.New model of tumor angiogenesis dynamic balance between vessel regression and growth mediated by angiopoietins and VEGF[J].Oncogene,1999,18(38):5356-5362.
[11] Holash J,Maisonpieire P C,Compton D,et al.Vessel cooption regress and growth in tumors mediated by angiopoietin and VEGF[J].Science,1999,284(5422):1994-1998.
[12] Hawighorst T,Skobe M,Streit M.Activation of the Tie2 receptor by angiopoietin-1 enhances tumor vessel maturation and impair squamous cell carcinoma growth[J].Am J Pathol,2002,160(4):1381.
[13] Ochiumi T,Tanaka S,Oka S,et al.Clinical significance of angiopoietin-2 expression at the deepest invasive tumor site of advanced colorectal carcinoma[J].Int J Oncol,2004,24(3):539.
[14] Peter M,Robert F,Jean B.Renal cell carcinoma:recent progress and future directions[J].Cancer Research,1997,57(11):5185-5189.
[15] Tian G,Dawson N.New agents for the treatment of renal cell carcinoma[J].Expert Rev Anticancer Ther,2001,1(4):546-564.
(收稿日期:2015-07-21) (本文编辑:周亚杰)
