可可蔗糖磷酸合成酶基因家族进化及组织表达分析
2015-05-30李付鹏等
李付鹏等


摘 要 在高等植物中,蔗糖磷酸合成酶(Sucrose phosphate synthase,SPS)是蔗糖合成的限速酶。在多种植物中都发现了SPS基因,而可可中尚未见相关报道。通过分析可可基因组数据库,鉴定出4个SPS候选基因,依次命名为TcSPS1、TcSPS2、TcSPS3和TcSPS4。4个基因的编码区(CDS)长度在3 075~3 228 bp之间,外显子数目为12~14,预测蛋白的平均分子量为118.15 ku,等电点均小于7。进化分析结果表明SPS基因家族分成3个亚族;TcSPS1和TcSPS2属于ClassⅠ亚族,TcSPS3和TcSPS4分别属于ClassⅡ亚族和ClassⅢ亚族。实时荧光定量PCR分析结果表明,TcSPS1与TcSPS2在树皮和果实中高量表达,TcSPS3和TcSPS4主要在叶片中表达。伴随着叶片和花蕾生长发育,各TcSPS基因表达量均呈现出上升的趋势,表明其与主要光合产物--蔗糖的合成或再合成有密切联系,参与可可“源库”器官中光合产物分配。
关键词 可可;蔗糖磷酸合成酶;表达分析;系统进化
中图分类号 S571.3 文献标识码 A
Phylogeny and Expression Profile of the Sucrose Phosphate
Synthase Gene Family in Cacao(Theobroma cacao L.)
LI Fupeng1,2,3, QIN Xiaowei1,2,3, WU Baoduo1,2,3, ZHAO Xizhu1,3,
WANG Hua1,3, ZHU Zihui1,3, LAI Jianxiong1,3*
1 Spice and Beverage Research Institute, Chinese Academy of Tropical Agricultural Sciences, Wanning,Hainan 571533, China
2 Ministry of Agriculture Key Laboratory of Genetic Resources Utilization of Spice and Beverage Crops, Wanning,Hainan 571533, China
3 Tropical Spice and Beverage Germplasm Repository, Ministry of Agriculture,Wanning,Hainan 571533, China
Abstract In higher plants, sucrose phosphate synthase(SPS)is widely considered as a key gene for sucrose synthesis. Although several paralogous genes encoding different isozymes of SPS have been identified and characterized in multiple plant genomes, detailed information about the SPS genes is still lacking for cacao. The study reported that the identification of four novel SPS genes from economically important cacao tree were designated as TcSPS1, TcSPS2, TcSPS3 and TcSPS4. Sequences analyses revealed that CDS of TcSPS1-4 were ranging from 3 075 bp to 3 228 bp, containing 12-14 exons. The average molecular weight of four predicted protein were 118.15 ku, and pIs of all proteins were less than 7. The expression patterns of the cacao SPS genes were investigated via Real-time PCR in various tissues, different developmental phases of leaf, flower bud. TcSPS1 and TcSPS2 were highly expressed in the bark and pods; TcSPS3 and TcSPS4 were predominantly expressed in the leaves. The transcription levels of TcSPS genes were continuously increased along with the leaf and flower bud development. These results indicated that TcSPS genes were significantly related with sucrose synthesis or re-synthesis in source and sink organs, and participate in photoassimilate translocation.
Key words Theobroma cacao L.; Sucrose phosphate synthase; Expression profile; Phylogenetic
doi 10.3969/j.issn.1000-2561.2015.09.010
蔗糖是植物光合产物和物质转运的主要物质形式,也是一种重要的信号因子。在植物体内,蔗糖主要由蔗糖磷酸合成酶(Sucrose phosphate synthase,SPS)和蔗糖磷酸酯酶(Suc-phosphatase,SPP)进行合成[1]。SPS是调控蔗糖合成的限速酶,催化果糖-6-磷酸和尿苷二磷酸葡萄糖形成蔗糖-6-磷酸,SPP再进一步催化蔗糖-6-磷酸形成蔗糖[2]。
SPS活性与蔗糖积累呈正相关,是光合产物分配的重要因子,在细胞壁合成、果实品质以及种子产量等方面发挥着重要作用[3-4]。玉米SPS与幼苗生长速度相关;其酶活性在杂交株系中表现出明显的杂种优势,并与干物质积累相关[5-6]。反义抑制马铃薯SPS基因,植株块茎中SPS活性降低,蔗糖合成受到抑制[7]。在马铃薯中过量表达SPS基因,叶片中SPS酶活性提高1倍,块茎中蔗糖含量显著提高,产量增加20%[8]。自玉米中克隆出首个SPS基因后[9],相继从20余种植物克隆了SPS基因[10]。SPS在高等植物中拥有一个基因家族,玉米中存在3个SPS基因位点,SPS基因在拟南芥中拥有4个成员[6,11]。研究结果表明,植物SPS基因家族包含3个亚族:ClassⅠ、ClassⅡ、ClassⅢ;SPS基因家族在进化过程中表现出结构保守,不同成员的功能发生分化[12]。马铃薯的4个SPS基因的表达模式表现出较强的组织差异性,随着植株发育表达量有显著变化[13]。水稻5个SPS基因的表达模式表现出特异性,OsSPS1主要在“源”器官中表达,OsSPS2、OsSPS6和OsSPS8在“源、库”器官的表达量相当[14]。从现有研究结果可以看出,同一物种不同SPS成员的调控与表达模式不尽相同,各成员在植物体行使的生物学功能也有显著差别。然而,可可中SPS基因家族的信息却未见报道。
可可(Theobroma cacao L.,2n=20)是世界三大饮料作物之一,世界上有超过50个国家进行规模种植。可可豆的主要经济成分是可可脂,主要用于制作巧克力等。蔗糖是种子发育以及脂肪合成的首要原料,可可豆中蔗糖浓度是脂类物质合成的限制因素[15-16]。因此,蔗糖合成速度及其浓度是影响可可脂合成的关键因素。本研究中,从可可全基因组数据库中分析筛选出4个SPS基因,对其进行了基因结构、进化等生物信息学分析,并利用实时荧光定量PCR技术对可可SPS基因家族成员时空表达模式进行了分析。
1 材料与方法
1.1 材料
1.1.1 植物材料 实验所用不同组织的材料,均来自中国热带农业科学院香料饮料研究所试验场的可可种质“TAS-R8”;各种组织(叶片、树皮、花蕾、果实)、不同发育时期的叶片和花蕾,采自“TAS-R8”成龄植株,样品采集后立即保存于-80 °C冰箱中备用。
1.1.2 药品和试剂 RNA提取试剂盒购自Omega公司(R6827-01),反转录试剂盒购自Fermentas公司(K1621),实时荧光定量PCR试剂SYBR Green Realtime PCR Master Mix购自Takara公司(QPK-201),DNase I购自Takara公司,其他生化试剂均为进口或国产分析纯试剂。
1.1.3 仪器和设备 实验过程中使用的移液器型号为Eppendorf Research plus,检测RNA所用电泳槽型号为上海天能HE-120,反转录所用PCR仪型号为Agilent SureCycler 8800,实时荧光定量所用PCR仪型号为Bio-rad CFX-96。
1.2 方法
1.2.1 RNA提取与cDNA第一条链合成 可可总RNA提取利用Omega RNA提取试剂盒,总RNA用DNase I处理之后,用1%琼脂糖凝胶进行检测。RNA提取之后及时进行反转录,cDNA第一条链用Fermentas反转录试剂盒合成,产物用双蒸水稀释50倍保存于-20 °C冰箱中备用。
1.2.2 可可SPS基因家族成员分离及序列分析 基于可可全基因组序列,利用Blast搜索可可基因组序列中SPS基因家族成员。具体方法如下,利用拟南芥SPS蛋白的保守区域在可可全基因组数据库(http://www.cacaogenomedb.org)进行BlastP分析,鉴定可可SPS基因家族成员。利用在线软件GSDS对可可SPS基因的外显子/内含子基因结构进行分析[17]。利用EaPASy在线工具(http://expasy.org/tools/)对可可SPS蛋白分子量、等电点、保守性等进行分析。
1.2.3 序列进化分析 基于拟南芥、杨树SPS蛋白序列在NCBI GenBank数据库搜索SPS同源序列,利用MEGA 4.0软件[18]对来自可可(TcSPS1-4)、猕猴桃(AcSPS2)、拟南芥(AtSPS145.15.2)、白菜(BraSPS4)、复活植物(CpSPS1-2)、黄瓜(CsSPS24)、柑橘(CuSPS1)、大麦(HvSPS1)、番茄(LeSPS1)、蒺藜苜蓿(MtrSPS2-3)、烟草(NtSPS1-2)、水稻(OsSPS128)、杨树(PtrSPS1-3)、蓖麻(RcSPS14)、甘蔗(SofSPS12)、菠菜(SolSPS1)、小麦(TaSPS12379)、葡萄(VvSPS13)、原生更苏植物(XhSPS2)、玉米(ZySPS1-2)20种植物42条SPS蛋白序列进行分子系统学分析;具体采用Neighbour-joining方法,测验进行1 000次bootstrap统计学检测。
1.2.4 定量PCR分析 利用实时荧光定量PCR技术对TcSPS基因家族成员进行时空表达模式分析,以GAPDH作为内参基因[19]。扩增TcSPS1-4基因及内参基因的特异引物用Primer Premier 5.0软件进行设计,由上海生工生物工程公司合成;引物序列见表1。PCR反应体系为20 μL,包含2×SYBR Green Realtime PCR Master Mix,10 μmol/L的左右引物各0.8 μL,稀释50倍的cDNA模板8.4 μL,每个反应组合设置3个重复。PCR反应程序为95 °C预变性3 min;95 °C 变性10 s;57 °C退火15 s;72 °C 延伸30 s;进行39个循环,每个循环采集一次荧光数据;从65 °C到95 °C,以0.1 °C/s 绘制熔解曲线。反应结束后,利用Bio-rad CFX-96软件分析扩增曲线和熔解曲线,运用2-△CT方法分析实时荧光定量数据。
2 结果与分析
2.1 TcSPS基因家族分离与序列分析
利用BlastP搜索分析可可基因组数据库,筛选出4个SPS候选基因,分别命名为TcSPS1、TcSPS2、TcSPS3和TcSPS4。4个基因编码的氨基酸长度在1 024~1 075 aa之间,预测蛋白的平均分子量为118.15 ku,等电点均小于7。4个基因氨基酸序列的保守性分析结果表明,TcSPS1与TcSPS2的相似性最高为77.3%,TcSPS1与TcSPS4的相似性最高为55.8%(表2)。
2.2 TcSPS基因结构及系统进化分析
分析比较基因的外显子/内含子组织结构有助于了解整个基因家族进化。GSDS软件分析结果表明,TcSPS基因家族成员包含12~14个外显子(图1),与植物中其他的SPS基因(如HbSPS1OsSPS1等)结构相似[20-21],表明植物SPS的外显子/内含子组织结构在进化中非常保守。除一些外显子长度的差异外,4个基因间外显子/内含子组织有较高的保守性,长度为64、132、177、54、63、128 bp均位于4个基因CDS序列中相似的位置。TcSPS1与TcSPS2的外显子数目均为13个,外显子/内含子组织结构也更保守;除以上6个外显子的长度位置相同外,还共同包含长度为183、90、699、117、274 bp的外显子。TcSPS基因多数的内含子长度为70~170 bp之间;TcSPS基因家族成员包含的最长的内含子为999 bp,为TcSPS2的第2个内含子。
为了更好的了解TcSPS基因家族成员与植物其他SPS基因间的进化关系,利用MEGA 4.0软件构建了包含TcSPS1-4在内42个SPS蛋白的系统进化树(图2)。图2显示,42个SPS蛋白可以明显分为3个类群(ClassⅠ、ClassⅡ和ClassⅢ),每个亚族均含有双子叶植物与单子叶植物的SPS成员,表明早在单双子叶植物分化之前SPS基因就已经分化出了3个祖先。相比较ClassⅡ和ClassⅢ的单子叶分支,ClassⅠ的单子叶分支又分出2个亚分支,每个亚分支均包含水稻和小麦的SPS成员,表明ClassⅠ亚族的祖先SPS基因在单子叶进化出来之前就已经发生了分化。对可可而言,3个亚族均包含TcSPS,TcSPS1和TcSPS2属于ClassⅠ亚族,TcSPS3和TcSPS4分别属于ClassⅡ亚族和ClassⅢ亚族。在各亚族中TcSPS均与PtrSPS聚在同一分支中, 表明可可与杨树的SPS基因亲缘关系较近,从一定程度上说明可可与杨树的分化较晚。综合分析TcSPS基因结构及系统进化树,外显子/内含子组织结构与基因的系统进化分析一致,TcSPS基因与物种间的生物进化关系趋于一致。
2.3 TcSPS基因表达模式分析
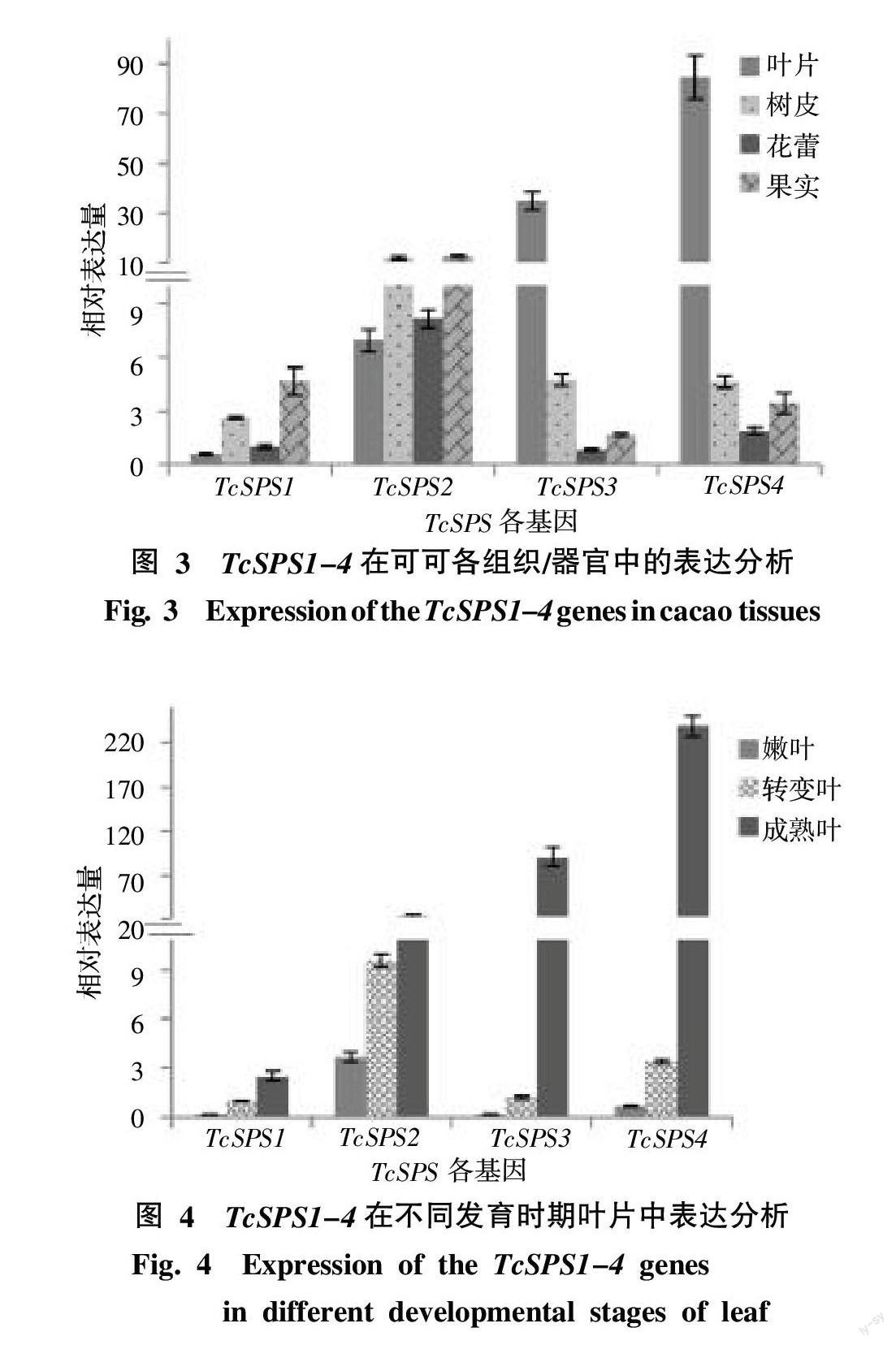
为了更好了解TcSPS基因的潜在功能,利用Real-time PCR技术分析了TcSPS基因在叶片、树皮、花蕾和果实中时空表达模式。由图3可知,TcSPS基因在所检测的4种组织/器官中均有表达,不同基因的表达模式存在差异但互有重叠。TcSPS1在果实中表达量最高,其次为树皮,在叶片中的表达量最低,TcSPS1基因在果实与叶片中的表达量相差约8倍。TcSPS2与TcSPS1有相似的表达趋势,在各组织/器官TcSPS2的表达量均高于TcSPS1;然而TcSPS2在各组织/器官间的表达差异较小,果实与叶片中的表达量相差约2倍。TcSPS3和TcSPS4表达模式类似,在叶片中表达量最高,其次为树皮,在花蕾中的表达量最低;TcSPS3和TcSPS4基因在叶片与花蕾中表达量分别相差约42和44倍,而在树皮与花蕾中表达量仅分别相差约5和2倍。
为了更进一步弄清TcSPS基因在“源库”器官发育过程中的功能,分析了不同发育时期叶片和花蕾中各TcSPS基因的表达模式。各TcSPS基因伴随着叶片生长发育,基因表达量均呈现出上升的趋势,成熟叶片中TcSPS1、TcSPS2、TcSPS3和TcSPS4的表达量相比较于嫩叶分别升高了15、6、537、364倍,见图4。TcSPS1、TcSPS2和TcSPS3基因表达量伴随着花蕾的发育呈现上升的趋势,均在开放的花中达到最大值,比小于2 mm花蕾组织中分别升高了17、3和119倍。TcSPS4基因在可可花开放之前,随着花蕾发育表达量略有下降,其在花蕾开放之后,表达量升高约3倍(图5)。
3 讨论与结论
近年来,随着基因组的快速发展,越来越多植物全基因组信息被公布出来,这就给通过比较基因组学克隆SPS基因带来极大便利。本研究借助已经测序的Criollo和Amelonado可可种质[22-23],从可可基因组中鉴定出4个TcSPS基因,平均含有13个外显子,预测蛋白的分子量在115.60~120.58 ku之间,与植物其他SPS成员非常相似[21]。植物SPS拥有3个亚族,每个亚族的双子叶植物与单子叶植物的SPS成员均分别聚成一个分支,说明SPS基因在单双子叶分化前已经分化,之后随着物种的演化而进化[12]。3个亚族均含有TcSPS成员,TcSPS1和TcSPS2属于ClassⅠ亚族,TcSPS3属于ClassⅡ亚族,TcSP4属于ClassⅢ亚族。综合外显子/内含子组织结构与系统进化结果,植物SPS基因在进化过程具有较强的保守性。
SPS是蔗糖合成的限速酶,实时荧光定量分析表明TcSPS1-4在所有被检组织/器官中均有表达,表达模式存在差异但互有重叠,表明各TcSPS基因在植株中行使着不同功能,广泛参与到可可生长发育的许多方面。蔗糖主要在“源”器官中合成,仅留少量供“源”器官使用,大部分都被转运到“库”器官/组织供其生长或转化成储存物质储藏起来。SPS与“源”器官中蔗糖的合成有密切关系,拟南芥SPS基因的无效突变体,叶片中蔗糖含量维持在偏低水平[24]。玉米“源”叶片中SPS活性与植株营养生长和籽粒产量呈现显著正相关关系[25]。水稻的OsSPS1和OsSPS11在“源”器官中有较高的表达量,而OsSPS2、OsSPS6和OsSPS8在“库”器官中表达量较高[14]。在本研究中,TcSPS1和TcSPS2在“库”器官(果实)和光合产物运输通道(树皮)中有较高的表达量,TcSPS3和TcSPS4在“源”器官(叶片)表达量最高。TcSPS1和TcSPS2可能参与果实中蔗糖的再合成[26],而TcSPS3和TcSPS4可能调控“源”器官中蔗糖合成与分配,参与到蔗糖在“源”器官的上载过程。尽管各TcSPS基因的表达模式不同,然而4个TcSPS均并伴随着花蕾的发育表现出上升的趋势,在开放的花中达到最大值,表明TcSPS基因与可可生殖器官的发育密切相关。
本研究对可可SPS基因家族成员的外显子/内含子组织结构、系统进化以及表达模式进行了系统的分析,研究结果为进一步分析可可SPS基因家族成员的生理生化功能提供有力参考与借鉴。
参考文献
[1] Cardini C E,Leloir L F,Chiriboga J. The biosynthesis of sucrose phosphate[J]. J Biol Chem,1955,214(1):149-155.
[2] Wang L,Cui N,Zhang K Y,et al. Research advance of sucrose phosphate synthase(SPS)in higher plant[J]. Int J Agric Biol,2013,15:1 221-1 226.
[3] Ishimaru K,Ono K,Kashiwagi T. Identification of a new gene controlling plant height in rice using the candidate-gene strategy[J]. Planta,2004,218(3):388-395.
[4] Babb V M,Haigler C H. Sucrose phosphate synthase activity rises in correlation with high-rate cellulose synthesis in three heterotrophic systems[J]. Plant Physiol,2001,127(3):1 234-1 242.
[5] Causse M,Rocher J P,Pelleschi S,et al. Sucrose-phosphate synthase: an enzyme with heterotic activity correlated with maize growth[J]. Crop Sci,1995,35(4):995-1 001.
[6] Prioul J L,Pelleschi S,Sene M,et al. From QTLs for enzyme activity to candidate genes in maize[J]. J Exp Bot,1999,50(337):1 281-1 288.
[7] Geigenberger P,Reimholz R,Deiting U,et al. Decreased expression of sucrose phosphate synthase strongly inhibits the water stress-induced synthesis of sucrose in growing potato tubers[J]. Plant J,1999,19(2):119-129.
[8] Ishimaru K,Hirotsu N,Kashiwagi T,et al. Overexpression of a maize SPS gene improves yield characters of potato under field conditions[J]. Plant Prod Sci,2008,11(1):104-107.
[9] Worrell A C,Bruneau J M,Summerfelt K,et al. Expression of a maize sucrose phosphate synthase in tomato alters leaf carbohydrate partitioning[J]. Plant Cell,1991,3(10):1 121-1 130.
[10] Lunn J E,MacRae E. New complexities in the synthesis of sucrose[J]. Curr Opin Plant Biol,2003,6(3):208-214.
[11] Langenkamper G,Fung R W,Newcomb R D,et al. Sucrose phosphate synthase genes in plants belong to three different families[J]. J Mol Evol,2002,54(3):322-332.
[12] Lutfiyya L L,Xu N,D'Ordine R L,et al. Phylogenetic and expression analysis of sucrose phosphate synthase isozymes in plants[J]. J Plant Physiol,2007,164(7):923-933.
[13] Reimholz R,Geiger M,Iiaake V,et al. Potato plants contain multiple forms of sucrose phosphate synthase, which differ in their tissue distributions, their levels during development, and their responses to low temperature[J]. Plant Cell Environ,1997,20(3):291-305.
[14] Okamura M,Aoki N,Hirose T,et al. Tissue specificity and diurnal change in gene expression of the sucrose phosphate synthase gene family in rice[J]. Plant Sci,2011,181(2): 159-166.
[15] Pence V C. Abscisic Acid and the maturation of cacao embryos in vitro[J]. Plant Physiol,1992,98(4):1 391-1 395.
[16] Bucheli P,Rousseau G,Alvarez M,et al. Developmental variation of sugars, carboxylic acids, purine alkaloids, fatty acids, and endoproteinase activity during maturation of Theobroma cacao L. seeds[J]. J Agr Food Chem,2001,49(10): 5 046-5 051.
[17] 郭安源,朱其慧,陈 新,等. GSDS:基因结构显示系统[J]. 遗传,2007,29(8):1 023-1 026.
[18] Kumar S,Nei M,Dudley J,et al. MEGA: a biologist-centric software for evolutionary analysis of DNA and protein sequences[J]. Brief Bioinform,2008,9(4):299-306.
[19] Pinheiro T T,Litholdo C G, Sereno M L,et al. Establishing references for gene expression analyses by RT-qPCR in Theobroma cacao tissues[J]. Genet Mol Res,2011,10(4):3 291-3 305.
[20] 肖小虎,方永军,曹 冰,等. 巴西橡胶树蔗糖磷酸合成酶基因的克隆和表达分析[J]. 热带作物学报,2013,34(6):1 065-1 070.
[21] Castleden C K,Aoki N,Gillespie V J,et al. Evolution and function of the sucrose-phosphate synthase gene families in wheat and other grasses[J]. Plant Physiol,2004,135(3):1 753-1 764.
[22] Argout X,Salse J,Aury J M,et al. The genome of Theobroma cacao[J]. Nat Genet,2011,43(2):101-108.
[23] Motamayor J C,Mockaitis K,Schmutz J,et al. The genome sequence of the most widely cultivated cacao type and its use to identify candidate genes regulating pod color[J]. Genome Biol,2013,14(6):r53.
[24] Sun J,Zhang J,Larue C T,et al. Decrease in leaf sucrose synthesis leads to increased leaf starch turnover and decreased RuBP regeneration-limited photosynthesis but not Rubisco-limited photosynthesis in Arabidopsis null mutants of SPSA1[J]. Plant Cell Environ,2011,34(4):592-604.
[25] Sarquís J I,Gonzalez H,de Jiménez E S,et al. Physiological traits associated with mass selection for improved yield in a maize population[J]. Field Crops Res,1998,56(3):239-246.
[26] Zhang X M,Wang W,Du L Q,et al. Expression patterns, activities and carbohydrate-metabolizing regulation of sucrose phosphate synthase, sucrose synthase and neutral invertase in pineapple fruit during development and ripening[J]. Int J Mol Sci,2012,13(8):9 460-9 477.
