流产嗜性衣原体MIP蛋白单克隆抗体的制备及特性鉴定
2015-05-29蔺俊丽李兆才曹小安周继章
蔺俊丽,李兆才,曹小安,赵 荣,周继章
(中国农业科学院兰州兽医研究所,兰州730046)
流产嗜性衣原体(Chlamydophila abortus)是严格细胞内寄生的革兰氏阴性细菌,是一种重要的人兽共患病病原。动物感染流产嗜性衣原体可引起妊娠母畜流产、死产或者产弱胎,公畜发生睾丸炎、尿道炎等症状,孕妇与感染的动物直接接触也会造成流产及全身感染等症状。国内目前对该病的检测方法是间接血凝实验(IHA),该法虽然操作简单,但有不可避免的主观性,容易在临床上造成误诊,为控制和净化该病带来困难。对该病的治疗目前一般采用抗生素治疗,但容易导致细菌产生耐药性,引发持续、慢性、亚临床感染。
流产嗜性衣原体巨噬细胞感染增强蛋白(Macrophage infectivity potentiator,MIP)作为一种免疫显性抗原[1-2]近年来越来越多的被研究。本研究利用前期纯化的重组MIP蛋白制备单克隆抗体,以期为进一步建立敏感的诊断方法以及流产嗜性衣原体的治疗和相关致病机制的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞株与动物 流产嗜性衣原体SX5标准株、骨髓瘤细胞SP2/0为兰州兽医研究所人兽共患细菌病研究室保存,SPF级Balb/c小鼠(雌性,8周龄)购自兰州兽医研究所动物实验中心。
1.1.2 主要试剂 RPMI 1640、HAT和HT选择培养基以及胎牛血清,Gibco公司;细胞融合剂PEG4000、弗氏完全佐剂、弗氏不完全佐剂,Sigma公司;细胞培养瓶、96孔细胞培养板、酶标板,Corning公司;单克隆抗体亚类检测试剂盒,Protein tech公司;SPF鸡胚,北京妫川亚申养殖中心。
1.2 试验方法
1.2.1 小鼠免疫及MIP多克隆抗体的检测 将纯化的重组MIP蛋白与弗氏完全佐剂乳化完全后,免疫3只小鼠,腹腔注射和皮下多点注射(50 μg蛋白/只),二免、三免于第14天、第28天进行,用不完全弗氏佐剂乳化。第三次免疫7 d后,小鼠尾静脉采血,分离血清,间接血凝法测定效价,选择高效价者加强免疫3 d后进行细胞融合试验,小鼠血清保存备用。
1.2.2 细胞融合 参照文献[3]无菌分离免疫鼠脾脏制备脾淋巴细胞悬液,以4∶1数量与SP2/0骨髓瘤细胞混合,室温1200 r/min离心8 min,使细胞沉淀,移去上清,往沉淀中缓慢加入1 mL预热40℃的 PEG(40%),时间控制在60 s左右,HAT培养基定容细胞悬液体积至50 mL后,转入铺有饲养细胞的96孔细胞培养板中(100 μL/孔),37℃,5%CO2温箱中静置培养10 d。
1.2.3 杂交瘤细胞的筛选及杂交瘤细胞株的建立
用纯化的MIP蛋白作为包被抗原,以融合细胞的上清液为一抗,间接ELISA检测筛选分泌抗MIP蛋白抗体的阳性克隆。将初步筛选得到的疑似阳性细胞克隆株,用HT培养基有限稀释后,再进行3次亚克隆,用同样的方法筛选,至阳性率达到100%,将所得的细胞株扩大培养,建株保存,培养上清即含有大量单克隆抗体。
1.2.4 抗MIP蛋白单克隆抗体的特性鉴定
1.2.4.1 间接ELISA方法检测抗体效价 以纯化的重组MIP蛋白包被酶标板(2 μg/孔),4℃过夜,PBST洗涤四次,5%BSA 37℃封闭1 h,洗涤,将单克隆抗体上清经倍比稀释加入,37℃孵育45 min,洗涤,加入HRP标记的羊抗鼠二抗(1∶10000),37℃孵育45 min后洗涤,加入显色剂TMB,避光反应10 min,加入2 mol/L H2SO4终止反应,立即于酶标仪上读出每孔450 nm处的吸光值,以产生阳性反应的最高稀释倍数为其效价,同时以SP2/0骨髓瘤细胞培养上清为阴性对照。
1.2.4.2 单克隆抗体亚类鉴定 操作步骤按照Protein tech公司小鼠单克隆抗体亚型鉴定试剂盒说明书进行。
1.2.4.3 单克隆抗体腹水制备以及相对亲和力鉴定 按常规方法[4]取8周龄Balb/c小鼠进行腹水制备,并纯化腹水单抗。以纯化的重组MIP蛋白(2 μg/孔)包板,单抗浓度依次为 80、40、20、10、5 μg/mL,每个梯度三孔,37 ℃孵育 45 min,洗涤后加入酶标二抗(1∶10000),37℃孵育45 min后洗涤,加底物显色测定,按50%最大结合的单抗计算其相对亲和力。
1.2.4.4 单克隆抗体特异性鉴定 将接种流产嗜性衣原体的鸡胚卵黄囊膜研磨,加入SPG缓冲液,5000 r/min离心15 min以除去大块组织,弃去沉淀,保留上清,14000 r/min离心30 min以沉淀衣原体,弃去上清,保留沉淀,用SPG重悬沉淀后进行超声破碎,超声功率400 W,超声5 s间隙5 s,超声30 min后将流产嗜性衣原体进行SDS-PAGE,23 V转膜20 min,5%脱脂奶粉(PBST稀释)孵育1 h后,以纯化的腹水为一抗(1∶1000,2% 脱脂奶粉稀释)4℃孵育过夜,PBST洗涤5次,每次3 min,以HRP标记的羊抗鼠IgG为二抗(1∶10000)室温孵育1 h后PBST洗涤,进行显色曝光。
1.2.4.5 杂交瘤细胞株染色体核型分析 参照文献[5]采用秋水仙素阻断法进行染色体计数。选择
对数生长期的杂交瘤细胞,加入秋水仙素溶液,终浓度0.4 mmol/mL,继续培养6 h后,用10 mL离心管1000 r/min离心10 min,弃上清,缓慢加入5 mL 37℃遇热的KCl(0.75 mol/L)重悬沉淀,置37℃15 min后加入1 mL固定液(甲醇∶乙酸=3∶1)1 mL,缓慢混匀,1000 r/min 离心10 min,加5 mL固定液重悬沉淀,室温放置15 min,1000 r/min离心10 min,弃上清,重复一次后重悬,吸取100 μL悬液,于1.5 m高度处垂直低落在-20℃预冷的载玻片上,自然风干后,滴加吉姆萨染色液,20 min后轻柔的洗去染色后,100×油镜显微镜观察染色体数目。
1.2.4.6 杂交瘤细胞株分泌抗体稳定性试验 参照文献[6]将杂交瘤细胞传代20次,每次传代测细胞培养上清的抗体效价;将杂交瘤细胞反复冻存复苏,测抗体效价;将液氮罐中冻存的阳性杂交瘤细胞,每20 d复苏一次,连续3个月,测上清液中的抗体效价。
1.2.4.7 流产嗜性衣原体中和试验 用SPG缓冲液倍比稀释 C.abortus(1∶1、1∶2、1∶4、1∶8),与相同体积的单克隆抗体混合,接种200个鸡胚,同时设培养基对照组(每株单抗接种100个鸡胚,每个稀释梯度以及对照组20个鸡胚)。培养3 d后每天检查死亡鸡胚数,直到第9天,培养结束后计算鸡胚相对死亡率。
2 结果
2.1 杂交瘤细胞株的建立 经3次小鼠常规免疫和一次加强免疫,细胞融合和3次亚克隆,挑选出疑似阳性克隆,以纯化MIP蛋白包被酶标板,间接ELISA鉴定疑似阳性细胞克隆,共挑选出7个阳性克隆,继续传代培养后得到2个强阳性。阳性克隆连续亚克隆3次,反复冻存和复苏之后仍能稳定分泌单克隆抗体,确定为阳性杂交瘤细胞株,并命名为 M 1,M 3。
2.2 单克隆抗体效价及亚类鉴定 ELISA方法测定两株单克隆抗体的效价均为1∶1600(表1);利用单抗亚型鉴定试剂盒对2株单抗进行亚型鉴定,两株单抗均为IgG1,轻链均为κ链(图1)。
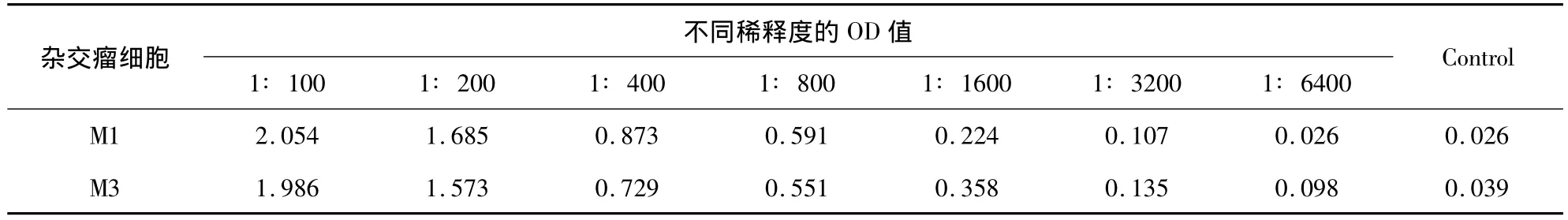
表1 间接ELISA对M1和M3杂交瘤细胞培养上清抗体效价的测定结果

图1 M1和M3抗体类及亚类鉴定结果
2.3 单克隆抗体相对亲和力鉴定 ELISA方法测定单抗相对亲和力,两株单抗50%最大结合浓度均为10 μg/mL,50%最大结合浓度越低,表明亲和力越大,所需抗体浓度越低。
2.4 抗体特异性鉴定 在27 kD左右出现明显的两条带,而其他地方没有,说明两株单克隆抗体能特异性识别重组MIP蛋白,结果见图2。

图2 M1和M3 Western blot特异性鉴定图
2.5 杂交瘤细胞系染色体分析 用秋水仙素阻断法进行染色体数目统计,两株杂交瘤细胞染色体数目相对稳定,Balb/c小鼠脾细胞和SP 2/0的染色体数目分别为20对和31~34对,则所获的杂交瘤细胞数应该51~54对之间,结果见图3。
图3 M1和M3杂交瘤细胞染色体镜检图(吉姆萨染色,100×)
2.6 杂交瘤细胞株分泌单克隆抗体稳定性试验胞体外传代20次,反复冻存复苏8次,仍能稳定分泌单克隆抗体,且将液氮罐中冻存3个月的杂交瘤细胞复苏,仍能稳定分泌抗体。
2.7 流产嗜性衣原体中和试验 2株单克隆抗体经倍比稀释后与同体积经SPG稀释的C.abortus混合,感染鸡胚,同时用培养基做对照。结果两株单克隆抗体均能降低鸡胚感染率,鸡胚感染率0~10%,而对照组感染率明显高,为95% ~100%,说明所制备的MIP单克隆抗体具有良好的中和作用,能有效阻断感染(图4)。

图4 M1和M3对流产嗜性衣原体的中和试验结果
3 讨论
MIP最初发现于嗜肺军团菌中,作为毒力因子[7]在军团菌胞内感染早期发挥重要作用。此后,在铜绿假单胞菌[8]、伯纳特立克次氏体[9]、大肠杆菌[10]以及鹦鹉热衣原体[2]、肺炎衣原体[11]中陆续发现了Mip样蛋白和mip样基因。
MIP是一种“经典”的细菌脂蛋白[12],在衣原体发育的两个阶段均有表达[13]。MIP在CD14的帮助下激活 TLR2/TLR1/TLR6通路[12],表明 MIP在衣原体感染中参与了引发炎症反应的致病机制。此外,流产嗜性衣原体MIP蛋白相对于以往衣原体研究的优势蛋白MOMP、POMP等,与血清有较高的反应性[14],这表明在流产嗜性衣原体感染过程中MIP蛋白扮演了重要角色。
本研究利用前期纯化的重组MIP蛋白,运用特异、灵敏的间接ELISA方法筛选杂交瘤细胞株,获得了两株单抗。进一步利用细胞核型分析、单抗亚型鉴定、单抗亲和力、单抗中和活性鉴定、单抗特异性鉴定对两株单抗进一步确认和评价。虽然采用了常规方法,但获得了两株特异性高、稳定性好的理想单抗。
对于单抗中和能力的鉴定,陆春雪等[1]利用制备的单抗与衣原体混合后感染Hela细胞,然后对细胞进行荧光染色,在荧光显微镜下观察以确定单抗的中和能力。本研究采取类似的方法将单抗与流产嗜性衣原体经倍比稀释,充分混合后接种鸡胚,从第3天开始每天查看鸡胚死亡情况直到第9天,直接计算各稀释度所有天数中总的鸡胚死亡率,以此判定MIP蛋白单克隆抗体的中和能力。本研究接种鸡胚的方法虽然传统,但是操作简便,假阳性概率低,结果可靠。通过中和试验验证了抗MIP单抗能显著降低鸡胚感染死亡率,由此可以判定,在流产嗜性衣原体感染鸡胚过程中,MIP做为一种毒力因子被其单克隆抗体中和,也从另外一个方面说明了流产嗜性衣原体MIP在动物感染过程中扮演着重要的角色,这为进一步研究流产嗜性衣原体感染动物的致病机制提供了新的思路。
此外,两株单抗50%最大结合浓度达到10 μg/mL,抗体亲和力较高,结合半抗原能力较强,这为后续建立双抗体夹心ELISA,阻断ELISA等敏感的、特异的检测方法奠定了基础。
总之,制备成功的两株单克隆抗体不仅对于建立敏感的动物衣原体病诊断方法奠定了基础,也为进一步研究流产嗜性衣原体的致病机制提供了新的思路。
[1]Chunxue Lu,Bo Peng,Yimou Wu,et al.Induction of protective immunity against Chlamydia muridarum intravaginal infection with the chlamydialimmunodominantantigen macrophageinfectivity potentiator[J].Microbes and Infection,2013(15):329 -338.
[2]Rockey D D,Chesebro B B,Heinzen R A,et al.A 28 kDa major immunogen of Chlamydia psittaci shares identity with Mip proteins of Legionella spp.and Chlamydia trachomatis -cloning and characterization of the C.psittaci mip -like gene[J].Microbiology,1996,142(Pt4):945-953.
[3]赵 凯,孙立新,孙宇石,等.抗紫杉醇单克隆抗体的制备及ELISA检测方法的建立[J].中国新药杂志,2012,21(4):436-442.
[4]缪芬芳,白海燕,白 昀,等.猪肺炎支原体DnaK蛋白质单抗的制备与鉴定[J].江苏农业学报,2012,28(6):1361-1366.
[5]江 淼,沈 飞,包红雨,等.大鼠抗小鼠重组膜联蛋白A2单克隆抗体的制备与鉴定[J].苏州大学学报,2011,31(6):879-892.
[6]王 铮,王铁成,冯 娜,等.犬瘟热单克隆抗体的制备及其生物学特性鉴定[J].动物医学进展,2014,35(3):73-77.
[7]Rolf Ko hler,Jorg Fangha nel,Bettina Ko nig.Biochemical and functional analyses of the mip protein:influence of the N-terminal half and of peptidylprolyl isomerase activity on the virulence of Legionella pneumophila[J].Infection and Immunity,2003,71(8):4389-4397.
[8]Konyecsni W M,Deretic V Konyecsni W M,et al.DNA sequence and expression analysis of aIgP and aIgQ,components of the multigene system transcriptionally regulating mucoidy in Pseudomonas aeruginosa:aIgP contains multiple direct repeats[J].J Bacteriol,1990,172(5):2511 -2520.
[9]Nicholas P Cianciotto,William O Connell,Gregory A Dasch,et al.Detection of mip-like sequences and mip-related proteins within the family Rickettsiaceae[J].Current Microbiology,1995,30(3):149-153.
[10]Horne S M,Young K D.Escherichia coli and other species of the Enterobacteriaceae encode a protein similar to the family of Mip - like FK506 - binding proteins[J].Arch Microbiol,1995,163(5):357-365.
[11]Lain R Peters,Michael J Day,Severine Tasker,et al.Antigen specificity of the humoral immune response to Mycoplasma haemofelis infection[J].Clinical and Vaccine Immunology,2010,17(8):1238-1243.
[12]Sylvette Bas,Laurence Neff,Cem Gabay,et al.The proinflammatory cytokine response to Chlamydia trachomatis elementary bodies in human macrophages is partly mediated by a lipoprotein,he macrophage infectivity potentiator,through TLR2/TLR1/TLR6 and CD14[J].J Immunol,2008,180(2):1158 -1168.
[13]Laurence Neff,Sawsan Daher,Sylvette Bas,et al.Molecular characterization and subcellular localization ofmacrophage infectivity potentiator,a Chlamydia trachomatis lipoprotein[J].Journal of Bacteriolgy,2007,189(13):4739-4748.
[14]Marques P X,Puneet Souda,Nally J E,et al.Identification of immunologically relevant proteins of Chlamydophila abortus using sera from experimentally infected preguant ewes[J].Clin Vaccine Immunol,2010,17(9):1491.
