STS处理对富贵竹切叶保鲜效果的影响
2015-05-28王俊宁刘振强刘付东标李润唐
王俊宁,刘振强,刘付东标,李润唐
(广东海洋大学 农学院,广东 湛江 524088)
正常情况下,活性氧在植物体内处于一种动态的平衡状态,作为第二信使调节植物的新陈代谢,然而,当受到外界环境或自身代谢氧化胁迫后,这种平衡将被打破,过量的活性氧对植株造成不同程度的伤害,甚至引起植株的死亡[1-3]。有氧生物在长期的进化中衍生出了一套非酶/酶防御 ROS系统,这个系统涉及到一些低分子质量还原性底物如抗坏血酸 (ASA)、谷胱苷肽(GSH)、生育酚(又称维生素E)、类黄酮、生物碱和类胡萝卜素以及几个重要的酶类如超氧化物歧化酶(SOD)、抗坏血酸氧化酶(APX)、过氧化氢酶(CAT)和谷胱苷肽过氧化物酶 (GPX)等[2],它们共同防御活性氧或其它过氧化物自由基对细胞膜系统的伤害,从而减少自由基对有机体的毒害。
富贵竹(Dracaena sanderiana‘Virens’)为龙舌兰科龙血树属常绿灌木状植物,又名开运竹、万年竹。由于其既具有竹韵、充满生机,又寓有富贵、吉祥的含义,深受人民的喜爱,现已成为国内外室内美化常见的装饰植物。但是,带叶富贵竹在贮运保鲜中叶片容易产生黄化,在出口运输过程中的损失率通常高达30%。目前,有关富贵竹的研究主要集中大田栽培、室内加工及茎段防腐保鲜方面[4-5],对带叶富贵竹的贮藏保鲜及采后活性氧代谢方面的研究鲜有报道。STS(硫代硫酸银)是目前切花保鲜中使用最广泛的乙烯抑制剂,其作用效果明显,对植物的伤害性小。它是一种阴离子络合物[Ag(S2O3)],由AgNO3和Na2S2O3按一定的摩尔浓度比配制而成,含有活性银,在切花体内移动性好,其输送功能比Ag+高70倍,能顺利达到花冠顶端。STS又是杀菌剂,其生理毒性比AgNO3小,且用量少[6]。目前有关STS在带叶富贵竹保鲜上的研究还未见报道。为了解决富贵竹贮运过程中叶片易黄化的问题,本试验以普通富贵竹为材料,研究了不同浓度STS处理对富贵竹叶片活性氧代谢、叶绿素含量和含水量的影响,旨在为带叶富贵竹的贮藏保鲜提供参考。
1 材料与方法
1.1 试验材料
普通富贵竹(Dracaena sanderiana‘Virens’)采自广东海洋大学园林系实习基地。采收时挑选健康、翠绿、无病虫害、株高约80 cm的一年生富贵竹植株作为试材。Na2S2O3为河南焦作化工三厂生产,AgNO3为北京化工厂生产,均为分析纯。STS溶液由AgNO3和Na2S2O3按摩尔浓度1∶4比例配制而成。
1.2 试验方法
1.2.1 取样方法及试验设计 2012年10月15日08:00—10:00,用已消毒的剪刀将富贵竹沿基部切下,先去掉茎干下半部分10~20 cm的枯叶,冲洗干净叶面上的泥土,将富贵竹放入清水,剪平切口,然后在清水中复水12 h,之后再用5,10,15 mmol/L硫代硫酸银溶液(STS)溶液脉冲10 min,以清水为对照(CK),然后取出放在室温条件下贮放。期间分别于第0、1、4、7、10、13、16和19天进行取样,同时测定富贵竹叶片的叶绿素含量、鲜质量、干质量。并保留部分叶片于-20℃冰箱备用。试验设3个重复,每个重复30株富贵竹。
1.2.2 测定方法 叶绿素含量采用丙酮法提取法[7]测定;丙二醛(MDA)含量采用硫代巴比妥酸比色法[8];可溶性总糖含量测定蒽酮比色法[7];过氧化氢含量采用四氯化钛法[9];超氧阴离子自由基含量采用羟胺氧化法[10]。POD参考Polle等[11]方法,以OD470每分钟增加0.01表示一个酶活力单位(U),POD活性以U/g FW表示;CAT测定参考Torres等[12]方法,以OD240每分钟减少0.01表示一个酶活力单位(U),CAT活性以U/g FW表示。SOD采用氮蓝四唑法[7]测定。
叶片的干质量、鲜质量采用称量法测定。

1.3 数据统计与分析
采用DPS数据处理软件进行数据整理与分析;用Fisher氏保护最小显著差数法(PLSD法)进行多重差异比较,显著性水平:显著(P<0.05),极显著(P<0.01)。
2 结果与分析
2.1 STS处理对富贵竹叶片叶绿素含量和黄化率的影响
贮藏中富贵竹叶片中的叶绿素含量变化如图1。在采后第1天,各处理叶绿素含量基本没变化,均维持在(2.55±0.08)~(2.66±0.05)mg/g,之后缓慢下降,于第7 天下降至(2.21±0.12)mg/g,随后3 d快速下降至第10天的(0.78±0.19)mg/g,之后变化不大。STS处理延缓了富贵竹叶片叶绿素含量的下降,各处理叶片的叶绿素含量在采后前10 d下降缓慢,之后开始快速下降。各处理的叶绿素含量从第10天起极显著高于同期的对照,其中10 mmol/L STS处理的效果最好,在采后第13~16天显著高于其他2个浓度。
由图2可知,各处理富贵竹叶片在采后第1天均没黄化,从第4天起CK组的叶片开始迅速黄化,于第13天达到(15.92±0.33)%,而STS处理降低了富贵竹叶片的黄化速率。据观察,CK组叶片在采后第9天出现黄化高峰,而不同浓度STS处理在采后第11天叶片大量黄化。可见,STS处理可延缓富贵竹叶片的黄化,其中10 mmol/L STS处理效果最好,达到极显著水平。

图1 STS处理对富贵竹叶片叶绿素含量的影响Fig.1 Effects of STS treatment on leaf chlorophyll content of Dracaena sanderiana‘Virens’

图2 STS处理对富贵竹叶片黄化率的影响Fig.2 Effects of STS treatment on leaf etiolation rate of Dracaena sanderiana‘Virens’
2.2 STS处理对富贵竹叶片含水量的影响
如图3所示,富贵竹采收时叶片的含水量为(71.02±0.03)%,复水后叶片含水量有所增加,为(72.91±0.34)%,之后 6 d 叶片的含水量变化不明显(第7 天为(72.41±1.72)%),但从第7 天起,富贵竹叶片的含水量快速下降,直至结束。STS处理延缓了富贵竹叶片含水量的下降,其中5 mmol/L和15 mmol/L STS处理在采后前13 d变化缓慢,而10 mmol/L STS处理的含水量基本没变化,到贮藏结束第19天时仍有(72.01±2.07)%的含水量。各处理与对照叶片的含水量在采后第10天达到显著水平,之后差异极显著,而不同浓度间差异不明显。可见,STS处理能有效维持叶片的含水量,其中10 mmol/L STS处理效果最佳。
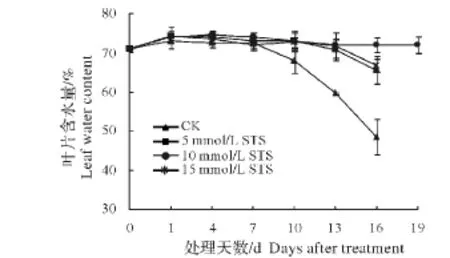
图3 STS处理对富贵竹叶片含水量的影响Fig.3 Effects of STS treatment on leafwater content of Dracaena sanderiana‘Virens’

图4 STS处理对富贵竹叶片SOD酶活的影响Fig.4 Effects of STS treatment on SOD activities of Dracaena sanderiana‘Virens’
2.3 STS处理对富贵竹叶片SOD活性的影响
采收时富贵竹叶片的SOD活性为(1 220.41±76.94)U/(g·h),经12 h复水之后,SOD活性急剧上升,并于采后第1天达到最大(1 803.24±69.95)U/(g·h),之后3 d SOD维持较高的活性,第4天过后SOD活性快速下降,于第7天降至(1 319.76±92.11)U/(g·h),之后又开始缓慢下降(图4)。不同浓度的STS处理对SOD活性影响不同,低浓度的STS处理(5 mmol/L、10 mmol/L)在采后前7 d极显著地提高了富贵竹叶片SOD活性,而高浓度的STS处理(15 mmol/L)对其活性基本没影响。
2.4 STS处理对富贵竹叶片CAT活性的影响
采后富贵竹叶片中CAT活性变化与SOD相似,即采收时较低(为(365.35±53.54)U/g),随后迅速增加,也于第1天达到最大(785.48±60.50)U/g,之后开始下降(图5)。10 mmol/L和15 mmol/LSTS处理对富贵竹叶片中的CAT活性影响不大,而5mmol/L STS处理反而降低了贮藏过程中富贵竹叶片中的CAT活性,在采后第1~7天该处理的CAT活性极显著低于对照和其他两个浓度处理。说明,低浓度的STS处理会降低贮藏过程中富贵竹叶片中的CAT活性。

图5 STS处理对富贵竹叶片CAT酶活的影响Fig.5 Effects of STS treatment on CAT activities of Dracaena sanderiana‘Virens’

图6 STS处理对富贵竹叶片POD酶活的影响Fig.6 Effects of STS treatment on POD activities of Dracaena sanderiana‘Virens’
2.5 STS处理对富贵竹叶片POD活性的影响
在采后前10 d,富贵竹叶片中的POD活性上升缓慢,10 d过后POD活性急剧上升(图6)。在整个贮藏过程当中,STS处理极显著地抑制富贵竹叶片中POD活性的增加,其中5 mmol/L和15 mmol/L STS处理的POD活性在整个期间呈极缓慢的速度增加,而10 mmol/L STS处理在采后前4 d反而降低了富贵竹叶片中的 POD 活性(为(605.00±10.41)~(607.50±13.10)U/g,低于采收时的(738.78±13.88)U/g),之后增加缓慢。不同浓度间差异显著,其中10 mmol/L STS处理的抑制效果最好。
2.6 STS处理对富贵竹叶片O2-·的影响
如图7所示,采后富贵竹叶片中片O2-·的积累在采后前10 d缓慢增加,10 d过后O2-·快速积累。5 mmol/L和15mmol/LSTS处理富贵竹叶片中的O2-·含量在整个贮藏过程增加缓慢,在前10 d与对照无差异,之后显著低于对照。而10 mmol/L STS处理O2-·含量在整个贮藏过程均要低于对照,且在第13~16天达到极显著水平。在这3个浓度当中,10 mmol/L STS处理对延缓O2-·的上升的效果最为显著。
2.7 STS处理对富贵竹叶片H2 O2含量的影响
采收时,富贵竹叶片的H2O2含量为(24.35±1.09)μg/g。在随后的贮藏过程中,前10 d的H2O2含量增加缓慢,之后迅速增加,于第13天出现高峰,之后开始下降。STS处理极显著地抑制了采后H2O2含量的增加,在采后前10 d,各浓度STS处理之间的H2O2含量变化不大,且彼此之间差异不显著,之后各处理开始上升,其中10 mmol/L和15 mmol/L STS处理比较接近,均高于5 mmol/L STS处理(图8)。

图7 STS处理对富贵竹叶片O2-·含量的影响Fig.7 Effects of STS treatment on O2-·content of Dracaena sanderiana‘Virens’
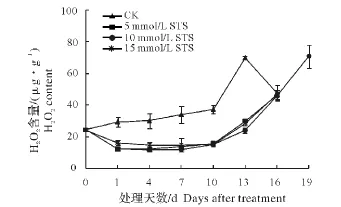
图8 STS处理对富贵竹叶片H2 O2含量的影响Fig.8 Effects of STS treatment on H2 O2 content of Dracaena sanderiana‘Virens’
2.8 STS处理对富贵竹叶片MDA含量的影响
随着贮藏期的延长,富贵竹叶片中的MDA含量不断缓慢上升,自采后第10天起,MDA含量增加迅速。在采后前10 d,STS处理对MDA含量基本无影响,但自第10天之后,STS处理极显著地抑制了采后叶片MDA含量的增加,其中10 mmol/L和15 mmol/LSTS处理的抑制效果接近,而5 mmol/LSTS处理只能略减缓MDA含量增加的速度(图9)。
2.9 STS处理对富贵竹叶片可溶性总糖含量的影响
在采后前10 d,富贵竹叶片的可溶性总糖急剧下降,从采后时的(79.28±2.25)mg/g下降至第10天的(46.07±3.46)mg/g,之后下降缓慢(图10)。STS处理可显著抑制了富贵竹叶片中可溶性总糖含量的下降,5 mmol/L STS处理在采后前7 d、10 mmol/L STS处理和15 mmol/L STS处理在采后前10 d,其可溶性总糖含量均极显著高于对照,且不同浓度之间差异不大,之后三者的可溶性总糖迅速下降,与对照差异不显著。其中,10 mmol/L STS处理对延缓可溶性总糖降解的效果最为显著。

图9 STS处理对富贵竹叶片MDA含量的影响Fig.9 Effects of STS treatment on MDA content of Dracaena sanderiana‘Virens’
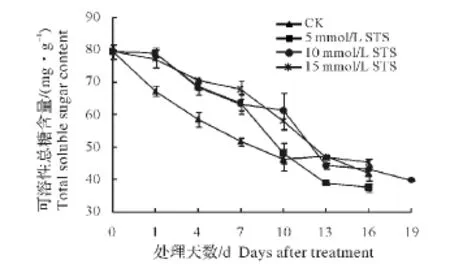
图10 STS处理对富贵竹叶片可溶性总糖含量的影响Fig.10 Effects of STS treatment on total soluble sugar content of Dracaena sanderiana‘Virens’
3 讨论
SOD、CAT是细胞内的重要保护酶,对ROS的清除和维持细胞内氧自由基的平衡起重要作用。SOD能将体内产生的O2-·转化为H2O2和O2,而产生的H2O2则进一步被CAT分解成水,起到清除体内多余O2-·和H2O2的目的[2-3]。本研究发现,富贵竹叶片中的SOD和CAT活性均在采后第1天出现活性高峰,随后维持较高的活性(图4、5),而此时富贵竹叶片中的O2-·和 H2O2含量相对较低(图7、8),说明SOD、CAT酶对带叶富贵竹采后贮藏早期中的氧自由基清除起主要作用。
POD具有双重性。一方面,POD在逆境或衰老初表达,清除H2O2,表现为保护效应,为细胞活性氧保护酶系统的成员之一;另一方面,它在逆境或衰老后期表达,参与活性氧的产生和叶绿素的降解,并能引发膜脂过氧化,表现为伤害效应,是植物体衰老到一定阶段的产物,甚至可作为衰老指标。一般认为其主要作用在于后者[13]。本研究发现,带叶富贵竹在采后前10 d,叶片中的POD活性和H2O2含量增加缓慢,10 d过后POD活性和H2O2含量急剧上升(图6、8)。相关性分析表明,二者存在显著的正相关(r=0.843 4**),说明POD参与了富贵竹贮藏后期H2O2的大量产生。同时研究发现,采后富贵竹叶片中的叶绿素含量不断下降,尤其是在采后第7~10天直线下降(图1)。相关性分析表明,富贵竹叶片中的叶绿素含量和POD活性存在显著的负相关(r=-0.822 2**),说明POD酶参与了富贵竹采后贮藏期间叶片中叶绿素的降解。由此可见,POD酶对富贵竹采后的衰老起着极其重要的促进作用。
STS作为一种有效的乙烯拮抗剂,能有效地抑制乙烯的产生和降低乙烯在植物体的活性,对香石竹[6,14]、兰花[15]、牡丹[16]、矮牵牛花[17]、金鱼草[18]等乙烯敏感型切花和天门冬切叶[5]、银杏叶片[19]等保鲜效果显著。本研究发现,10 mmol/L STS处理显著地延缓了采后富贵竹叶片叶绿素的降解,极显著地降低了富贵竹叶片的黄化率和推迟了叶片黄化的时间。对照组的叶绿素从采后第1天之后开始降解,第7~10天急速下降,其叶片从第4天开始出现黄化,到第9天大部分叶片已黄化;而10 mmol/L STS处理的叶绿素含量则是从采后第4天之后才开始缓慢下降,到第10天只下降了0.04 mg/g,黄叶出现的时间从第7天开始,于第11天达到高峰(图1、2),从第4天起10 mmol/L STS处理叶片的黄化率极显著低于对照组。此外还发现,10 mmol/L STS处理能有效地抑制富贵竹叶片含水量的下降,对照组从采后第7天起其叶片含水量持续快速下降,而10 mmol/L STS处理在整个贮藏期间基本没变化(图3)。这与STS处理可减缓银杏叶片叶绿素含量的下降[19]及低浓度STS(5~10 mg/L)处理可显著延长天门冬切叶的瓶插寿命并保持较高幅度的鲜重变化率[5]的研究结果一致。
富贵竹采后使用10 mmol/L STS处理,极显著地提高了采后前7d叶片中的SOD,但降低了CAT活性,且在采后前7 d达到极显著水平。这与袁华玲等[20]的研究结果一致,他们发现,在马铃薯试管苗的培养基中添加STS,提高了试管苗的SOD活性但降低了CAT活性。此外,10 mmol/L STS处理极显著地抑制了POD活性和H2O2含量的增加,减少了贮藏过程中O2-·和MDA含量的积累。这与苏冬梅等[19]的研究结果STS处理可抑制银杏叶片POD活性和质膜渗透的增加相符。
切花体内含糖量的高低与切花品质密切相关,贮后的观赏品质也与其含糖量呈正相关。本研究发现,10 mmol/L STS处理极显著地抑制了富贵竹采后前10 d叶片中可溶性总糖含量的下降,这与张宇和江春[18]在金鱼草上的研究结果一致。
[1]林植芳,刘楠.活性氧调控植物生长发育的研究进展[J].植物学报,2012,47(1):74-86.
[2]张怡,路铁刚.植物中的活性氧研究概述[J].生物技术进展,2011,1(4):242-248.
[3]赵天宏,孙加伟,付宇.逆境胁迫下植物活性氧代谢及外源调控机理的研究进展[J].作物杂志,2008,124(3):10-13.
[4]余前媛,甘勇,任永波.富贵竹茎段保鲜研究[J].安徽农业科学,2008,36(18):7568-7569.
[5]盛爱武,乔爱民,高飞,等.富贵竹切口保鲜及贮运研究[J].园艺园林科学,2005,9(9):329-331.
[6]郭嘉.不同STS浓度对香石竹切花保鲜效果的影响[J].内江科技,2010,31(11):48.
[7]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:74-77.
[8]赵生杰,许长成,邹琦,等.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994,30(3):207-210.
[9]张蜀秋.植物生理学实验技术教程[M].北京:科学出版社,2011:197-198.
[10]中国科学院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南[M].北京:科学出版社,1999:308-309.
[11]Polle A,Tilman T,Seifert F.Apoplastic peroxidases and lignification in needles of Norway Spruce(Picea abies L.)[J].Plant Physiol,1994,106(1):53-60.
[12]Torres R,Valentines M C,Usall J,et al.Possible involvement of hydrogen peroxide in the development of resistancemechanisms in Golden Delicious apple fruit[J].Postharvest Biol Technol,2003,27(3):235-242.
[13]Zhang JX,Kirkham M B.Drough-stress-induced changes in activities of superoxide dismutase,catalase,and peroxidase in wheat species[J].Plant Cell Physiology,1994,35(5):785-791.
[14]王少平,宋荷英,刘樾.STS处理切花香石竹的保鲜效果研究[J].安徽农业科学,2007,35(33):10677.
[15]高俊平.观赏植物采后生理与技术[M].北京:中国农业大学出版社,2002:209-212.
[16]刘丽亚,刘蕾,王荣峰,等.STS、PP333对牡丹切花保鲜及某些生理特性的影响[J].吉林农业大学学报,2005,27(3):276-279.
[17]徐明全.正硫代硫酸银和氨基乙氧乙烯甘氨酸对延长矮牵牛花期的效应[J].江苏农业科学,1994(3):55-56.
[18]张宇,江春.不同浓度STS预处理对切花金鱼草保鲜效果的影响[J].晋中学院学报,2011,28(3):56-59.
[19]苏冬梅,杨定海,冯兆云,等.银杏叶片衰老与调节的生理生化变化[J].经济林研究,2001,19(1):4-6.
[20]袁华玲,金黎平,黄三文,等.不同通气条件下硫代硫酸银对马铃薯试管苗生长和抗氧化酶活性的影响[J].植物生理学通讯,2007,6(12):1082-1084.
