三球悬铃木果球离体培养与再生体系的建立*
2015-05-26崔明珠张娜娜田保明李云玲刘世超曹刚强位芳
崔明珠,张娜娜,田保明,李云玲,刘世超,曹刚强,位芳
(郑州大学生命科学学院,河南 郑州 450001)
悬铃木 (Platanus orientalis)为悬铃木科 (Platanaceae)悬铃木属 (Platanus)落叶大乔木,原产于东南欧、印度及美洲,属下约7种。中国引入栽培3种,分别为一球悬铃木 (P.occidentalis Linn.)、二球悬铃木 (P.acerifolia Willd.)、三球悬铃木。三球悬铃木又名法国梧桐,树姿优美,冠大荫浓,遮荫效果良好,是著名的行道树;可吸尘、抗菌、净化空气,是良好的园林绿化树种,且其木材也可用作建筑和家具用材[1]。
目前,国内外已对多种园林绿化木本植物的离体植株再生和育种进行过研究,有关悬铃木再生体系的研究也有多篇报道,邹永梅等[2~3]、蔡晓明等[4]、Tao等[5]、Sun 等[6]分别以当年生枝条、2-3年生枝条和叶片为外植体建立了北美一球悬铃木植株再生体系,查向浩等[7]、王磊等[8]、李思等[9]、Li等[10]、刘国锋等[11~13]分别以二球悬铃木的单芽茎段、叶片及下胚轴为起始外植体进行不定芽的诱导,建立了植株再生体系。其中,供试材料基因型及外植体来源较为复杂,且鲜有三球悬铃木再生体系[14~15]的报道。鉴于此,本实验以三球悬铃木成熟果球为材料,探讨了不同消毒方式、无机盐浓度对其种子萌发的影响,以及叶龄、光照对叶片愈伤组织诱导和植物生长调节剂浓度对不定芽分化的影响,初步建立三球悬铃木果球离体培养技术及高效的叶片再生体系,以期为促进三球悬铃木离体植株再生和苗木的推广提供参考。
1 材料与方法
1.1 实验材料
郑州大学校园内生长健壮的6年生三球悬铃木的成熟果球。
1.2 实验方法
1.2.1 种子消毒
剥离果球中的种子,先用自来水冲洗1 h,再用含洗涤剂的溶液揉洗10 min,然后用自来水冲洗干净。用无菌滤纸吸干种子表面水分后,先用75%乙醇浸泡30 s,然后用含少量Tween-20的10%H2O2进行不同时间 (5 min、10 min、15 min、20 min)的消毒处理,然后将种子分别播种于EX培养基(与李思等[9]的种子无菌萌发培养基成分相同)和MS[16]培养基中,光照培养 (光照强度1 500 Lx、光周期16时/天、温度25℃)45天后,观察无菌苗的生长状况,统计种子的萌发率和污染率,分析消毒时间、无机盐浓度对无菌苗种子萌发的影响。萌发率=(萌发种子数/种子总数)×100%,污染率=(污染种子数/种子总数)×100%。每次处理统计30粒种子,重复3次。
1.2.2 愈伤组织诱导
将不同叶龄 (20天、30天、40天、50天、60天)的三球悬铃木无菌苗叶片,用解剖刀去掉叶尖及叶柄,在远轴面轻轻地划3刀,远轴面向下,分别接种于愈伤诱导培养基 (MS+IBA 0.1 mg/L+KT 1.0 mg/L+6-BA 1.5 mg/L)上,先在25℃黑暗条件下培养7天,再转入光照培养 (光照强度1 500 Lx、光周期 16时/天、温度 25℃)。其中,叶龄40天的叶片,光照条件设2个处理:A为直接光照培养;B为黑暗培养7天后,转入光照培养。每2周继代1次。30天后,统计叶片的愈伤组织诱导率,分析叶龄和光照条件对叶片愈伤组织诱导率的影响。愈伤组织诱导率=(出愈外植体数/接种总外植体数)×100%。每次处理统计25个外植体,重复3次。
1.2.3 不定芽分化
诱愈培养30天后,将40天叶龄的经暗培养处理的叶片愈伤组织分别接种于分化培养基 (MS基本培养基,添加 0.1~1.0 mg/L IBA、0.1~1.0 mg/L KT、0.5~1.5 mg/L 6-BA,蔗糖 30 g/L,琼脂6 g/L,pH值5.8)上,光照培养 (光照强度1 500 Lx、光周期16时/天、温度25℃)。每2周继代1次。30天后,统计叶片愈伤组织的不定芽分化率,分析植物生长调节剂浓度对叶片愈伤组织不定芽分化的影响。不定芽分化率=(出芽愈伤数/接种总愈伤数)×100%。每次处理统计20块愈伤组织,重复3次。
1.2.4 壮苗培养
待不定芽长至3~5 cm,于超净工作台中,用解剖刀将不定芽连带少许愈伤组织单个切下,继代于新鲜的分化培养基上,继续光照培养 (光照强度1 500 Lx、光周期16时/天、温度25℃)。
1.3 数据分析
利用Excel 2007统计分析作图,并采用SPSS 21.0进行方差分析。
2 结果与分析
2.1 三球悬铃木果球离体培养和无菌苗的获得
2.1.1 污染问题
在培养初期,因三球悬铃木种子较小,果毛较多,种皮较厚,利用常规的消毒方法 (0.1%HgCl2消毒10 min和 10%NaClO消毒20-30 min)消毒后,萌发过程中仍污染严重,即使延长消毒时间,污染仍然严重,且由于消毒剂对种子长时间的毒害作用,导致种子萌发率低,无菌苗长势差,生长缓慢,褐化严重,阻止了离体培养无菌苗在短时间内的获得,成为系统构建三球悬铃木再生体系的重大障碍。H2O2毒性较小,且低浓度有打破种子休眠作用。图1表明,使用H2O2作为消毒剂,随着消毒时间的增加,种子污染率下降,萌发率也随之降低,当消毒时间为10 min时,可在不影响萌发率的前提下将污染率降到最低,且无菌苗长势较好,组培苗无褐化现象。
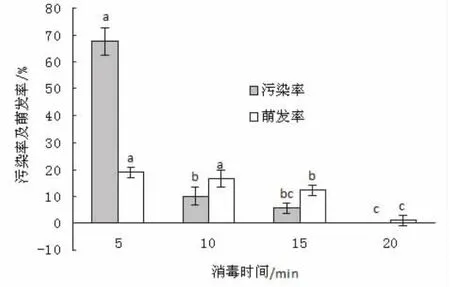
图1 H2O2不同消毒时间对三球悬铃木种子污染率和萌发率的影响注:图中同组数据字母完全不同时,表示在P﹤0.05水平差异显著,下同。Fig.1 Effect of sterilization time on seed contamination rate and germination rate of mature fruit seeds
2.1.2 种子萌发培养基的筛选
N是构成蛋白质的重要元素,K是细胞的生化反应缓液,两者均是植物细胞正常生长的必需元素之一。不同的植物或同一植物的不同外植体的最适用量不同。本实验三球悬铃木的萌发培养基为EX和MS培养基,二者无机盐含量不同 (表1)。

表1 MS和EX培养基中部分大量元素的浓度配比Tab.1 The concentration ratio of a part of macronutrien in the MS and EX medium mmol·L-1

图2 不同培养基的无菌苗萌发注:a为MS培养基上萌发的无菌苗;b为EX培养基上萌发的无菌苗Fig.2 Mature fruit seeds germinated on different media
图2表明,在含低盐成分的EX培养基上萌发的无菌苗叶片翠绿、健壮;而在含高盐成分的MS基本培养基上萌发的无菌苗叶片发黄、瘦弱。故EX培养基可选作三球悬铃木种子萌发的培养基。
2.2 三球悬铃木叶片愈伤组织的诱导
2.2.1 叶龄对叶片愈伤组织诱导率的影响
研究表明[9~12],较幼嫩的外植体容易脱分化形成愈伤组织,再分化形成芽,可获得较高的再生率。不同叶龄三球悬铃木叶片愈伤组织的诱导结果见图3。从图3可知,叶龄为30天以下及50天以上的叶片,其愈伤组织诱导能力明显低于30-50天叶龄的叶片;30-50天叶龄的叶片较易形成愈伤组织,且40天叶龄的叶片愈伤组织诱导率最高,可达89.33%。生长初期的低龄叶片,体积较小,接种后易卷曲,褐变而死亡;而苗龄增大到一定程度,叶片柔嫩度降低,纤维含量增大,组培苗逐渐木质化,愈伤组织诱导率降低,分化能力也随之下降。

图3 叶龄对三球悬铃木叶片愈伤组织诱导率的影响Fig.3 Effect of explant age on leaf callus induction rate
2.2.2 光照条件对叶片愈伤组织诱导率的影响
George等[17]认为黑暗条件下,可减少外植体酚类物质的释放,减轻褐化,从而利于再生。黑暗和光照条件下,三球悬铃木叶片愈伤组织诱导结果见图4。由图4可知,光照条件对三球悬铃木叶片的脱分化很重要,暗培养能显著促进愈伤组织的形成。黑暗培养7天后叶片叶脉处开始明显膨大,能够快速形成青绿色、淡黄色或红褐色的紧实、生长状态良好的愈伤组织 (图5b);直接光照培养的叶片则容易干枯、褐化,较难形成愈伤组织,且形成的愈伤组织脆化,延长培养时间,很容易死亡。经过黑暗培养的叶片愈伤组织诱导率比光照培养的叶片高出约30.67%。

图4 光照条件对叶片愈伤组织诱导率的影响Fig.4 Effect of light on leaf callus induction rate

图5 三球悬铃木离体植株再生注:a为种子萌发培养45天后的无菌苗;b为叶片叶脉处膨大,形成愈伤组织;c为叶片愈伤组织分化出丛生芽;d为不定芽壮苗培养后,形成单棵植株Fig.5 In vitro plantlet culture and shoot regeneration
2.3 三球悬铃木叶片愈伤组织不定芽的分化
植物生长调节剂配比对叶片愈伤组织的不定芽分化影响大。由表2可知,各组合均能使叶片愈伤组织分化出不定芽。不同浓度的IBA对不定芽的分化存在差异。IBA浓度为0.1 mg/L时,不定芽分化率高,随着IBA质量浓度的增大,不定芽分化率明显降低。本实验最终以添加IBA 0.1 mg/L、KT 1.0 mg/L和6-BA 1.5 mg/L的培养基作为三球悬铃木组培苗的分化培养基,其不定芽分化率为66.67%。愈伤组织在转到分化培养基上后,便开始分化出不定芽,随着培养时间的延长,不定芽数量增多,单生芽增殖为丛生芽 (图5c)。

表2 不同植物生长调节剂浓度对叶片愈伤组织不定芽分化率的影响Tab.2 Effect of different hormone combinations on adventitious bud induction
3 结论与讨论
选择合适的外植体是建立再生体系的重要前提。植物不同时期、不同部位、不同来源的材料都可以作为再生体系建立的外植体。悬铃木的再生多以当年生枝条[2,7~8]、2-3 年生枝条[6]、叶片[14~15,18]和下胚轴[12]为外植体,但当年生或2-3年生枝条的取材易受季节限制,而下胚轴又不易大量获得。三球悬铃木果球成熟后,可长期保存,本实验采用无菌苗叶片作为再生外植体,将成熟果球上剥离的种子用75%乙醇浸泡30 s,含少量Tween-20的10%H2O2消毒10 min后,播种于低盐成分的EX培养基上,可明显提高其种子的萌发率,为组织再生提供大量的外植体。用10%H2O2消毒处理时,时间过短,种子污染率大,时间过长,种子的萌发率急剧下降,因此选择合适的消毒时间 (10 min),才能在保证萌发率的前提下降低污染,该结果与周晓玲等[18]的研究相似。周晓玲等[18]还发现,降低MS用量对二球悬铃木幼苗玻璃化有很好的防止作用,且幼苗粗壮,枝条高。本研究分别以低盐培养基EX和高盐培养基MS进行三球悬铃木无菌幼苗的萌发实验,也得到了相同的结果,降低无机盐含量,三球悬铃木无菌苗生长状况更佳,叶片翠绿、健壮。
不同叶龄的叶片,木质化程度不同,通常,较幼嫩的外植体容易脱分化,也容易再分化形成不定芽,可以得到比较高的出芽率。在本研究中,叶龄为20天和60天的叶片,愈伤组织诱导率明显低于30-50天叶龄的外植体,且以40天最高,这与王磊等[8]的研究结果叶龄35-60天的二球悬铃木试管苗叶片适于再生,40天分化率最高相同。光照条件对叶片的脱分化有重要影响,叶片先经过7天的黑暗培养,再转入光照培养,愈伤组织诱导率比直接光照培养的高约30.67%,且愈伤组织致密、生长状态良好,不易褐化死亡。这与刘国锋等[12]的研究结果强光会抑制愈伤组织的形成和生长,进而不利于芽的分化是一致的。此外,王磊等[8]也报道经历黑暗培养,可以促进不定芽的分化。
植物生长调节剂是影响悬铃木再生效果的关键因素之一。周晓玲等[18]研究发现生长素类似物NAA、IAA对二球悬铃木子叶愈伤组织的分化有促进作用。本研究对三球悬铃木叶片愈伤组织的不定芽诱导选取KT、IBA、6-BA等3种植物生长调节剂的不同组合进行实验得出最佳配比,也发现生长素类似物IBA的浓度对三球悬铃木愈伤组织的不定芽诱导有显著影响,但随着IBA浓度的增高,愈伤组织芽诱导率下降,该结果与查向浩等[7]、Liu 等[11]、范国强等[15]的研究结果一致。
[1]郭翠萍.园林绿化树种悬铃木[J].山西林业科技,2004(3):35-36.
[2]邹永梅,施季森.北美悬铃木的组织培养[J].南京林业大学学报(自然科学版),2006,30(6):61-65.
[3]邹永梅,施季森.北美一球悬铃木高效遗传转化体系的建立[J].南京林业大学学报(自然科学版),2005,29(4):15-19.
[4]蔡晓明,杨立伟,施季森,等.北美悬铃木无性系间组培特性差异研究[J].江苏农业科学,2008(4):89-93.
[5]Tao F J,Zhang Z Y,Zhou J,et al.Contamination and browning in tissue culture of Platanus occidentails L.[J].Forest Science and Practice,2007,9(4):279-282.
[6]Sun Y H,Zhao Y L,Wang X J,et al.Adventitious bud regeneration from leaf explants of Platanus occidentalis L.and genetic stability assessment[J].Acta Physiologiae Plantarum,2009,31(1):33-41.
[7]查向浩,易海艳.二球悬铃木的组织培养和体外植株再生研究[J].安徽农学通报,2010,16(13):72-73.
[8]王磊,李红双,蔺娜,等.悬铃木叶片再生体系的建立[J].林业科学,2004,40(1):58-63.
[9]李思,金亮,陈永勤,等.二球悬铃木叶片离体植株再生[J].湖北大学学报(自然科学版),2010,32(2):220-224.
[10]Li Z N,Fang F,Liu G F,et al.Stable Agrobacterium mediated genetic transformation of London plane tree(Platanus acerifolia Willd.)[J].Plant Cell Reports,2007,26(5):641-650.
[11]Liu G F,Bao M Z.Adventitious shoot regeneration from in vitro cultured leaves of London plant tree(Platanus acerifolia Willd.)[J].Plant Cell Reports,2003,21(7):640-644.
[12]刘国锋,包满珠.悬铃木下胚轴及叶片再生不定芽的影响因素分析[J].园艺学报,2009,36(3):399-404.
[13]Liu G F,Guang J,Chen L Q,et al.Plant regeneration from excised hypocotyl explants of Platanus acerifolia willd[J].In Vitro Cellular and Developmental Biology-Plant,2002,38(6):558-563.
[14]何晓兰,刘桂华,佘建明,等.悬铃木叶片不定芽再生[J].江苏农业学报,2006,22(3):225-228.
[15]范国强,蒋建平,贺窑青,等.悬铃木叶片植株再生系统的建立[J].园艺学报,2003,30(2):236-238.
[16]Murashige T,Skoog F.A revised medium for rapid growth and bioassays with tobacco tissue cultures[J].Plant Physiology,1962,15:608-612.
[17]George E F,Hall M A,Klerk G D.Plant propagation by tissue culture PartⅠ:The technology[M].Basingstoke,UK:Exegetics Ltd.,1993.
[18]周晓玲,陈冬玲,宋兆建,等.英国梧桐离体无性繁殖体系的建立[J].武汉植物学研究,2008,26(6):627-633.
