柯萨奇病毒A16在恒河猴外周血单个核细胞中的增殖研究
2015-05-25乞素冬王晶晶张小龙沈霏李琦涵李艳艳刘龙丁和占龙
乞素冬,王晶晶,张小龙,沈霏,李琦涵,李艳艳,刘龙丁,和占龙
中国医学科学院/北京协和医学院医学生物学研究所,云南省重大传染病疫苗研发重点实验室,昆明 650118
·论著·
柯萨奇病毒A16在恒河猴外周血单个核细胞中的增殖研究
乞素冬*,王晶晶*,张小龙,沈霏,李琦涵,李艳艳,刘龙丁,和占龙
中国医学科学院/北京协和医学院医学生物学研究所,云南省重大传染病疫苗研发重点实验室,昆明 650118
柯萨奇病毒A16(CA16)感染灵长类动物模型显示该病毒在猴体内可形成明显的病毒血症期,在此基础上,本研究进一步分析病毒血症形成与CA16在外周血单个核细胞(PBMC)不同组分中增殖的关系。首先用CA16感染恒河猴,检测病毒在PBMC组分CD4+、CD8+、CD20+、CD11c+、CD16+和CD14+细胞中的增殖情况和感染动力学,发现病毒仅在部分CD14+细胞中有增殖表现。然后通过刺激CD14+细胞产生一定量的树突细胞(DC),用CA16感染DC,发现CA16能在DC中形成具有动力学意义的增殖过程,增殖峰值出现在感染后12~36 h。这些结果可能为CA16感染发病机制提供重要信息。
柯萨奇病毒A16;恒河猴;外周血单个核细胞;感染;增殖动力学
以人肠道病毒71型(enterovirus type 71,EV71)和柯萨奇病毒A16(Coxsackievirus A16,CA16)为主要病原的儿童手足口病(hand,foot and mouth disease,HFMD)[1,2],是近年来在亚洲和太平洋地区出现的大规模流行的病毒性传染病[3]。作为一个已受公众关注的传染病,其主要临床病理特征是患儿的手足口部疱疹及相应的类似感冒症状[4],其中1%~2%可发展成以中枢神经系统损伤为特征的重症病例[5],主要为EV71感染[6],而大多数CA16感染病例表现为特征性的疱疹及发热[7],这一临床病理机制尚不清楚。本课题组在探索CA16感染灵长类动物模型时发现,CA16感染引起的特征性病理表现过程与EV71感染过程类似[8],即经历一个明显的病毒血症期。基于这一结果,本课题组初步分析了CA16感染恒河猴外周血单个核细胞(peripheral blood mononuclear cell,PBMC)及血液中不同成分的基本特征,为进一步探讨CA16感染的病理机制提供参考。
1 材料与方法
1.1 材料
1.1.1 细胞与病毒实验所用Vero细胞由中国医学科学院医学生物学研究所病毒免疫室保存;CA16分离自2010年广西壮族自治区HFMD患者咽拭子,经Vero细胞传代培养。
1.1.2 主要试剂和仪器试剂有Ficoll-Paque PREMIUM(GE Healthcare,Piscataway,NJ,USA);CD4+、CD8+、CD16+、CD20+和CD14+抗体(Miltenyi Biotec,Bergisch Gladbach,Germany);RPMI 1640培养基、胎牛血清(Hyclone,Logan,UT,USA);粒细胞-巨噬细胞集落刺激因子(granulocytemacrophage colony stimulating factor,GM-CSF)、白细胞介素4(interleukin 4,IL-4)、肿瘤坏死因子α(tumor necrosis factorα,TNF-α)(Peprotech,NJ,USA);CD83、CD86、CD40、人白细胞抗原DR(human leukocyte antigen-DR,HLA-DR)(BD Biosciences,San Diego,CA,USA);QIAmp Viral RNA mini Kit(Qiagen,Germany);One Step PrimeScript RT-PCR Kit(TaKaRa,Japan)。0.22 μm滤器购自Millipore(Bedford,MA)。仪器有FACSArill、CantoⅡ(BD,San Jose,CA,USA)及7500 PCR仪(ABI,USA)。
1.2 方法
1.2.1 病毒分离与培养将所采集的HFMD患儿咽拭子经无菌磷酸盐缓冲液(phosphate buffered saline,PBS)稀释,用0.22μm滤器过滤除菌后接种于含MEM培养基的Vero细胞中,于37℃、5% CO2培养箱中培养,待细胞出现细胞病变效应(cytopathic effect,CPE)后收获样品。将Vero细胞培养至单层后,将感染复数(multiplicity of infection,MOI)为0.1的病毒接种至细胞,待显微镜下出现CPE后收获病毒液,于-80℃冻存备用。
1.2.2 病毒感染性滴度检测将所培养的病毒液按10倍梯度稀释,于96孔平底细胞培养板中培养,每孔10μl,每个稀释度接种8孔。每孔加入Vero细胞悬液100μl(密度为2×105个细胞/孔),于37℃培养至第7天时观察病变情况,将细胞病变>50%判为阳性,以Karber公式计算感染性滴度。
1.2.3 实验用恒河猴及病毒感染方法经过中国医学科学院医学生物学研究所动物伦理委员会批准(批准号:SCXK[滇]2011-0005),在实验开始前2周选取2~3岁、体重2.0~2.5 kg的健康恒河猴6只,隔离饲养,采集血样检测CA16抗体,确保所有实验猴CA16抗体均为阴性。其中4只经鼻腔喷雾途径感染CA16,感染剂量为4.5 lgCCID50/ml(每只鼻腔喷雾1 ml);另外2只设为对照,每只PBS鼻腔喷雾1 ml。于感染后的第1、3、5、7、9、14天共收集4 ml乙二胺四乙酸(ethylenediaminetetraacetate,EDTA)抗凝全血,其中200μl用于PBMC分离和病毒核酸提取,剩余血样用于后续实验。
1.2.4 PBMC的分离与淋巴细胞分选将剩余EDTA抗凝全血约3.8 ml,经Ficoll-Paque PREMIUM密度离心分离出PBMC,台酚蓝染色、计数。将计数后的细胞用磁珠分离技术分选出CD4+、CD8+、CD16+、CD20+和CD14+细胞,并结合BD流式细胞仪分选HLA-DR+细胞。将细胞密度调整至1× 105个/孔,培养于含10%胎牛血清的RPMI 1640培养基。同时以阴性猴PBMC为对照。自培养开始每隔24 h收集细胞,并收集密度离心后的血浆、红细胞和单核细胞,于-80℃冻存备用。
1.2.5 病毒接种与培养将部分筛选后含不同表面分子的细胞按1×105个/孔培养于含1%胎牛血清的RPMI 1640培养基,接种0.1 MOI CA16,连续培养72 h,每隔12 h收集样品,以Vero细胞为对照。
1.2.6 树突细胞的培养将经磁珠分选的CD14+细胞按1×105个/孔培养于含1%胎牛血清的RPMI 1640培养基,加入20 ng/ml GM-CSF和10ng/ml IL-4培养4 d,加入10 ng/ml TNF-α继续培养2 d,收集细胞;通过标记CD83、CD86、CD40和HLA-DR抗体,用流式细胞术检测树突细胞(dendritic cell,DC)诱导情况。同时以未经CD14分选的PBMC及阴性猴PBMC为对照。自培养起每隔24 h收集细胞,用于进一步监测病毒在体内的增殖情况。
1.2.7 病毒载量检测将收集的样品包括200μl EDTA抗凝血及经Ficoll-Paque PREMIUM密度离心后的血浆、红细胞、单核细胞和上述相关细胞培养上清液,按Qiagen试剂盒说明书提取核酸,定量反转录-聚合酶链反应(quantitative reverse transcriptase-polymerase chain reaction,qRT-PCR)按TaKaRa试剂盒说明书进行。根据GenBank中注册的CA16 VP1序列保守区(注册号:JN590244)设计特异性引物和探针,引物序列为F1:5′-CAACCCATCTGTGTTTGTGAAAA-3′;R1:5′-GGTATGCACTAGCTGGTGACATG-3′;P1:5′-(FAM)CCGCCAGCTCAAGTGCAGTCCC(TAM)-3′。同时将密度分别为105、104、103、102、101、100、10-1拷贝/μl的CA16 RNA标准品加入同一反应板中进行PCR。
1.3 统计分析
所有数据以mean±SD表示。数据统计采用GraphPad Prism软件。
2 结果
2.1 CA16在PBMC中增殖导致病毒血症
对CA16感染恒河猴全血进行RT-PCR,结果显示病毒血症的出现主要在感染后第5~7天,病毒出现的高峰是感染后第5天,最高病毒载量可达260拷贝/ml(图1A),与以前对其他肠道病毒如EV71的研究结果类似[8],也与文献报道的脊髓灰质炎病毒感染特性相似[9]。另外,对外周血的不同组分,包括PBMC、血浆、红细胞及血小板进行分离并检测,结果显示病毒主要存在于PBMC中,病毒载量在第5天达400拷贝/105个细胞(图1B),这与全血中病毒出现的时间基本吻合。虽然PBMC中病毒拷贝数略高,但仍在同一数量级上。其他组分经统计比较没有差异(图1B)。这一结果提示,CA16在PBMC中增殖可能是病毒血症的主要原因。

图1 CA16感染恒河猴引起的病毒血症Fig.1 Dynamic distribution of CA16in infected rhesus monkey
2.2 CA16感染淋巴细胞的检测
基于对CA16感染恒河猴后病毒载量的分析,进一步探索CA16在PBMC中的主要增殖细胞。在PBMC相关淋巴细胞的筛选过程中,用猴CD4和CD8抗体经磁珠分选后获得CD4+和CD8+细胞,对这2种细胞进行RT-PCR,结果显示与未感染对照组相比,CD4+和CD8+细胞中不存在CA16核酸(图2A)。用同样方法从正常恒河猴外周血中分离CD4+、CD8+和CD20+细胞,进行CA16体外感染,病毒增殖过程分析表明CA16不感染CD4+、CD8+及CD20+细胞(图2B)。结果提示,在恒河猴PBMC中,T细胞不是CA16感染的靶细胞。同时,用抗CD20抗体检测从恒河猴PBMC中分离的B细胞,结果显示B细胞也不是CA16感染的敏感细胞,而作为对照的Vero细胞则有明显的病毒扩增趋势(图2B)。
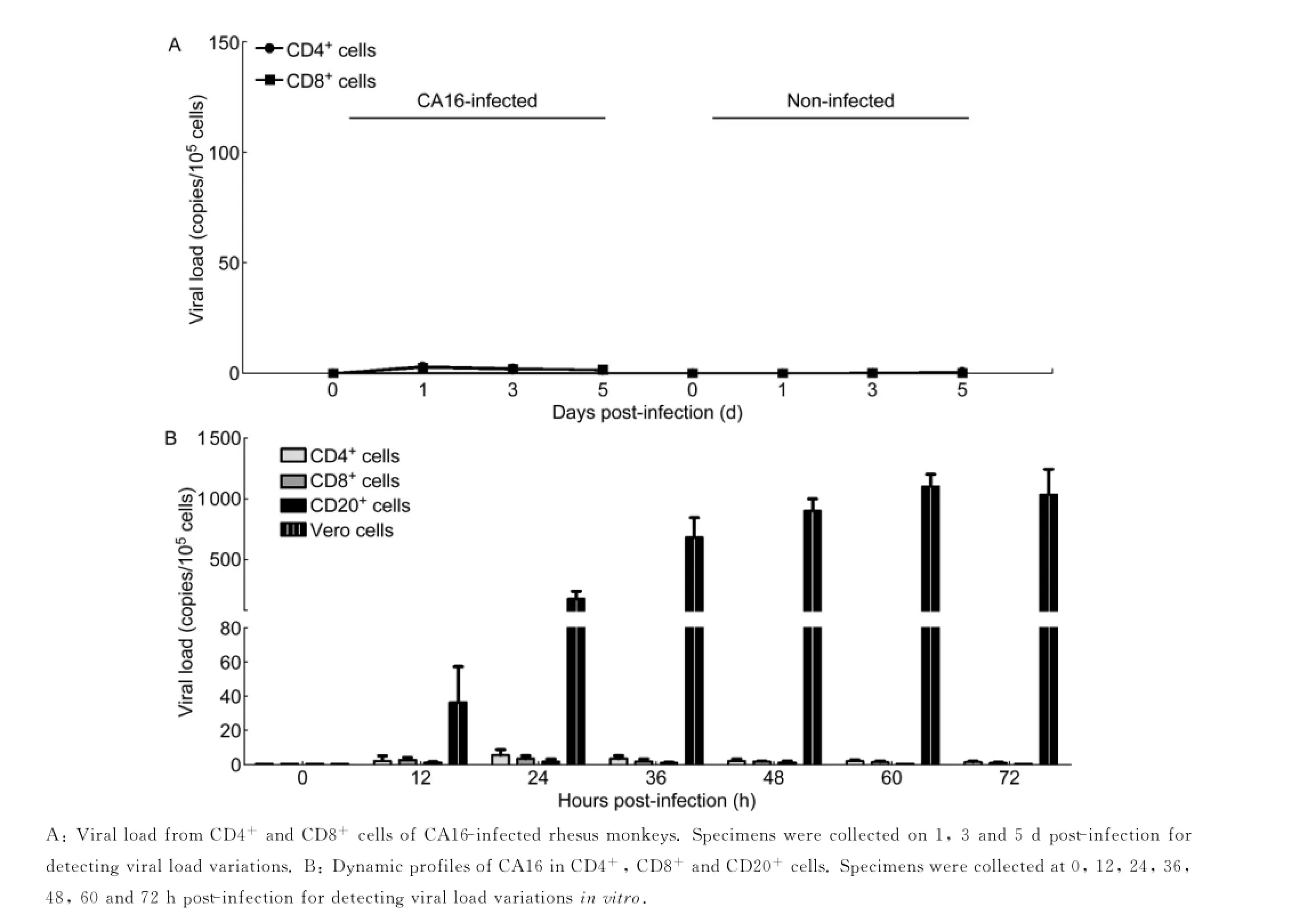
图2 CA16感染T和B细胞的分析Fig.2 Viral loads in lymphocytes from the blood of infected rhesus monkeys
2.3 CA16感染中性粒细胞及单核细胞的动力学分析
鉴于CA16对T、B细胞不敏感,本研究用CD16和CD14抗体磁珠分离技术分离恒河猴感染CA16后第1、3、5天PBMC中自然杀伤细胞(natural killer,NK细胞)的主要表面抗原CD16+群体和单核细胞主要表面抗原CD14+群体,检测病毒RNA基因。结果显示,NK细胞中CA16基因检测基本为阴性(图3A),而用CD14抗体分离的单核细胞中可见病毒载量轻度升高,病毒拷贝数在感染后第3天开始上升,均值高于100拷贝/105个细胞。在此基础上,用同样分离方法分离正常恒河猴的CD16+和CD14+细胞,体外感染CA16,检测病毒增殖情况。结果显示,病毒感染CD14+细胞后12~48 h可见病毒基因拷贝数轻度上升,而NK细胞仍为阴性(图3B)。此外,由于CD14也是部分DC的表面抗原,故进一步用抗HLA-DR抗体对CD14细胞分选,发现筛选后的细胞在CA16感染过程中病毒未增殖(图3C)。这些结果似乎提示,CA16可在部分CD14+细胞中增殖。
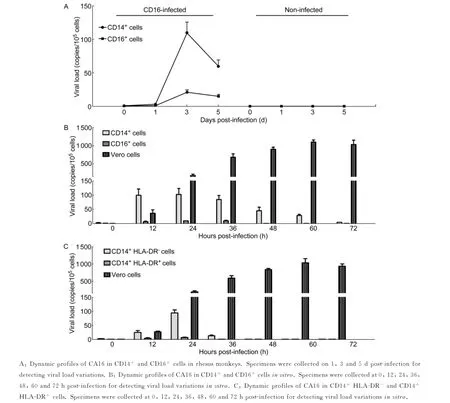
图3 CA16在CD14+和CD16+细胞中的增殖情况Fig.3 CA16 can be propagated in the proliferation of CD14+and CD16+cells
2.4 CA16对DC的感染分析
基于CA16仅对少量CD14+细胞感染的观察,本研究对同样能表达CD14的DC进行检测。首先,为准确分离DC,将来自正常恒河猴的PBMC经IL-4和GM-CSF诱导培养并经TNF-α刺激后,用CD83、CD86、CD40和HLA-DR抗体来确定是否培养成功。结果显示,恒河猴PBMC经适当刺激物刺激后,部分PBMC可刺激分化成DC(图4A)。在这些DC中进行CA16感染动力学分析,同时以PBMC和Vero细胞组为对照(图4B)。结果显示,CA16在24 h内即可快速感染PBMC,但很快病毒载量检测恢复为阴性。这段时间内病毒拷贝数值较低,均值约为100拷贝/105个细胞。病毒能在DC中形成具有动力学意义的增殖过程,出现峰值的时间为12~36 h,病毒载量均值为100~200拷贝/105个细胞,60 h后降至阴性。Vero细胞对照组则与前期研究相似,表现出典型的增殖动力学过程。
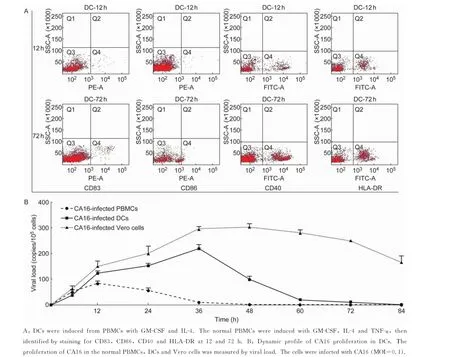
图4 CA16在DC中增殖的动态状况Fig.4 Dynamic profile of CA16 proliferation in DCs in vitro
3 讨论
CA16作为引起儿童HFMD的主要病原之一,尽管所致临床病理结果比EV71轻[10],但其较高的发病率和典型的手足口疱疹等临床特征具有明显的公共卫生意义[9]。因此,对其病理机制的认识,将有助于临床治疗及疫苗预防相关研究。由于有关CA16感染的病理分析大多来源于啮齿类动物实验[11],而啮齿类动物作为CA16疫苗的动物模型存在一定的不足[12],因此本研究探讨了CA16感染非人灵长类动物并将其作为致病机制研究模型的可能性。这些实验在一些临床观察的基础上[13],均提示CA16在感染恒河猴后可引起典型的病毒血症,即机体感染病毒后3~5 d内病毒可能以人们尚不清楚的方式开始增殖,至第7天时逐渐完成增殖过程。这一过程是否与人类感染CA16后所表现的相关临床症状有一定关系,需更多实验数据和临床研究的支持。本研究显示这一病毒血症的形成与病毒在PBMC某一群体中的增殖相关。进一步探讨CA16在PBMC群体中增殖的具体细胞载体,结果提示CA16主要增殖于DC,包括表面表达CD14+的DC;而在其他PBMC群体中,包括T、B细胞,NK细胞及中性粒细胞,CA16均没有明显增殖。这一现象为更深入认识CA16感染的病理机制提供了线索。
DC作为摄取入侵微生物的重要细胞,能通过抗原呈递而激活免疫系统中引起特异性免疫的功能细胞[14],具有控制免疫系统对入侵微生物产生有效免疫反应或无效免疫反应,甚至异常免疫反应的重要意义。而具有这一重要调控能力的细胞在CA16感染过程中可能出现的反应,很可能就包括了病毒感染过程的具体病理性因素。由此着手深入研究,有可能为研究CA16感染的发病机制提供重要参考。
[1] McMinn PC.An overview of the evolution of enterovirus 71 and its clinical and public health significance[J].FEMS Microbiol Rev,2002,26(1):91-107.
[2] Rabenau HF,Richter M,Doerr HW.Hand,foot and mouth disease:seroprevalence of Coxsackie A16 and Enterovirus 71 in Germany[J].Med Microbiol Immunol,2010,199(1):45-51.
[3] Ooi MH,Wong SC,Mohan A,Podin Y,Perera D,Clear D,del Sel S,Chieng CH,Tio PH,Cardosa MJ,Solomon T.Identification and validation of clinical predictors for the risk of neurological involvement in children with hand,foot,and mouth disease in Sarawak[J].BMC Infect Dis,2009,9:3.
[4] Chan LG,Parashar UD,Lye MS,Ong FG,Zaki SR,Alexander JP,Ho KK,Han LL,Pallansch MA,Suleiman AB,Jegathesan M,Anderson LJ.Deaths of children during an outbreak of hand,foot,and mouth disease in Sarawak,Malaysia:clinical and pathological characteristics of the disease.For the Outbreak Study Group[J].Clin Infect Dis,2000,31(3):678-683.
[5] Ishimaru Y,Nakano S,Yamaoka K,Takami S.Outbreaks of hand,foot,and mouth disease by enterovirus 71.High incidence of complication disorders of central nervous system[J].Arch Dis Child,1980,55(8):583-588.
[6] Lee TC,Guo HR,Su HJ,Yang YC,Chang HL,Chen KT.Diseases caused by enterovirus 71 infection[J].Pediatr Infect Dis J,2009,28(10):904-910.
[7] Huang XY,Kang K,Xu YL,Wei HY,Li XL,Ma H,You AG,Chen HM,Xu BL.Etiology surveillance of hand-footmouth disease in Henan province between2008 and2011[J].Zhonghua Yu Fang Yi Xue Za Zhi,2012,46(10):883-887.
[8] Zhang Y,Cui W,Liu L,Wang J,Zhao H,Liao Y,Na R,Dong C,Wang L,Xie Z,Gao J,Cui P,Zhang X,Li Q.Pathogenesis study of enterovirus 71 infection in rhesus monkeys[J].Lab Invest,2011,91(9):1337-1350.
[9] Wu PC,Huang LM,Kao CL,Fan TY,Cheng AL,Chang LY.An outbreak of coxsackievirus A16 infection:comparison with other enteroviruses in a preschool in Taipei[J].J Microbiol Immunol Infect,2010,43(4):271-277.
[10] Zhu RN,Qian Y,Deng J,Xing JF,Zhao LQ,Wang F,Liao B,Ren XX,Li Y,Zhang Q,Li J.Study on the association of hand,foot and mouth disease and enterovirus 71/CA16 among children in Beijing,2007[J].Zhonghua Liu Xing Bing Xue Za Zhi,2007,28(10):1004-1008.
[11] Cai Y,Liu Q,Huang X,Li D,Ku Z,Zhang Y,Huang Z.Active immunization with a Coxsackievirus A16 experimental inactivated vaccine induces neutralizing antibodies and protects mice against lethal infection[J].Vaccine,2013,31(18):2215-2221.
[12] Mao Q,Wang Y,Yao X,Bian L,Wu X,Xu M,Liang Z.Coxsackievirus A16:epidemiology,diagnosis,and vaccine[J].Hum Vaccin Immunother,2014,10(2):360-367.
[13] Wang J,Qi S,Zhang X,Zhang Y,Liu L,Che Y,He Z,Zhao Y,Lu S,Yu W,Li Q.Coxsackievirus A16 infection does not interfere with the specific immune response induced by an enterovirus 71 inactivated vaccine in rhesus monkeys[J].Vaccine,2014,32(35):4436-4442.
[14] Schulte BM,Kers-Rebel ED,Prosser AC,Galama JM,van Kuppeveld FJ,Adema GJ.Differential susceptibility and response of primary human myeloid BDCA1+dendritic cells to infection with different Enteroviruses[J].PLoS One,2013,8(4):e62502.
Study on proliferation of Coxsackievirus A16-infected peripheral blood mononuclear cells in rhesus monkeys
QI Su-Dong*,WANG Jing-Jing*,ZHANG Xiao-Long,SHEN Fei,LI Qi-Han,LI Yan-Yan,LIU Long-Ding,HE Zhan-Long
Institute of Medical Biology,Chinese Academy of Medicine Science/Peking Union Medical College,Yunnan Key Laboratory of Vaccine Research &Development on Severe Infectious Disease,Kunming 650118,China
Previous study suggested that primate animal model infected by Coxsackievirus A16(CA16)can display a significant viremia phase.This study was conducted for further analyzing the relationship between viremia and viral proliferation in peripheral blood mononuclear cell(PBMC)population.Firstly,the rhesus monkeys infected with CA16 were detected for the viral loads in CD4+,CD8+,CD20+,CD11c+,CD16+and CD14+cells from the PBMCs at different infectious stages,and the results revealed that CA16 could only propagate in some CD14+cells.Secondly,in the dendritic cells(DCs)derived from CD14+cells induced by granulocyte-macrophage colony stimulating factor(GM-CSF)and interleukin 4(IL-4),a significant viral proliferation dynamics could be observed with a viral load peak at 12-36 h post-infection(hpi).These findings will likely provide important information on the pathogenesis of CA16 infection.
Coxsackievirus A16;Rhesus monkey;Peripheral blood mononuclear cell;Infection;Proliferation dynamics
HE Zhan-Long,E-mail:hzl@imbcam.com.cn
2014-11-18)
云南省重点新产品生物重大科技专项(生物疫苗)(2012ZA009),“十二五”国家科技重大专项(2014ZX09102042001),云南省应用基础研究面上项目(2013FZ142)
和占龙
*同为第一作者
